造血细胞发育的3大阶段是根据细胞特点人为划分的。形态学可辨识细胞池中的细胞有明确的形态特征,其发育程序很清楚,早有图谱鉴别各种细胞及其成熟程度,为临床诊断提供了很有价值的手段。干细胞池中的细胞缺少分化特征,都表现为淋巴细胞样的单个核细胞,不能用形态学方法加以鉴别。从20世纪50年代初提出干细胞概念之后,直到1961年加拿大生物学家Till和McCulloch报道了脾结节形成方法,才能检测和计数干细胞。他们把小鼠骨髓细胞悬液静脉注入致死剂量辐射小鼠,7~8天后见受体小鼠脾表面出现许多结节。病理切片证明脾结节为各种细胞集落,其中约半数是幼稚红细胞集落。染色体研究证明,集落中的细胞为单克隆性质,表明各个集落都产生于单个细胞。作者根据集落细胞的多样性,认为形成集落的细胞具有多向分化能力,是干细胞,命名为脾集落形成单位(colony forming unit spleen,CFU-S)。以后有许多实验进一步证明了CFU-S的干细胞性质及其发育阶段。如取单个脾结节做成细胞悬液再移植,第2代受体小鼠脾脏中仍长出各种细胞集落,表明第1代脾结节中含有自我更新的多向分化潜能细胞。如果给受体小鼠造成多血症或注射红细胞生成素抗体,抑制红细胞生成,则脾结节中缺少红细胞集落,而未分化细胞集落增多,注射红细胞生成素后两天可使未分化细胞集落发育为红细胞集落,CFU-S的干细胞性质得到肯定后,CFU-S检测方法就成为判断干细胞数量和质量的经典方法。CFU-S检测结果证明成年小鼠骨髓中干细胞含量最高,其次是脾脏,也发现循环血液中有干细胞。
用此方法还检出了卵黄囊中的CFU-S及其迁移到胎肝和其他造血组织的过程。之后又发现CFU-S并非均一的细胞群体,它包含着多个发育阶段的造血干细胞。各个CFU-S在细胞大小、细胞密度、黏附性,以及自我更新和分化潜力方面都不完全一样。细胞移植后12天出现的脾结节(CFU-sd12),比8天出现的脾结节(CFUsd8)分化能力强。再移植实验证明CFU-sd12可向红系、粒系和巨核细胞系发育,但是它已失去向淋巴细胞系发育的潜力,可见CFU-sd12还不是多能干细胞。用有染色体标记的骨髓细胞做移植实验,发现另有淋巴细胞干细胞,具有分化为T淋巴细胞和B淋巴细胞的能力,而不能向髓系发育,它们也来自骨髓,提示骨髓中存在更未分化的多能干细胞。这种细胞具有自我更新和多向分化能力,移植到致死剂量辐射小鼠可使其骨髓和淋巴组织重建并长期存活,恢复功能。细胞移植实验也就成为检验多能造血干细胞的可靠手段。为了检测人多能造血干细胞,必须消除免疫反应才可使移植的细胞存活,经典的严重联合免疫缺陷(SCID)小鼠是良好的动物模型。能用于移植人造血干细胞并研究其发育潜力的动物,无胸腺免疫缺陷小鼠和胎羊,以及从SCID小鼠发展而来的NOD/SCID小鼠,人源化SCID-hu小鼠和转基因SCID小鼠。从小鼠骨髓长期培养方法发展而来的长期培养启动细胞(LTC-IC)检测也是实验室用来观察造血干细胞的常用手段,但是只有在体外培养12周后,还能启动骨髓长期培养体系的LTCIC才具有重建受损伤骨髓的能力。
上述方法为研究造血干细胞发育积累了丰富的数据,也为临床观察造血干细胞提供了可靠指标。但是这些方法都不能识别单个干细胞,能识别和分离干细胞的方法有赖于对造血干细胞表面分子的研究及其特异性单克隆抗体的制备。在小鼠造血系统中,表达sca-1和thy-1抗原的细胞具有干细胞的生理特征。用特异性单克隆抗体分离出来的sca-1+、thy-1+、Lin-细胞群通常是一些静止的细胞,能保护经致死剂量辐射小鼠度过骨髓衰竭期,在人造血系统中,CD34抗原是重要的分化标志,用单克隆抗体分离出来的CD34+CD38-细胞群处于有丝分裂周期中者极少,这种细胞在临床骨髓移植中广泛应用,可以重建受损伤的造血系统。但CD34+CD38-细胞并非骨髓中最早发育阶段的干细胞,1996年Osawa等报道了正常小鼠骨髓中的CD34-Lin-细胞群能重建经致死剂量辐射小鼠骨髓的结果,随后有一系列报道关于人CD34-Lin-细胞的研究结果,证明从人脐血、周血、骨髓或胎儿肝脏中分离出来的CD34-Lin-细胞比CD34+CD38-细胞更为原始,它们在SCID小鼠或胎羊体内分化为CD34+细胞并向髓系和淋巴系发育。1997年Miraglia等又从CD34+细胞表面找到一个新的分化标志AC133,它是一个具有5段穿膜结构的细胞表面分子,抗AC133单克隆抗体也因此成为分离造血干细胞用于临床治疗的抗体。比CD34和AC133更为早期的干细胞标志是血管内皮细胞生长因子受体2(VEGF-R2),实验证明用抗VEGF-R2单克隆抗体KDR分离的干细胞具有自我更新和多向分化功能,可使受损害的造血和免疫系统恢复,长期保持正常功能。骨髓中KDR+细胞只占CD34+细胞群的1%或更少,CD34-KDR+细胞是目前能分离出来的最早的多能干细胞。
多能干细胞经定向分化发育成定向干细胞,又称祖细胞,祖细胞的发育潜力有限,只能向各自的终末细胞发育。由于祖细胞增殖受控于细胞因子,所以祖细胞的发育过程及其数量可用半固体培养方法检测。在红细胞系统,有暴增性红细胞集落形成单位(burst forming unit,erythroid;BFU-E)和红细胞集落形成单位(colony forming unit,erythroid;CFU-E)。前者比后者幼稚,细胞表面受体种类较多,增殖潜力较强,能在红细胞生成素和干细胞因子或白细胞介素3的协同作用下形成多中心红细胞集落群体。CFU-E则只对红细胞生成素有反应,形成单个红细胞集落。在粒细胞和单核细胞系统,有粒-单核细胞集落形成单位(colony forming unit,granulocyte monocyte;CFU-GM)、粒细胞集落形成单位(colony forming unit,granulocyte;CFU-G)和单核细胞集落形成单位(colony forming unit,monocyte;CFU-M)。CFU-GM为粒系和单核系的共同祖细胞,能在粒单核细胞刺激因子的刺激下形成粒细胞和单核细胞的混合集落。CFU-G和CFU-M则分化程度更受限制,只能形成粒细胞集落和单核细胞集落。巨核系祖细胞也可根据其增殖潜力的差别分为暴增性巨核细胞集落形成单位(burst forming unit,megakaryocyte;BFU-Meg)和巨核细胞集落形成单位(colony forming unit,megakaryocyte;CFU-Meg)。从上述细胞发育过程中的相互关系可以制出造血细胞发育模式图。随着研究手段的不断改进,能检出的干细胞阶段增多,模式图也多种多样。下面是引自Quesenberry绘制的模式图(图1-1)。在模式图中,造血细胞早期发育阶段还增加了半固体培养和腹腔扩散盒培养中检出的原始细胞集落形成单位(colony forming unit, blast;CFU blast),包含4种髓细胞的混合细胞集落形成单位(colony forming unit,granulocyte-erythroid macrophage megakaryocyte;CFU-GEMM),高增殖潜力集落形成细胞(high proliferative potential colony forming cell,HPP-CFC)和扩散盒集落形成单位(colony forming unit,diffusion chamber,CFU-D)。再移植实验证明,它们属于不同发育阶段的祖细胞。这些分化阶段的检出有赖于新的细胞因子。近年来许多具有造血调节作用的细胞因子的发现和应用,丰富了造血调控的理论领域,从而开拓了细胞因子的临床应用前景。
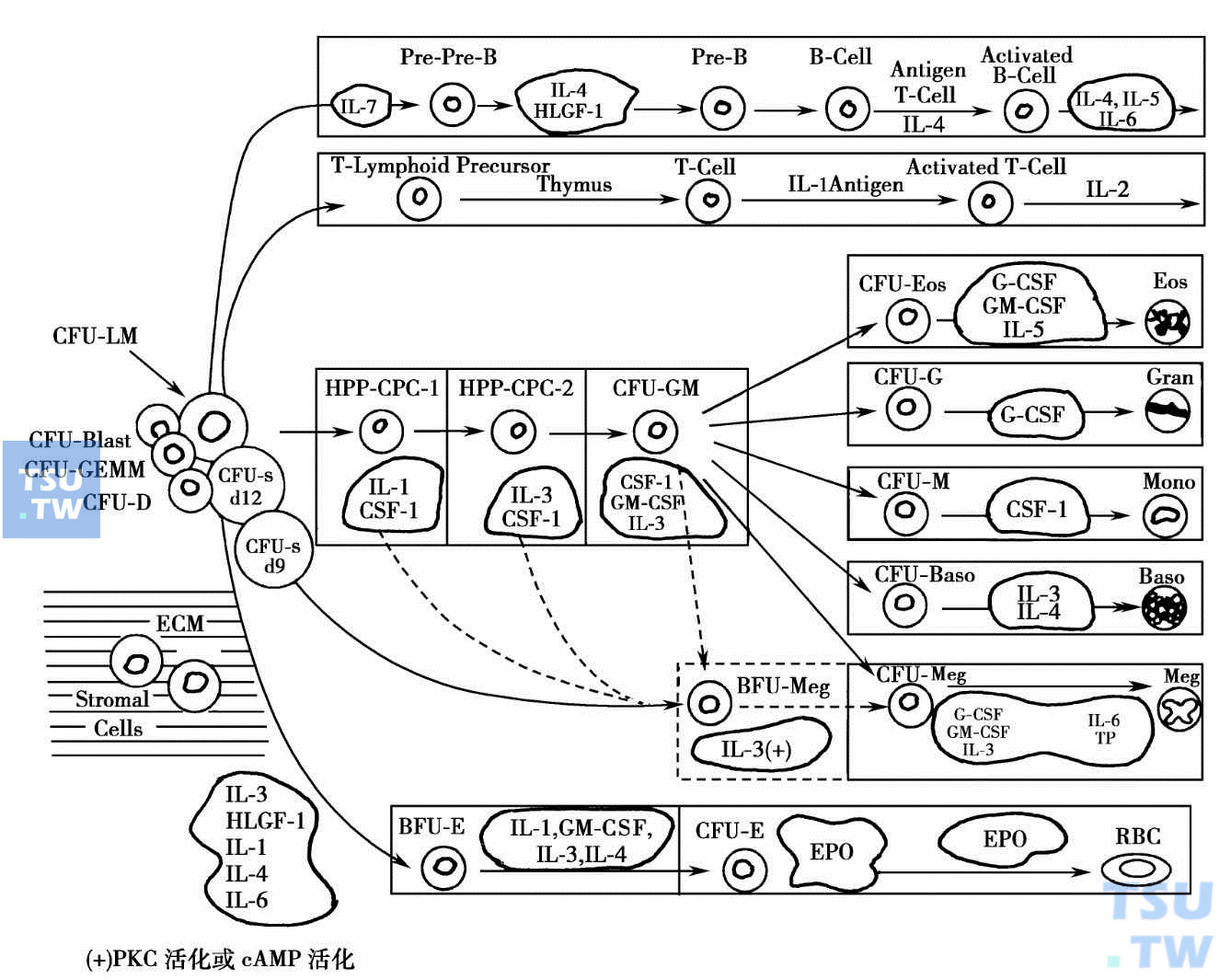
造血细胞发育模式:CFU-LM 淋-髓系集落形成单位 CFU-D 集落形成单位-扩散盒CFU-sd9集落形成单位-脾形成于第9天
各种祖细胞定向发育为终末功能细胞的过程也有其自身特点。最早的红系祖细胞BFU-E,表面受体种类繁多,受干细胞因子(stem cell factor,SCF)、白细胞介素3(interleukin-3,IL-3)或粒巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor,GM-CSF)刺激后,经过11~12次有丝分裂发育成为CFU-E。CFU-E是晚阶段红系祖细胞,其增殖和成熟受控于红细胞生成素(erythropoietin,EPO)。CFU-E受EPO刺激后再经过2~3次有丝分裂成为原始红细胞,进入形态学可辨认细胞阶段。正常状态下,形态学可辨认的幼稚红细胞有4次分裂,到晚幼红细胞阶段失去有丝分裂能力,进一步脱去固缩的核。无核的成熟红细胞寿命约100~120天,其中含有残留RNA者在煌焦油蓝染色下出现蓝色颗粒或蓝色丝状物,称为网织红细胞,是成熟红细胞中比较幼稚的阶段。外周血中出现过多网织红细胞提示红细胞生成处于应激状态。病理状态下,红细胞不能充分成熟和释放,称为无效造血。
最早的巨核系祖细胞BFU-Meg有很强的增殖能力,分化为CFU-Meg后增殖能力减低,在以后的发育过程中出现细胞核DNA倍增和分裂而胞质不分裂,使细胞由2倍体变为4倍体、8倍体、16倍体、32倍体,甚至64倍体和128倍体。各种多倍体巨核细胞都能通过胞质的迅速扩张和胞质中血小板形成发育为成熟巨核细胞,最后释放血小板,留下裸核。巨核系祖细胞表面有多种细胞因子受体,SCF、IL-3 和IL-11都是刺激早期巨核祖细胞增殖的重要细胞因子。晚期巨核祖细胞的增殖和成熟则受控于血小板生成素(thrombopoietin,TPO)。实验证明TPO能单独作用于CD34+、CD41+巨核祖细胞,刺激细胞分裂增殖,诱导血小板形成,使之发育为多倍体成熟巨核细胞。TPO的受体是原癌基因c-mpl的表达产物,被TPO识别和结合后进一步活化JAK2和JYK2酪氨酸激酶,从而使细胞内的许多STAT蛋白酪氨酸磷酸化。TPO及其受体的发现,为阐明细胞内信号传递机制提供了有用的模型。体内外实验结果证明TPO是一种具有临床应用价值的血小板刺激因子。
