骨髓是人体中最大的造血器官,它是一种海绵状、胶状或脂肪性组织,封闭于坚硬的骨髓腔内,可被骨小梁分开。骨髓分为红骨髓和黄骨髓两种,婴幼儿时期骨髓腔中充满红色骨髓,内含大量发育中的红细胞,造血十分活跃。约5岁以后,长骨骨干的骨髓腔内出现黄色骨髓,该转变过程是黄骨髓从远端呈向心性扩展,逐渐替代红骨髓,至成年人仅肱骨的上1/3和股骨的上1/3、颅底骨、胸骨、肋骨、肩胛骨、脊柱及髂骨仍为红骨髓。骨髓腔的重量出生时占体重的1. 4%,约65g,成年时则为体重的3. 5%~4. 6%,约1600~3700g,平均2800g。相应地,血容量出生时占体重的8%,成年仅为体重的7%。
骨髓的结构
骨髓由神经、血管、基质细胞等组成,其间充以各种造血细胞。
骨髓的神经
骨髓的神经来自脊神经和动脉,骨髓的全部动脉都有神经束伴行,神经束的分支缠绕动脉壁呈网状分布,神经纤维终于动脉的平滑肌。毛细血管只在其行程的某些部分与很细的无鞘神经纤维接触,这些神经纤维终于毛细血管或造血细胞间。骨髓的静脉系统也有神经,但比动脉少些,另一些孤立的神经束在骨皮质与中央静脉间平行前行,与许多血窦接触,终止于血窦内皮。无数无髓神经纤维自骨髓长轴伸向骨髓表面,有的终止于骨内膜,有的进入哈维管。组织化学方法证明,肾上腺能神经多见于动脉的外膜、中小静脉和血窦,胆碱能神经多见于大血管和骨髓实质中接近脂肪细胞和巨核细胞处。
位于造血组织中的无鞘神经纤维末端含有神经介质,可以影响造血。实验证明在外膜网状细胞中有神经生长因子受体的存在,在骨髓血管内皮细胞中有P物质的神经激肽(neurokinin)受体,而P物质是可以刺激骨髓祖细胞生长的,因此神经可能存在着对造血的调节。
骨髓的血管系统
骨髓有丰富的血管系统,骨髓的动脉和静脉以多种方式和途径进出骨髓,长骨有营养动脉,从骨干进入,还有从骨骺进入的骺动脉和干骺端动脉,扁骨和不规则骨的骨髓往往由营养动脉和骨膜动脉供应。以股骨为例,营养动脉从骨干近心端穿过营养孔进入骨皮质,在进入骨髓后,即分为升支与降支,升支较短,向骨骺延伸,并继续分支,降支沿长轴中心延伸至另一侧骨骺端也继续分支;升支、降支在长骨两端与骨骺动脉分支吻合,营养骨骺部的骨髓,最后进入骨组织。位于骨长轴中心的升支、降支,也分出分支,自中心向骨髓周边放射状排列,造血组织附近再分支成动脉毛细血管,与血窦相连。此外,还有许多小动脉入骨组织营养骨,其中有些血管可以回到骨髓与血窦相连。丰富的血窦彼此相连,汇合成集合静脉,多以辐射状向心走行,汇入中央静脉,中央静脉沿骨长轴延伸,与营养动脉相伴,最后从营养孔走出骨髓腔。血窦间充满骨髓的实质,称为造血索,造血索由造血组织组成。也可夹杂脂肪组织或胶质,但脂肪常在骨髓的周边。骨髓的血循环与骨皮质的关系十分密切,多数骨髓的毛细血管先进入骨皮质的哈佛管,再返回骨髓,连接于血窦。在骨髓的再生中哈佛管起细胞蓄存库的作用,在哈佛管中聚集有造血干细胞和其他体细胞,这些细胞可以通过相互联系的血管提供骨髓。
血窦形状不规则,直径大小不等,约25~35μm。血窦壁由内皮细胞、基底膜和外膜网状细胞(周细胞)组成。
血窦壁的内皮细胞扁平而宽大,覆盖着窦腔的内表面,整个细胞呈梭形,核常膨向窦腔内,细胞宽而扁,周边的胞质较薄,厚度在2~3μm以下。胞质内含线粒体,高尔基体,核糖体,微丝,微管,吞饮泡等。内皮细胞间的连接有两种方式:①互相重叠(overlaping);②互相交错对插(interdigitating),这种连接方式与骨髓外血管内皮细胞不同,它不是紧密连接,可以互相滑动,有利于血窦的扩张和收缩。这种连接的不牢固性是骨髓内皮细胞的特点。
在变薄的内皮细胞胞质上可形成不连续隔膜窗(fenestra with diaphragm),隔膜窗只有两层胞膜的厚度,这些有隔膜的区域可能是成熟血细胞穿过窦壁进入外周血的地方,血细胞通过后血窦立即修复。
内皮细胞是髓血屏障的主要组成部分,有活跃的内吞作用,可控制化学物质进入髓索和释放成熟红细胞到外周血中去。血液中颗粒状物质被内皮细胞内吞,首先通过有网格蛋白衣被小凹(clathrincoated pits),颗粒的摄取可能通过受体介导或血浆白蛋白结合到颗粒表面而产生,有些窦壁变得很薄,小颗粒可直接由循环血进入造血间隙。与内吞作用有关的还有溶酶体、吞噬体、转化小管和隔膜窗。研究证明血窦内皮细胞腔面表达vWF抗原(von Willebrand factor antigen)、Ⅳ型胶原和层粘连蛋白(laminin),分布着唾液酸和其他糖物质,它的分布不连续,常围绕着隔膜窗和有外衣的内吞泡,因此认为这些糖可能与内皮细胞的膜功能有关。
内皮细胞的基底膜是断续的、一层无定形颗粒状物,主要由层粘连蛋白和Ⅳ型胶原组成。
外膜是由外膜网状细胞(又称周细胞)组成,呈不连续分布,胞突的一面包绕血窦内皮,另一面伸出长长的突起穿行于造血细胞之间,二者紧密接触覆盖血窦外表面的60%;该网状细胞胞质容量很大,在某种条件下(如给动物注射内毒素)网状细胞突起覆盖区域可明显减少,可在20%以下,此时血细胞会有更多机会进入血窦。
窦外膜网状细胞合成网状(嗜银)纤维,与它的胞质突起一起伸入到造血组织中,构成了支持造血的网。
外膜网状细胞膜有很强的碱性磷酸酶的阳性反应,表达CD10、CD13和HLA-Ⅰ类抗原;表达神经生长因子受体;含有α-平滑肌肌动蛋白、波形蛋白、层粘连蛋白、纤维连接蛋白和Ⅰ型、Ⅲ型和Ⅳ型胶原;CD34阴性。
骨髓的基质细胞
基质细胞主要由内皮样细胞、成纤维细胞、脂肪细胞、巨噬细胞、骨细胞、基质干细胞等组成。
一、内皮细胞
血管内皮细胞不仅仅是充当血管内壁和血液间的机械屏障,而且是造血微环境(hematopoietic microenviroment,HME)中重要的基质成分,与造血细胞有密切的解剖关系,它是体内、体外维持造血的基本成分。内皮细胞在体外培养间接反映了体内造血微环境的状况,为研究骨髓造血提供了一个有用的体外模型。体外培养的内皮细胞在光镜下显示胞体大,呈多角形、不规则形,胞质丰富,偶见颗粒,核呈圆形,染色质浓集,核仁明显。电镜下可见外形和核极不规则,有多处深凹陷,核中以常染色质为主,有多个核仁,胞质中有基质深的长形线粒体和电子密度不等的圆形颗粒,部分内皮细胞可见杆状的W-P小体(Weibel-Palade body)。
最近一系列的研究证明,造血微环境中的血管内皮细胞,特别是微血管内皮细胞在造血祖细胞的增殖和系特异性分化中起关键性作用。以下实验证实这一点,胎肝激酶(fetal liver kinases,FLK-1)是血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)的受体,当小鼠缺乏FLK-1时,则不能形成造血岛,发育至8. 5~9. 5天,会死于子宫内;这主要是由于胎胚中不能形成血管,因此也就不能造血,这些材料说明造血干细胞与内皮细胞间的互相作用对于干细胞的自我更新和扩增可能是很关键的条件。体外实验还证明,造血祖细胞与内皮细胞直接接触,7天后可使祖细胞数量扩增5倍,骨髓内皮细胞系BMEC-1也可以支持来自脐带血的CD34+细胞扩增,无论造血地点如何改变,从卵黄囊到胎儿肝和脾还是最后停留于成人骨髓,造血干细胞与微血管内皮细胞之间密切的相互作用关系始终保持不变。
内皮细胞产生的生长因子
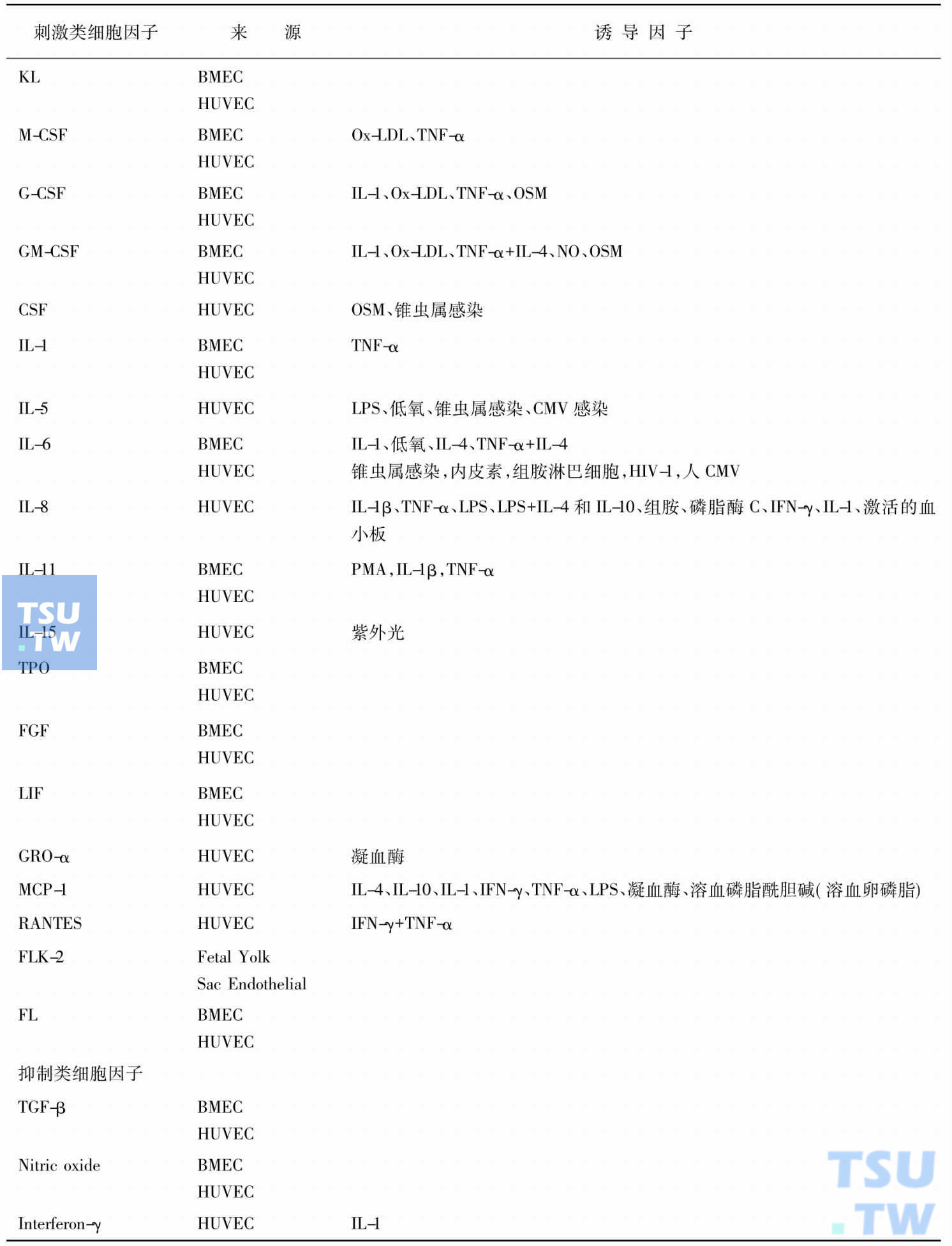
注:HUVEC,人脐静脉内皮细胞(human umbilical vein endothelial cells);BMEC,骨髓内皮细胞(bone marrow endothelial cells);胚胎卵黄囊内皮细胞(fatal yolk sac endothelial)
骨髓造血微环境中的微血管内皮细胞可生成多种生长因子(上表),参与干/祖细胞的特异性分化。内皮细胞还产生大量黏附分子,调节造血细胞的增殖和分化,使造血细胞黏附于特定的区域,选择性的将一些造血生长因子(如IL-3和GM-CSF等)与带有相应受体的干/祖细胞黏附于基质细胞表面。细胞与细胞,细胞与细胞外基质间黏附相互作用是造血调控的重要机制之一,造血细胞表面的黏附分子与基质细胞表面的相应配体之间的相互识别作用和信号传导,是这种细胞间相互作用的分子基础。细胞黏附分子参与造血调控的机制可能是:①促进造血细胞表达更多的造血因子受体,增加造血细胞对造血因子刺激的敏感性;②促进造血细胞分泌造血因子。总之,在造血微环境中,内皮细胞提供了一个有利于造血干细胞自我更新、增殖和分化的环境。在此,内皮细胞不仅控制着造血祖细胞的穿行和归巢(homing),而且提供细胞间的相互沟通和分泌细胞因子,从而保证造血的稳定状态。综上所述,内皮细胞参与造血调控的方式是:①分泌造血生长因子;②分泌细胞黏附分子介导细胞外基质与造血细胞的黏附;③内皮细胞与造血细胞的直接接触。在人骨髓和人骨髓长期培养中均可看到内皮样细胞包绕造血细胞,这是二者进行直接接触的方式之一。
二、成纤维细胞
呈梭形,有1~2个核,胞质中含丰富的粗面内质网和大量微丝束。有伸出的胞质突起,它表达CD10、CD29、CD44、CD44a、CD49e、VCAM-1,胶原Ⅰ、Ⅲ、Ⅳ,碱性磷酸酶,波形蛋白(vimentin),层粘连蛋白(laminin)和纤维连接蛋白;成纤维细胞还表达α-平滑肌-1抗原和平滑肌肌浆球蛋白,所以又称肌纤维细胞。成纤维细胞可分泌多种生长因子,如IL-1、IL-6、IL-7、IL-8、M-CSF、G-CSF、GM-CSF、SCF、IFN-β,也可受多种生长因子的刺激,如IL-1、IL-6、IL-7、G-CSF、IFN-γ、PDGF、TGF-β、TNF-α。成纤维细胞定位于骨髓的造血索中,常与不成熟的粒细胞接触,因此认为这两种细胞在功能上有密切的联系。成纤维细胞的滋养层支持祖细胞向粒细胞和淋巴细胞分化,由其他非造血器官来的成纤维细胞常常不支持造血。
三、巨噬细胞(吞噬细胞)
核不规则,胞质中有溶酶体颗粒和残渣小体,外形不规则,可伸出长的突起与幼稚细胞接触。酸性磷酸酶为阳性反应,其表面特异性抗原为7/4、Mac-1和F4/80,还表达碱性磷酸酶和部分粒系标志,生长缓慢,用CSF-1刺激则生长好。骨髓中的巨噬细胞具有活跃的吞噬功能和防御功能。当异物、细菌、毒物侵入时,巨噬细胞参与吞噬和清除,如给动物注入活体染料后,红骨髓可吞噬和清除大量染料;巨噬细胞还能清除损伤的和衰老的红细胞碎片,它还可以吞噬晚幼红细胞脱出的核,TNF-α和NO是巨噬细胞发挥杀伤作用的主要效应因子。经肿瘤抗原刺激后分泌的TNF-α可能是骨髓基质细胞抑制白血病生长的重要因素之一。最近报道巨噬细胞和淋巴细胞通过生长因子的产生和细胞间的相互作用形成造血微环境的一部分。巨噬细胞是干细胞刺激因子(如IL-1)和抑制因子(如巨噬细胞炎症蛋白1-α和TNF-α)的来源。在局部控制造血中起重要作用。血小板来源的生长因子PDGF促使巨噬细胞表达PDGF受体,上调白介素1的分泌。从而激活早期的造血细胞。巨噬细胞还可调节细胞外基质的结构和成分,以及纤维粘连蛋白(fibronectin)的含量。巨噬细胞常位于红细胞造血岛的中央,是给红细胞提供铁的保姆细胞。此外,巨噬细胞常位于血窦旁,它可以伸出突起穿越内皮细胞壁,清除血液循环中的无效红细胞等。巨噬细胞的第三种位置是在造血细胞之间。
四、脂肪细胞
来源于成纤维细胞或外膜网状细胞,在体外人和小鼠的成纤维细胞可转化为脂肪细胞,脂肪细胞也可转化为成纤维细胞。脂酶和PAS染色阳性,苏丹黑和Oil red染色阳性。其胞质中含大量脂滴,核常被挤到一侧,它多位于窦旁。脂肪细胞减少了造血空间,压迫血管,使血管变窄,甚至呈丝状。一旦机体需要,脂肪细胞可以失去脂肪,使血窦重新形成,造血得以恢复。骨髓中的脂肪细胞不像其他部位的脂肪细胞急性饥饿时分解,骨髓中的脂肪细胞体积小,饱和脂肪酸含量低,在组化上与其他地方的脂肪细胞也不同。
五、骨细胞
成骨细胞、破骨细胞和骨内膜细胞均在造血中起一定作用,骨形成祖细胞类似基质前体细胞,位于非黏附骨髓细胞中,CD34阴性;基质细胞在体内、体外均能形成骨,基质细胞和成骨细胞能分泌TGF-β,并对其产生反应,将其移入骨头可形成稳定的早期干细胞的造血微环境。造血细胞的分化是在骨髓腔中靠近成骨细胞处进行的,因此推测成骨细胞和造血细胞之间存在着特殊的关系。近年工作证明,第一,分离出来的人的成骨细胞可以持续合成以下生长因子的mRNA:G-CSF、GM-CSF、IL-1、LT、TGF-β、TNF-α、LIF、M-CSF;第二,在骨髓长期培养中,类似成骨细胞的细胞可以支持粒细胞的生成;第三,成骨细胞的免疫表型特征与基质细胞类似。因此,认为成骨细胞可能是造血微环境的成员之一。
六、基质干细胞
在骨髓的基质细胞中含有少量的基质干细胞,在一定条件下可分化成成纤维细胞、成骨细胞、脂肪细胞、内皮细胞、肌肉细胞。目前,对其特异表面标志还存在争议,有人认为基质细胞存在于CD34+、CD38-、HLA-DR的亚群中,或存在于CD34+、Stro-1+的亚群中,也有学者认为存在于CD34-的亚群中,需要今后进一步的工作确定。
细胞外基质(extracellular matrix,ECM)
ECM主要由三类大分子物质组成:糖蛋白、蛋白多糖和胶原,它不是被动无活力的结构支架,而是传递和接受信息的物质基础,造血细胞对ECM的特异性识别是血细胞增殖分化的第一步,造血细胞对基质的黏附决定它在基质微环境中的地位。现分述如下:
一、糖蛋白(glycoproteins)
目前已知的有纤维连接蛋白(fibronectin,FN)、血细胞粘连蛋白(hemonectin,HN)、层粘连蛋白(laminin,LN)等。
1)纤维连接蛋白:是一种黏附分子,主要由成纤维细胞产生,它是存在于多种细胞表面、基质及血浆中的一种糖蛋白,是骨髓基质中主要纤维成分,它可连接各种细胞、生长因子和其他ECM分子,与细胞黏附、迁移、分化等的作用有关,与造血细胞的关系十分密切。红系祖细胞膜上的VLA5(α5β1)与FN的RGD短肽结合,RGD短肽可以抑制红系祖细胞与FN的结合,证实了VLA5是红系祖细胞FN的受体。随着红系祖细胞的成熟,细胞表面FN的受体逐渐改变或减少,与FN结合的能力逐渐降低,正常人的成熟红细胞则不能与FN结合。
实验证明,FN可以把骨髓前体细胞锚定于特定的、有利于它生长的造血微环境中,FN还可促进造血祖细胞的增殖,促进CFU-MIX、CFU-E及BFU-E克隆的大量生长,FN还可以提高红系前体细胞对红细胞生成素(EPO)的敏感性。
2)血细胞粘连蛋白:是从骨髓中分离出的一种60kD糖蛋白,出生后在其他组织如乳腺、肾、脾中均不含这种蛋白,它可促进造血细胞的增殖和分化,黏附于血细胞粘连蛋白的绝大多数是粒细胞系统,因此,它与粒细胞造血有密切的关系。在胚胎时期,随着造血的迁移,先后在卵黄囊、肝、脾和骨髓中出现,从而在不同组织中参与造血。实验证明,HN介导粒系对ECM的黏附。用早幼粒细胞HL-60观察发现,未诱导的HL-60有60%黏附于HN,而分化后仅30%黏附于HN。另外,骨髓干细胞和骨髓祖细胞与外周血的粒细胞比较,对HN的黏附能力增强10倍,说明HN的黏附与粒细胞系的分化成熟有关,对HN黏附能力的下降可能是成熟粒细胞进入血循环的原因。
3)层粘连蛋白:是由内皮细胞产生的非胶原糖蛋白,与Ⅳ型胶原、硫酸肝素等共同组成血管内皮下基底膜,这是肿瘤细胞扩散的重要屏障。研究发现成熟中性粒细胞表面68kD糖蛋白为LN受体,其表达与炎症反应时中性粒细胞聚集于血管基底膜现象有关,层粘连蛋白可促进白细胞的趋化作用。
二、蛋白多糖(proteoglycans,PG)
旧称黏蛋白,是由许多氨基葡聚糖(glycosaminoglycans,GAG)侧链共价连接核心蛋白组成。近10年来PG的研究工作飞速发展,它不仅是细胞间填充物,还具有活跃的生物学活性,可主动参与和影响细胞的各种行为,并对机体的多种生理和病理过程发生作用。在骨髓中PG分布于外膜网状细胞的表面和细胞外基质中,有调节造血细胞增殖的作用,与粒细胞对基质细胞的黏附作用也有密切的关系。实验证明,成熟粒细胞只有经过透明质酸处理,清除GAG的阻断才能黏着基质细胞层。PG中的硫酸肝素(HSPG)可以结合从基质细胞中分泌的GM-CSF。实验证明ECM某些有PG的区域中的GM-CSF的密度要比基质细胞表面的高,证明PG对GM-CSF具有局部浓缩的作用,以传递特异性的分化信息。另外HSPG也介导造血祖细胞与基质细胞的结合,这种定位生长因子和介导细胞相互作用的性能,在造血细胞系特异性分化过程中至关重要。PG中还有硫酸软骨素(CS)、透明质酸(HC)等也与造血有关,最近发现CD44也是一种膜表面PG,参与淋巴细胞的活化、归巢、分化等。
三、胶原
骨髓中胶原主要是Ⅰ、Ⅲ、Ⅳ和Ⅵ型胶原,还有少量Ⅴ型胶原。Ⅰ型胶原为粗大纤维素,Ⅲ型胶原为微细的原纤维,均由成纤维细胞产生,Ⅳ型胶原为网络样结构,是基底膜的主要成分,由内皮细胞产生。双标记免疫电镜证实Ⅴ型胶原常存于Ⅰ、Ⅲ型胶原核心部,其含量甚微,但与纤维化过程的启动机制有关。近年的研究指出,正常CFU-GM、BFU-E均特异性地与Ⅰ型胶原结合,外周血中中性粒细胞和单核细胞也有30%左右与Ⅰ型胶原结合。
ECM成分不但很多,且彼此之间有着密切的联系,这些不同成分间还可互相连接,如FN具有连接硫酸肝素和胶原的部位,层粘连蛋白可连接Ⅳ型胶原和肝素,从而使ECM得以担负繁杂的生物功能。
骨髓的造血细胞
一、红细胞系统及红系
造血岛幼稚红细胞位于血窦及脂肪细胞之间,成群存在,这种成群的幼稚红细胞称之为红细胞造血岛,是红细胞生成的功能和解剖单位,其中心为1~2个巨噬细胞;相差显微镜下可以看到巨噬细胞胞质围绕着有核红细胞快速运动并与之密切接触,造血岛外层的细胞较内层更成熟,中心的巨噬细胞伸出长长的突起包绕着幼稚红细胞,有核红细胞逐渐成熟,就离开巨噬细胞主体,贴近血窦,脱核后成为网织红细胞,通过内皮细胞进入血窦,脱下的核被巨噬细胞吞噬。
在慢性缺氧或溶血性贫血时,由于受缺氧或红细胞生成的刺激,在外周血中也可以发现有核红细胞。
二、粒细胞系统
位于造血索中部,远离血窦,粒系干/祖细胞在骨内膜下的髓索较多。骨髓中幼稚粒细胞与外膜网状细胞突起密切接触,通过lectin样黏附分子“锚”于外膜网状细胞表面,随着细胞成熟这些黏附分子逐渐消失,便于粒细胞向血窦壁运动。骨髓中成熟粒细胞表面的这种糖蛋白的改变,有利于与内皮的接触。当其进入窦腔时,首先是部分胞质进入和穿过内皮细胞,细胞变形后进入窦腔,粒细胞的核由于有分叶,通过窦壁时不需要有明显变形。与网织红细胞一样,进入窦腔的部分往往靠近内皮细胞的连接处。
三、巨核细胞系统
巨核细胞也分布在骨髓内血窦的外侧,这种不连续的空间结构的分布,取决于相互间特异的黏附和给不同的细胞系提供特异性的生长因子,巨核细胞与血窦间的密切关系可能与局部产生协同生长因子如白细胞介素-11、Kit-ligand、白介素6和LIF有关,所有这些都将影响巨核细胞的发育。
四、淋巴细胞和巨噬细胞
集中于动脉附近造血索的中央。
计算机三维结构重建分析,确认人骨髓巨核细胞靠近血窦壁,而粒细胞则位于中央动脉壁周围。红细胞主要位于血窦壁周围,形成造血索。基于以上认识,目前认为中央动脉、血窦和造血索共同构成骨髓的单元结构,作为骨髓的功能结构单位,含脂肪细胞基质成分,巨噬细胞和造血干细胞的球样小体称为造血元(hematon)。
骨髓细胞的黏附与归巢
近来发现,造血干/祖细胞(HSPC)的膜表面有很多黏附分子(adhesive molecule,AM)表达,黏附分子可以介导细胞-细胞或细胞-基质之间相互接触和结合。在HSPC表达的黏附分子共有6种:
- β1组,整合素家族,极迟出现的抗原VLA-1~6均有表达,其中VLA-5/5(CD49d/CD29和CD49e/CD29)表达量较大;β2组,主要是淋巴细胞相关抗原(LFA)-1(CD11a/CD18)。
- 免疫球蛋白(Ig)超家族LFA2、3及细胞间黏附分子(ICAM)-1、2、3等。
- 选择素家族(CD62)L-选择素和P-选择素。
- 依赖钙离子的黏附分子如P-cadherin等。
- 唾液粘蛋白家族CD15、CD15s、CD164等。
- CD44分子。
HSPC上的黏附分子在基质细胞和细胞外基质上都有相应的配体,二者的黏附可以使HSPC铆钉于造血微环境中,使其处于有利位置以便受基质细胞分泌因子的作用。VLA-4与VCAM-1、VLA-5与纤维粘连蛋白(FN)、LFA-1与ICAM间相互作用,是HSPC黏附于基质的主要原因,特别提出基质细胞来源的趋化因子SDF-1可使HSPC与骨髓基质的流动性黏附变为牢固性黏附。细胞的黏附有利于对造血的正常增殖、分化的维持。在干细胞移植中HSPC归巢要通过与内皮细胞的黏附,在其上移动,在骨髓腔移动及与骨髓基质黏附的过程。因此,HSPC归巢虽然不是单纯黏附分子的介导,它也起着相当重要的作用。
骨髓的髓血屏障和细胞的释放
骨髓的髓血屏障(marrow-blood barrier,MBB)和细胞的释放。人的血细胞产生于骨髓的髓索中,成熟的血细胞进入血液循环中必须穿越MBB,每天约2×1011红细胞、1×1010粒细胞、4×1011血小板穿越MBB进入血循环,单核细胞、淋巴细胞也是如此。血中的造血干细胞营养也要经过MBB。
MBB的结构主要由血窦(内皮、颗粒状基底膜、外皮)构成,由于外皮层是不连续的,它覆盖内皮细胞的程度是变化的,与穿越MBB的细胞数量成反比;当溶血、失血时,外皮细胞覆盖面明显减少,此时由其他细胞共同构成MBB。
在没有外皮细胞覆盖的窦壁部位,脂肪细胞、巨核细胞和窦周巨噬细胞可代替外皮细胞的功能。脂肪细胞本身来自蓄积脂肪的外皮细胞,巨核细胞常位于窦腔外面,它可伸出胞质突起穿越内皮细胞,突起内无细胞器,使巨核细胞固定在血窦壁上,突起可从血循环中获得信息。巨核细胞有引入作用(emperipolesis),血细胞可以通过巨核细胞进入血窦,故在某些情况下在巨核细胞胞质内常见完整的造血细胞,多数为红系细胞,也有粒细胞等,这两种细胞胞膜完整;在有失血等情况下,巨核细胞胞质内幼稚细胞、网织红细胞明显增加,故推测当机体需大量细胞从骨髓释放入血循环时,部分细胞则经巨核细胞进入血窦。
血细胞由髓索进入血循环,不是在血窦内皮细胞间的连接处,而是在其附近形成一个孔(又称隔膜窗),进入血窦的细胞推压内皮细胞外膜与内膜某点融合,然后裂开,形成膜孔——即细胞进入血窦的通道,细胞通过后,膜孔闭合。推动血细胞进入血窦的压力来自动脉,它足以使血细胞穿越窦壁。膜孔直径2~3μm,穿过膜孔的细胞必须发生变形,由于幼稚红细胞的核不能变形,不能通过MBB,只有网织红细胞才能通过膜孔,而核留在造血索内,称之为骨髓的“摘除”功能。在某些血液病和肿瘤时,血中出现幼稚细胞提示MBB受损。
血细胞的生成与释放的调节可能是通过体液因子——各种糖蛋白,如红细胞生成素(erythropoietin)、集落刺激因子(colony stimulating factor,CSF)、血小板生成素(thrombopoietin)等,它们能增加产出,也能促进释放。已知粒细胞释放因子是粒细胞集落刺激因子(G-CSF);粒-巨噬细胞集落刺激因子(GMCSF)、转化生长因子-β(TGF-β)、白介素8、C3e补体、糖皮质激素、雄激素和内毒素。中性粒细胞减少的动物,血浆含粒细胞释放因子,很像G-CSF。血小板和网织红细胞释放因子很难确认,其生物学意义也不大。不成熟粒细胞通过凝集素样黏附分子铆钉于外膜网状细胞,在细胞的成熟过程中,这些黏附分子逐渐丢失,粒细胞可以向血窦壁移动,并与内皮细胞接触,最后进入血窦。
血小板释放是巨核细胞胞质穿过内皮细胞与胞体分离并进入血窦形成复合血小板碎片(multiplatelet)或前血小板(proplatelet),呈长豆荚形结构,可在血窦腔中见到,这些最后都变成单个血小板,释放血小板后的巨核细胞核仍留在骨髓中最后退化并被吞噬。由于血小板在骨髓中几乎没有储备,当血细胞大量丢失时,血小板恢复很慢。
关于微粒物质通过血髓屏障问题,已证明骨髓内直径28nm的碳粒可在3分钟内穿过MBB进入血循环。骨髓移植需要大量干/祖细胞进入造血索(穿越髓血屏障),有学者在小鼠注射环磷酰胺引起骨髓血窦内皮细胞损伤和胞膜的不稳定性,如窦腔内膜的脱落、空泡化,窦内皮细胞不完整,使干/祖细胞易于进入骨髓。膜不稳定性的机制,一方面是由于脂质的过氧化作用,使膜流动性增强,从而增强通透性;另一方面,脂质层中间的蛋白质侧向运动,使部分膜蛋白质缺乏,使膜产生融合倾向,形成空泡,反复膜融合使内皮细胞膜断裂,为干祖细胞进入打开缺口。
骨髓的功能
一、造血:成人中的红细胞、粒细胞、血小板和部分淋巴细胞都由红骨髓生成,每天生产的红细胞数约为1011/ kg,粒细胞约为1. 6×109/kg,人B淋巴细胞也是由骨髓产生。
二、防御功能:红骨髓中的巨噬细胞可以吞噬细菌、毒物。另外,衰老的红细胞也由巨噬细胞清除,特别在溶血性贫血时,可见大量巨噬细胞,其胞质内含有大量次级溶酶体。血红蛋白所含的铁由巨噬细胞储存,待重新利用。
三、免疫功能:骨髓是B淋巴细胞的产生地,并向胸腺提供造血干细胞,在胸腺发育成T淋巴细胞。骨髓中还有浆细胞,可分泌免疫球蛋白。
四、其他功能:骨髓中含有未分化的间充质细胞、成纤维细胞,以及成骨细胞、破骨细胞等,具有一定创伤修复及成骨作用。
