遗传病的基因诊断也适用于血液遗传病。本段在举例中将尽量结合血液病加以讨论。
基因诊断的基本依据是,生物的体细胞中含有该生物体的全部遗传信息。个体如果患有某种遗传病,则所有体细胞都带有这种致病基因。因而只要检测外周血、胚胎或胎儿的皮肤、羊水或绒毛细胞,脐带血,则可查出是否患有该病,或为该病的携带者。由于基因诊断是在发病前已经作出,故这种诊断法也称为“逆向诊断法”(reverse diagnosis)。
基因诊断的基本方法
一、DNA探针杂交是早期基因诊断技术的基础。诸如:DNA探针的制备(缺口翻译、末端标记)、核酸分子杂交(southern blot hybridization)、斑点杂交(dot blotting)和寡核苷酸探针杂交等。这些早期建立的方法,目前已经较少应用,它比较烦琐,经济和时间的耗费也多,还不能精确的基因病变的部位和性质。但是如果与下面介绍的PCR法结合起来,它们的价值仍然不可低估。例如使用于β地中海贫血的反向点杂交、PCR-ASO法(见后),又如检测α地中海贫血基因缺失或重复,结合内切酶(endonuclease)使用的核酸分子杂交法等。
二、聚合酶链反应(polymerase chain reaction,PCR)是1985年建立的具有划时代意义的一种新技术,后来在此基础上,发展和衍生了很多新的技术。这种技术的特点是,在短时间内,可以将感兴趣的一段DNA扩增到几百万个拷贝,使这段DNA通过显色,用肉眼都可以观察到。如果观察不到,则表示该基因组中缺失了这段DNA,如果位置(片段大小)发生了改变,则代表该基因发生了这样那样的突变。PCR技术有了很大的发展和开发出很多方面的用途,在这个基本原理的基础上建立了许多新方法。PCR的基本原理起源于DNA复制及核酸的变性与复性,现已经成为分子生物学实验室的常规技术,此不赘述。
PCR实验中,先根据需要扩增的DNA片段,从5'到3'的顺序合成一对大约20个碱基的寡核苷酸作为引物(primer)。反应体系含4种单核苷酸(dATP,dCTP,dTTP,dGTP,合称dNTP)、Mg2+,Tris-HCl缓冲液、引物、待扩增的DNA。先变性几分钟后,加入耐热的DNA聚合酶(Taq酶)。在聚合酶的作用下,利用溶液中的核苷酸原料,不断延伸合成新的互补链。这样,这段DNA从一条变成2条。若继续按照变性(92~95℃)、复性(40~64℃)、延伸(72℃)的顺序循环25~40个周期,可以得到100万个以上拷贝。用溴乙啶染色(或银染),在荧光下(或肉眼)可直接观察到是否存在引物间的那段DNA片段。
遗传病的基因诊断
已知突变的基因诊断
一、缺失型突变的基因诊断
如大多数α地中海贫血都属于缺失型。在我国多数为东南亚型SEA,-20kb(α地1)、缺失3. 7kb或4,2kb的α地 2。如果为α地1的纯合子,临床表现为Bart胎儿水肿综合征。最早是在α基因的内部设计一对引物(引物的设计有较为严格要求,现在可以采用专门软件进行)。如果PCR反应出现特异性带,表明存在α基因,该个体正常;如果扩增后没有特异性带,说明两条DNA都缺失α基因,则可诊断为Bart水肿胎。目前对α地中海贫血杂合子和纯合子可以用一种称为缺口-PCR(gap-PCR)的方法进行诊断。即设计3条引物,一条在5'端(A),第二条在3'端(C),另一条在距5'端314bp左右处(B)(在5'端缺失部分内)(下图)。这样。三条引物在一个反应体系中扩增时,因为A、C相距约20kb,不能扩增,而A、B相距仅314bp,可以扩增出314bp的条带。这样,如果待测DNA正常,则仅能见到一条314bp带;如果为杂合子(即一条16号染色体上有正常的两个α基因,而另一条上完全缺失α基因),此时,可以见到除314bp的条带外,由于缺失的两断端融合,AC可以扩增出一条558bp的带。最后,如果两条16号染色体的α基因都缺失,则只能见到558bp条带而无314bp条带。这样,正常(αα/αα)、杂合子(--/αα)、Barts水肿胎(--/--)均可区别开来。
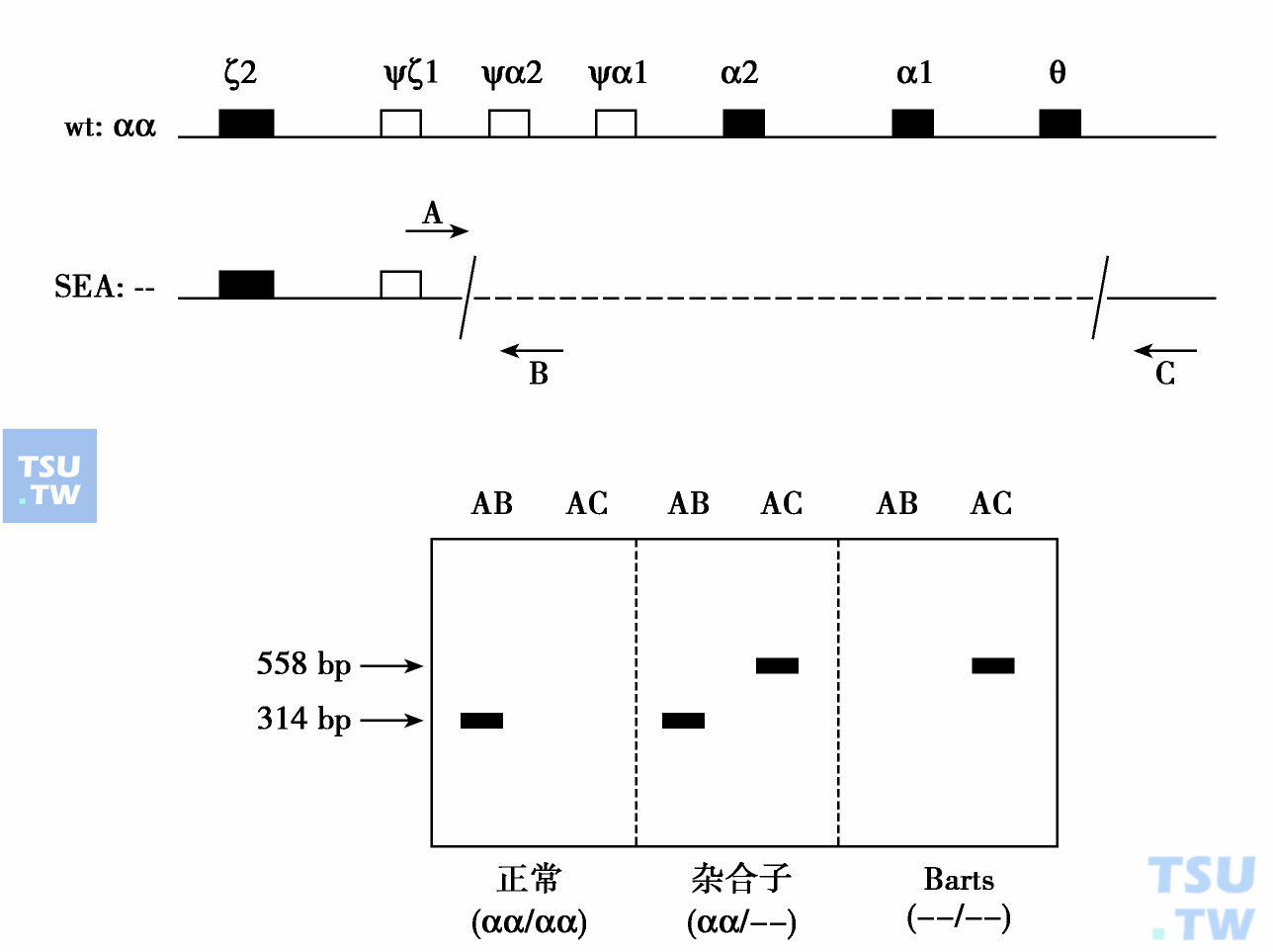
缺口PCR诊断Bart水肿胎引物设计与扩增结果示意图
同理,可以按同样方法设计检测只有3. 7kb和4. 2kb的缺失。
二、点突变的基因诊断
1)ASO法:检测点突变必须首先弄清突变的位置和性质。例如,β地中海贫血大多数为点突变。此时可合成等位基因特异寡核苷酸(allele-specific oligonucleotide,ASO)探针,探针通常为20bp左右的核苷酸。用放射性核素或非放射性核素标记。用于检测点突变时一般需要合成两种探针:一种与正常基因序列完全一致,能与之稳定地杂交,但不能与突变基因序列杂交;另一种与突变基因序列一致,能与突变基因序列稳定杂交,但不能与正常基因序列稳定杂交。这样,就可以把只有一个碱基发生了改变的基因与正常基因区别开来。
PCR可结合ASO,称为PCR-ASO技术。即先将含有突变点的基因有关片段进行体外扩增,然后再与ASO探针作点杂交,这样就简化了方法,节约了时间,只要极少量的基因组DNA即可进行。多个基因的各种突变探针(可达106种)混合进行ASO,通过斑点杂交同时对500个样品进行检测,是此项技术的发展,如能对杂交阳性进行测序,更为准确。利用ASO原理,结合荧光标记探针和特殊的图像技术,发展出多种快速、高通量的突变检测技术,如TaqMan探针技术、分子信标(molecular beacon)、表面等离子共振技术(surface plasmon resonance,SPR)等。
2)反向点杂交(RDB):如果同时需要检测多种某个基因突变,可以采用我国学者设计的“反向点杂交(reverse dot blot,RDB)”技术。例如,我国的β基因突变有10多种,RDB技术即预先将各种突变的ASO探针按方阵点在特殊的硝酸纤维膜上,干后,将膜浸泡在扩增出的β基因PCR产物中,通过显色反应,根据方阵上的显色杂交点,可诊断该基因发生了哪种突变。
3)突变特异性扩增系统(ARMS):突变特异性扩增系统(amplification refractory mutation system,ARMS)是较常用的简易检测单个碱基置换、插入、缺失或微缺失的方法。随着研究的深入,在表5-5中列出的各种血液病中,都陆续发现它们各自有多种不同的突变,有些达十几种或几十种之多。但是在同一种族或民族中却常见到只有几种,这就给采用ARMS法作基因诊断带来极大的方便。即可以设计几对针对突变的引物,在一次PCR反应中,检查出4~5种突变。这样就可以对90%以上的该病患者或携带者做出诊断。其他10%左右可以用测序补充。
4)直接测序(direct sequencing):由于测序技术的发展和成本的大大降低,许多基因诊断实验室利用PCR产物扩增后直接测序的方法来进行突变的诊断。这种测序方法一般一次常规测序反应能读出平均700bp的有效长度,对于扩增片段较短,外显子较少的基因突变的检测尤其适用。近年来利用类似化学终止法DNA测序的原理,发展出高通量的突变检测方法,如利用引物延伸方法发展起来的焦磷酸测序技术(pyrosequencing),以及利用循环逆向终止方法(cyclic reversible termination,CRT)发展出的DNA测序方法(Solexa),可以应用于大规模的SNP检测和突变分析。
在此法的基础上还发展了双重和多重ASA(MASA)、颜色互补分析(colour complementation assay)、致变分离PCR法(mutagenically separated PCR,MS-PCR)等。
5)DNA芯片技术:又称基因芯片或微阵列(microarray)是指按特定的排列方式将大量基因探针或基因片段固定在硅片、玻片、塑料片等上。这是结合核酸分子杂交和高密度阵列分析产生的一种基因检测技术。应用于已知突变检测。现在已经开始探讨和试用于临床。
DNA芯片技术具有快速、大批量、自动化的优越性。适用于具有许多突变点的基因检测。目前已试用于CFTR、HIV、β珠蛋白、线粒体、BRCA1等基因的突变或单核苷酸多态性(SNPs)检测。也有人已试验双色探针进行突变检测、DNA或RNA的定量检测。此外,在许多基础研究(如代谢途径分析、基因表达及其调控、基因结构与功能鉴定等)和药物筛选等领域也有可能应用这种技术。但是,如果不需要同时检测大批量的某种基因突变,这种技术受到经济方面的限制。
6)定量PCR技术:一般的PCR都只能做到定性,在进行基因表达水平研究时往往需要定量。20世纪80年代起已经有人研究定量DNA为模板的PCR和RT-PCR(用反转录酶将DNA转录为mRNA后再进行PCR反应称为反转录PCR,即RT-PCR)。1990年有人用PCR反应稳定上升对数期的PCR产物来定量。但难以控制相同的模板量和扩增效率。例如血液病遗传病中,β地中海贫血在药物或基因治疗中,从RNA水平监测珠蛋白肽链表达水平的高低,对治疗效果的评价都非常有益。
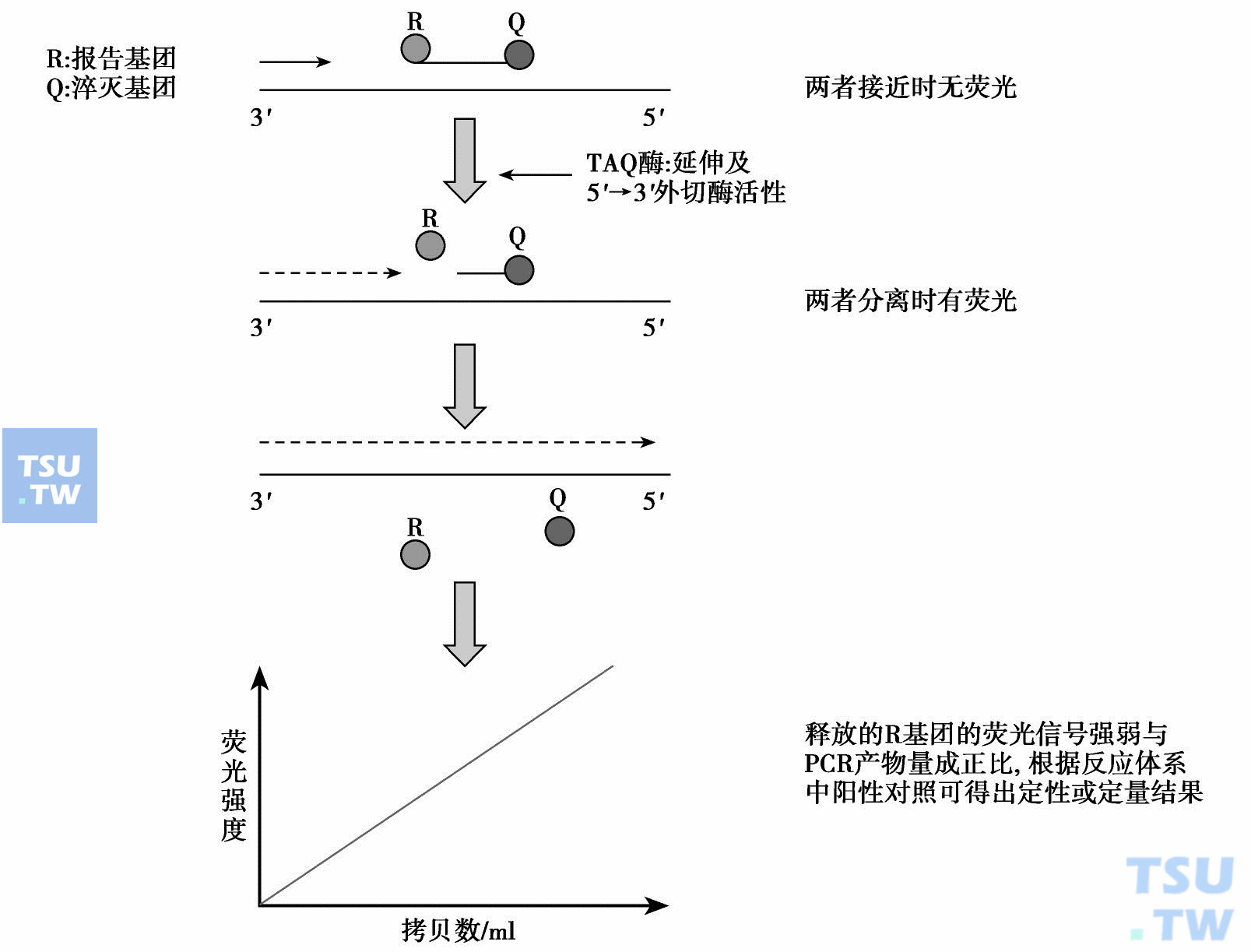
TaqMan荧光探针定量PCR技术的工作原理示意图
现在采用较多的是竞争性PCR(quantitative competitive PCR,QC-PCR)进行定量,但此法准确性较差、烦琐、要求条件高。一般实验室不易操作。目前建立的一种定量PCR(real-time quantitative PCR),因为用荧光标记引物,通过检测荧光强度来确定PCR产物量。在此基础上发展出的TaqMan荧光标记探针技术,既能检测模板DNA或cDNA的量,又能检测特异性等位基因,其原理见上图。其应用特点是:
- 融合荧光PCR和等位基因特异性杂交技术,敏感度高、特异性强。
- 实时测荧光信号,判断有无扩增。密闭体系,无污染。
- 可定量DNA 或RNA模板数目,用于病情判断和治疗监测。
- 可设计双色或多色荧光标记探针,进行多重PCR反应,可同时检测正常和突变等位基因。
- 可设计成阵列方式,在一多孔反应板上检测多个突变。
目前该法已经应用于病原体、肿瘤基因检测、免疫分析、基因表达、突变及多态性研究。
未知突变性质遗传病的基因诊断
原则上,所有未知突变性质的遗传病都可以进行基因诊断。主要的方法是用限制性片段长度多态性(restriction fragment length polymorphism,RFLP)做连锁分析。所谓RFLP是指不同个体的基因组DNA,如用同一种限制性内切酶去切割,产生DNA片段的长度各不相同。这种现象称为RFLP。其产生原理有二:①基因组DNA每隔100~200个碱基会出现一个中性突变,这一突变会增加或减少一个酶切位点。使切割的DNA长度不同;②基因组中存在多种重复顺序,但重复顺序因人而异。如果酶切点在重复顺序的两侧,则会因人而异地切出大小不等的片段。例如,甲型血友病是因第Ⅷ因子基因突变引起。此基因长达186kb,由26个外显子组成。虽然已经知道的缺失型和点突变有几十种,但大多数突变性质仍然未知。所以可以用RFLP进行基因诊断。其方法是,此基因的第18内含子有一个BclⅡ多态位点。如在两侧设计引物扩增出一142bp片段,再用BclⅡ进行酶切,则有些人可以切出99bp和43bp两个片段,而另外一些人则无此切点。通过连锁分析则可进行基因诊断。
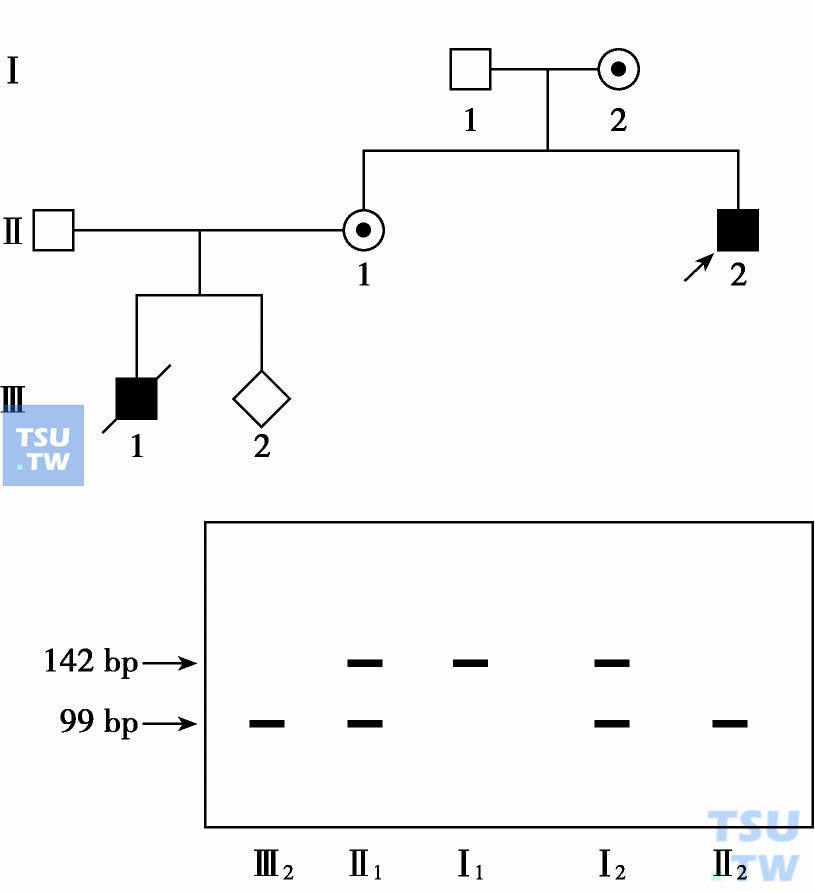
一个X-连锁甲型血友病家系RFLP连锁分析结果示意图
上图是一个甲型血友病患者家系。先证者(Ⅱ3)有切点,基因型为99bp/-(常规电泳43bp不易见到,故有99bp片段就代表有切点),表明血友病基因与这一切点连锁。他的母亲(Ⅰ2)和他的同胞姐姐(Ⅱ1)查出基因型为142bp/99bp,因此如胎儿为男性,基因型为99bp/-,则胎儿极可能为患儿,应引产。如为142bp/-,则应为正常胎,应保留。有时单一位点分不清,则需要做多位点综合分析,称为单倍型分析(haplotype analysis)。这种方法,结合新近发现的各种遗传标记,已用于疾病基因定位分析。但是,随着时间的推移,未知突变的遗传病在理论上应该越来越少,所以,RFLPs的应用会逐渐减少。
产前诊断
产前诊断(prenatal diagnosis)是应用细胞和分子诊断的技术,对出生前的胚胎或胎儿进行遗传病诊断。由于从受精细胞分裂开始,所有体细胞都含有个体的全部基因组,所以原则上,能够进行基因诊断的遗传病,也能够进行产前基因诊断。但实际上,由于可以获得的胎儿细胞量极少、母体细胞污染和具有一定的创伤性,所以还不是一般实验室可以做到的。常规应用的是绒毛、羊水细胞和脐血。目前追求的目标:一是尽量早期,二是非创伤性。前者的热门话题是植入前遗传病产前诊断(preimplantation genetic diagnosis,PGD),后者则是母血分离胎儿细胞进行胎儿遗传病的诊断。有人在母体外周血血浆中发现胎儿DNA,并试图用母体外周血浆进行产前基因诊断。但母亲的血浆与胎儿血浆难以分离,所以,目前还只能用于胎儿是否男性和父亲是显性遗传病的基因诊断参考。
植入前遗传病诊断是指在受精卵卵裂后第三天,胚胎发育的4~8细胞期,取1~2个细胞或极体进行遗传学诊断,从而判断该个体是否患有某种遗传病。余下的细胞根据诊断结果决定是否植入继续妊娠。实际上,PGD是与体外受精(IVF)结合进行。这项技术在20世纪90年代由英国开始,已有超过40个国家和地区开展。主要的诊断手段是单细胞PCR和FISH技术。通过FISH可以查出21三体、18三体、13三体、X和Y染色体异常以及染色体易位。通过单个细胞PCR结合DGGE、SSCP、杂合双链分析、荧光PCR等技术,已经有下列单基因病(包括杂合子)诊断成功的报告:β地中海贫血、镰形细胞贫血、囊性纤维化、成骨不全Ⅰ、Ⅳ型、高氨血症Ⅰ型、中链氨酰辅酶A脱氢酶(MCAD)缺乏症、Lesch-Nyhan综合征、视网膜母细胞瘤、脆性X、Bloch-Sulzberger综合征等。但这些诊断技术精确性、一次性判断的准确度、镶嵌体等问题,还需要积累更多的经验才能肯定对临床有应用价值。结合我国实际情况和PGD诊断的准确性,作者认为,目前在我国更应该发展和推广的还是羊水细胞和绒毛的产前诊断。
