Ig由肽链组成,其单体包括两条重链及两条轻链,链间和链内由二硫键相连接。
多肽链及二硫键
重链约含446个氨基酸残基,其分子量(MW)约53kD(IgG)或75kD(IgM);轻链约含214个氨基酸残基,MW约22. 5kD。轻、重链间及重链间借二硫键及非共价键相连,每条链内也有二硫键。这些链间二硫键维持着轻-重、重-重4个链之间关系,链内二硫键将各链分成功能区。故这些二硫键在维持Ig分子构型的稳定性上起重要作用。此外,在电镜下可见抗体分子结晶呈Y字形外观(图6-15)。
功能区
轻、重链的氨基末端(N末端)因易发生变异,叫可变区(V区);其余部分直到羧基端(C末端),氨基酸结构稳定,称恒定区(C区)。轻链有一半(第1~107)氨基酸残基为V区(VL),其余为C区(CL);重链的1/4(第1~120)氨基酸残基为V区(VH),其余为C区(CH);重链有1个V区及3或4 个C区:CH1、CH2、CH3,少数Ig还多一个恒定区(Ch4)。1条重链V区和1条轻链V区共同组成抗体分子上的抗原结合位点,或称抗体结合价,一个Ig单体上有两个结合价。
在轻、重链的可变区上,有3个氨基酸序列短片段易发生变换,故称为超变区。超变区氨基酸是抗体直接与抗原决定簇(表位)接触的部位,也是抗体多样性的主要结构基础。从功能角度上看,又称为互补决定区(complementarity determining region,CDR)。此外,超变区紧密相邻的氨基酸序列相对稳定,称为骨架区,占可变区组成的80%。
进一步剖析发现,重链上的3个C区与轻链上的C区彼此结构相似,每一区含有约100~110个氨基酸残基,由链内的二硫键连接组成一个环。无论轻、重链上的V区都有类似结构。Ig的一条重链上有4个功能区:VH、CH1、CH2、CH3,少数还有CH4,一条轻链有两个功能区:VL及CL。
绞链区
绝大多数重链的CH1与CH2之间有一小段富含半胱氨酸及脯氨酸的序列,称绞链区。连接两重链和轻重链的二硫键位于此区。半胱氨酸和脯氨酸是亚氨基酸,不能折叠成α螺旋故该区肽链呈伸展状态,易被酶解。绞链区也可使抗体分子具有可曲性,可使Y字形双臂呈90°~180°。此外,还赋予抗体补体结合等性质。
酶解碎片
木瓜蛋白酶作用于绞链区链间二硫键附近略靠重链的氨基端一侧,得到3个大小相似的碎片,其中两个相同,各含一条L链及半条H链及各含一个抗原结合位点,称为Fab片段(antigen binding fragment)。第3个碎片包含两条重链的另一半,称为Fc(crystalligable fragment)。胃蛋白酶作用位点在绞链区链间二硫键附近略偏羧基端的一侧,可得到一个大片段,分子量约100kD,Y形分子两臂仍连接一起,故含2个Fab片段,此二价片段称为F(ab)2。Y形分子的柄受胃蛋白酶进一步消化,成为小片段肽链。
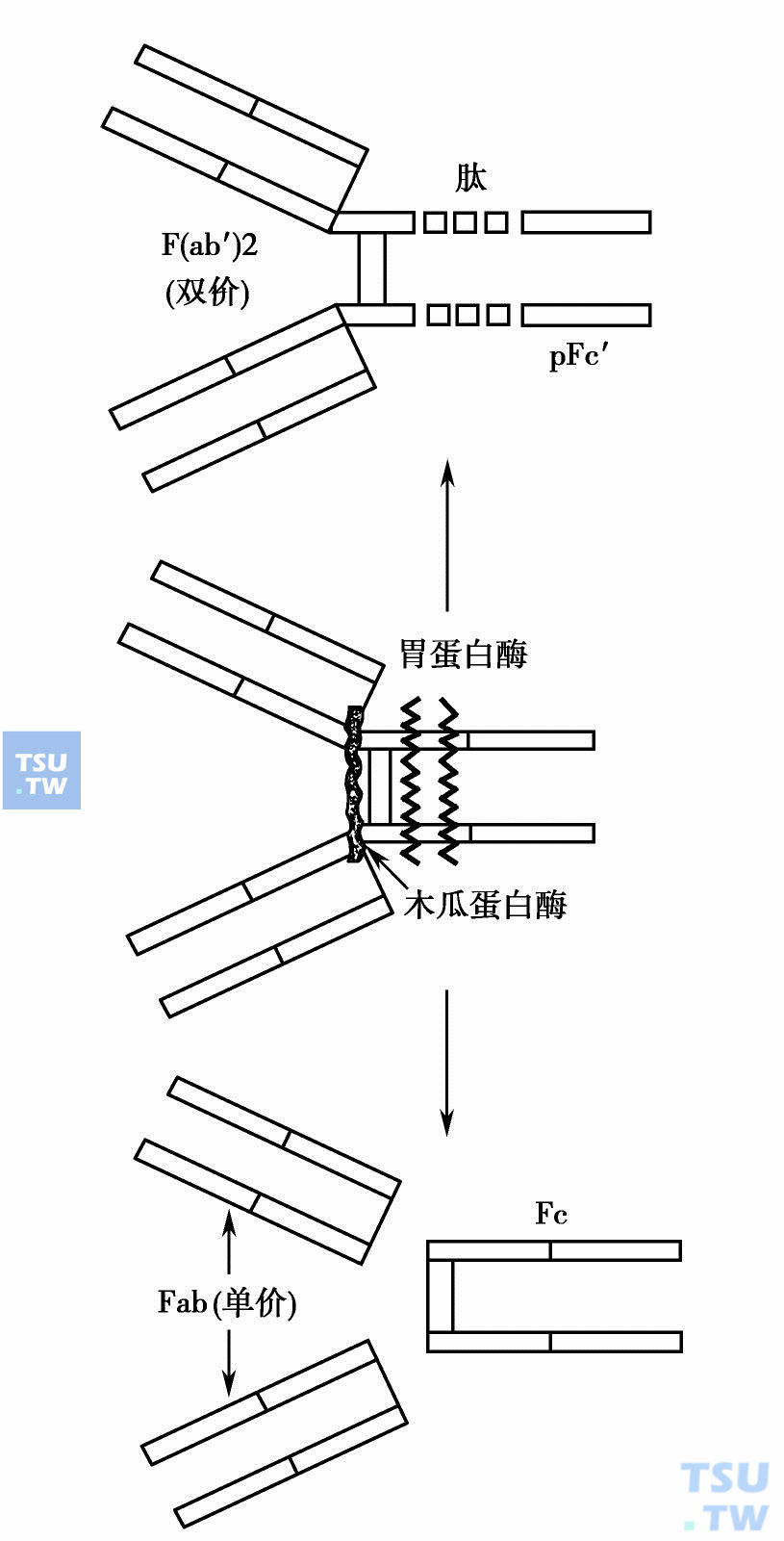
免疫球蛋白分子被蛋白酶分解示意图
上图:Ig分子被胃酶水解,自二硫键C末端一侧断裂,成为一大片及一些小碎片 下图:Ig分子被木瓜酶水解,自二硫键N端侧断裂,成为三个大小相似片段
碳水化合物部分
有一些长短和形状不同的糖链附在Ch2功能区,在天冬酰胺的第1个碳与糖N乙酰葡糖胺之间形成一个键。其功能尚不明,可能在Ig分子的运转和分泌上起作用。若干扰α及ε链的糖基化反应,便可阻止IgA及IgE分子的分泌。这些糖链数目在Ig类之间也不相同:分子IgG有2个糖链,IgM有10个,IgA有16个,IgE有12个。
功能区的三级结构
如下图所示,一条轻链上的2个功能区CL及VL和连接二者的一小段“转弯”区。CL及VL的空间构象大体一致。在晶体衍射观察下呈卵形或圆筒形外观。每个功能区的多肽有特征折叠,叫做Ig褶。肽链沿自身按相反方向来回折叠(即反向平行)形成片状,所谓β-折叠层(βpleated sheets)。当折叠改换方向时,每股弯曲呈发夹型。几乎在所有的弯曲处都含有一个高度保守的甘氨酸。每个功能区由两个β-折叠区(X 及Y)组成,其间由二硫键固定。CL功能区的两片折叠层分别含3股及4股的反向平行股;而VL功能区的两片层分别含4股及5股。VL近N端的3个反向平行折叠的肽环(标有氨基酸序号26、53、963个环)就是超变区或互补决定区所在部位。肽环的形状、走向可因氨基酸组成的变更而异。这种局部氨基酸的多变性并不损及β-折叠片的7股及9股骨架。此外,每个V区有4个保守的骨架序列。VL及VH上各有3个互补决定区(CDR),这6个CDR形成抗体结合部位。由于它位于V区的自由端而获得一定的移动性,有利于结合抗原。
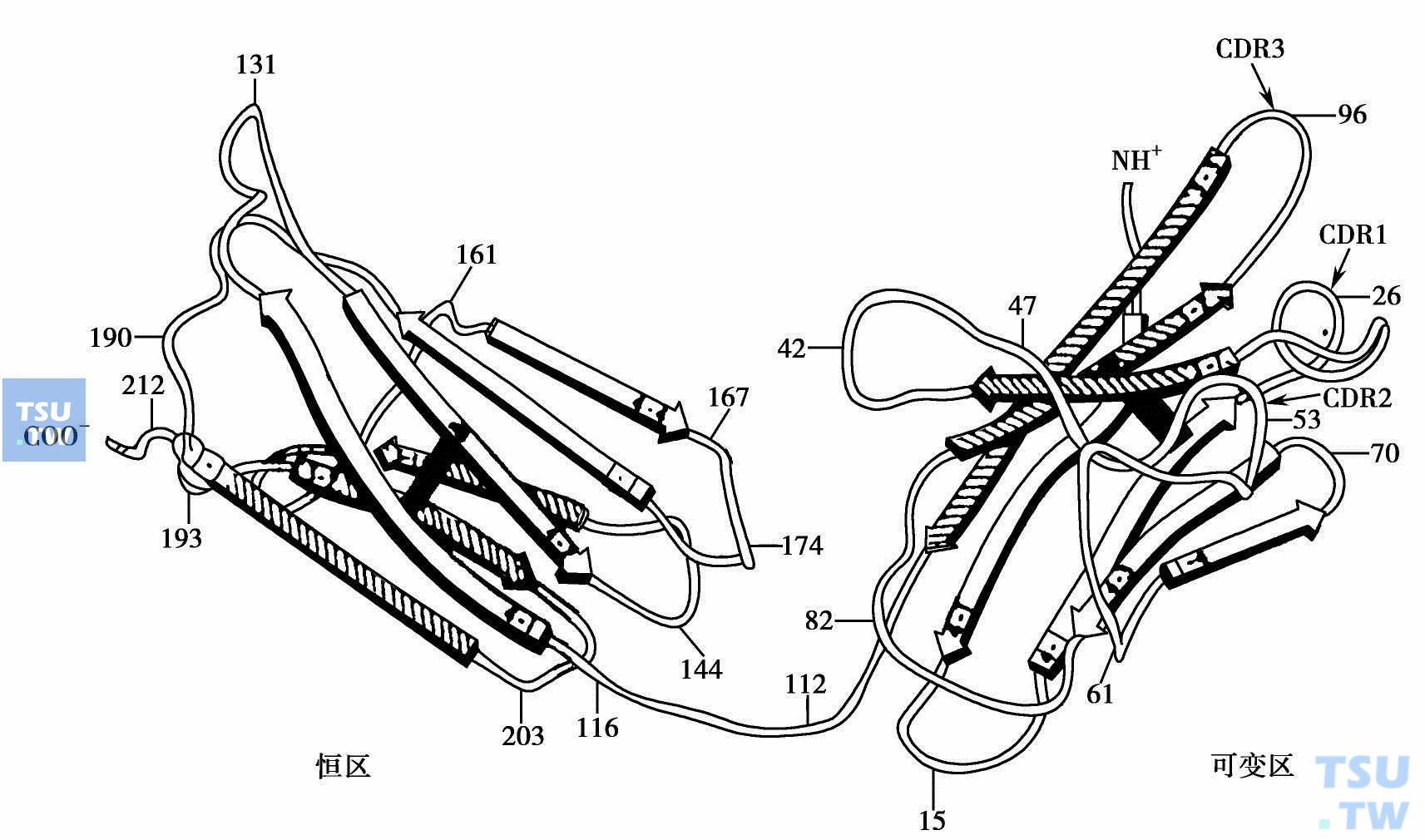
免疫球蛋白轻链可变区、恒区及高度可变区立体构象;CDR1~3表示三个高度可变区位置 黑条表示二硫键(摘自Edmundson AB:1975)
抗体与抗原的结合
一个Fab片段中一般形成15nm×0. 6nm×0. 6nm的腔隙,表面由6个超变区环围,构象随Ig分子不同而异,体现了抗体结合部位的特异性。另外,由“转弯区”绞旋160°~170°,使两个恒定区(CL及CH1)互以4股折叠的疏水面相向而紧密贴合。两个可变区(VL及VH)则互以5股折叠层的亲水面相向,得以容纳水相抗原进入。总之,不同Ig的结合部位可呈现出空间构象千姿百态的抗原受纳腔,腔面上有各种活性基团和电荷布局,而具有形形色色的空间构象。活性基团和电荷布局不同的抗原或半抗原,便可按照与抗体结合部位对应的互补关系而“对号入座”,呈现专有的特异性反应。但抗原抗体结合的对应互补点关系并非绝对的。一种抗体可能与若干种抗原结合。反之,一种抗原决定簇也可能与若干种抗体结合。因为只要抗原分子上某一局部(决定簇)能被抗体结合部位所容纳,互补匹配,便可导致抗原抗体结合。这便是交叉反应的道理。
