免疫球蛋白不仅可变区种类繁多,而且,恒定区也有肽链结构和氨基酸组成的差异,单体、二聚体或多聚体的差异,链间连接形式及二硫键数目的差异等,从而可将Ig划分为各种类型。由于这些结构差异,也导致Ig性质及功能等不同。
免疫球蛋白的同型(isotypes)分类
免疫球蛋白(Ig)
根据其恒定区肽链结构和抗原性的差别而划分5大类,每类都包括轻重链。按重链恒定区差别分为5种H链:γ、μ、α、δ及ε链,它们相应的Ig有5类:IgG(γ)、IgM(μ)、IgA (α)、IgD(δ)、IgE(ε)。按轻链恒定区差别划分为κ 及λ链两型。任何一种Ig单体都由两条同类的重链和两条同型的轻链组成。任何一类Ig都可分成κ 及λ两型。如IgG包括γ2κ2和γ2λ2,IgM包括μ2κ2及μ2λ2(2代表2条链),其余类推。
不同类的重链除氨基酸组成、数目有差别外,功能区数目也不同。γ、α及δ链有3个功能区(CH1、CH2及CH3),μ及ε链有4个功能区(CH1~CH4)。此外,δ链的绞链区也比其他重链为长。IgG的CH2 及IgM的CH4上有激活补体经典途径的位点,但IgM的只有和抗原结合,使分子构象改变后才能暴露出补体结合位点。κ及λ链的比例随物种不同而异,在人类血清中κ:λ是70:30,而小鼠为95:5。
此外,组成各类Ig的单体数目也有差异。IgG、IgE及IgD为单体形式;IgM为五聚体,分子量大(900kD),各相邻单体以二硫键相连,Fc端朝内侧,Fab端向外,形成梅花状,并有一个J链。IgA有多种形式,在血清中以单体为主,在黏膜表面和分泌液中为二、三、四聚体等。这些多聚体有J链和分泌组分(SC)相结合。J链由浆细胞分泌,分子量约15kD,是含124个氨基酸的糖肽,富含门冬氨酸和谷氨酸而呈酸性,借二硫键与IgA的重链相连而使多聚体稳定。分泌组分(SC)或分泌片是糖肽,分子量70kD,由黏膜上皮细胞产生,带有J链的Ig多聚体(如IgA二聚体),在通过上皮细胞时与SC结合,SC 把IgA二聚体携运到黏膜的腔面,并保护Ig使不受消化酶的分解。
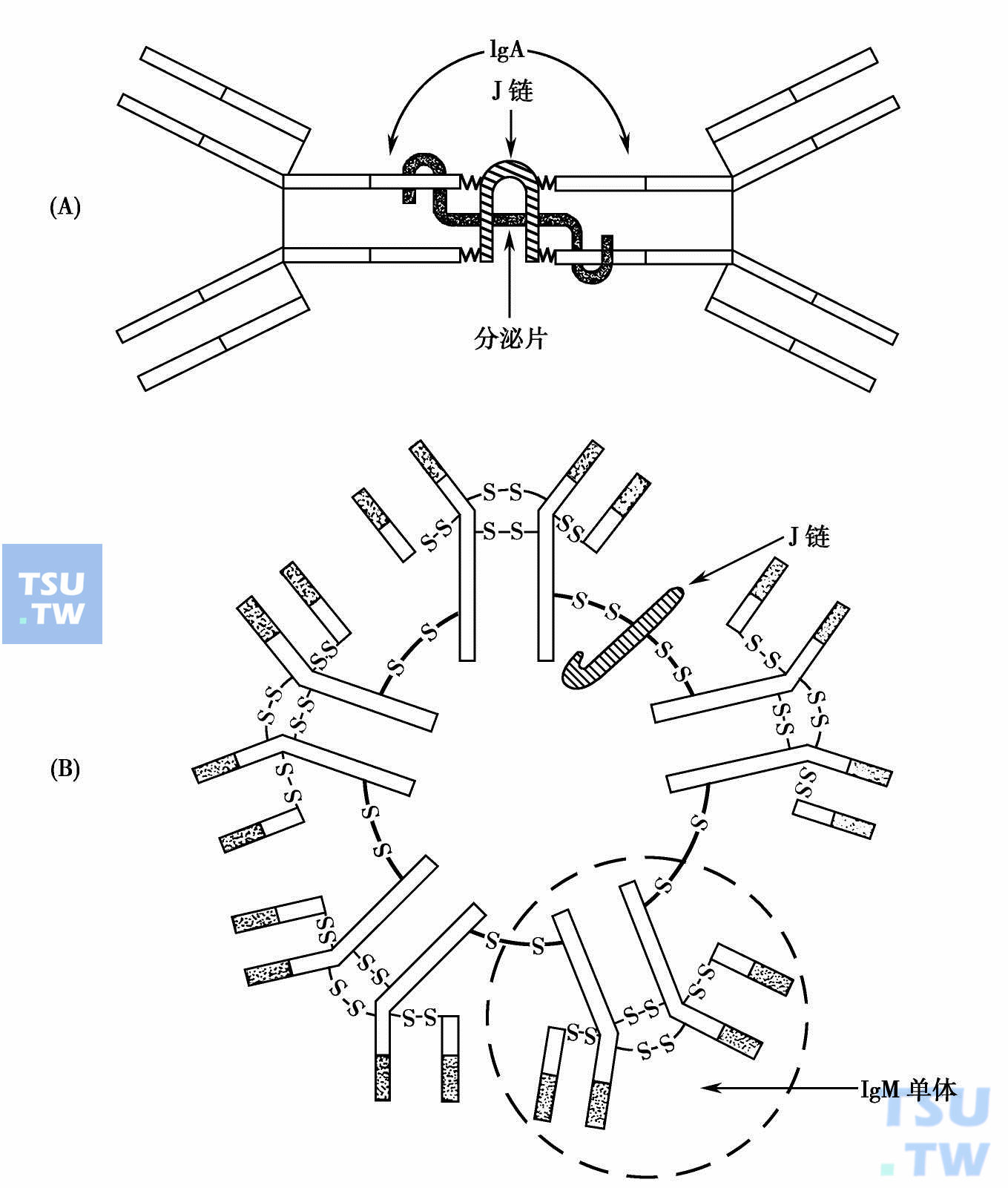
IgM与IgA结构示意图:(A)IgA二聚体;(B)IgM五聚体
免疫球蛋白的亚类和亚型
一、亚类(subclass)
依据同一个体的同一类Ig中重链恒定区抗原性差异、重链间二硫键数目的差异及连接位置不同,而将同一类Ig分为若干亚类。人类IgG的重链γ又可分为4种:γ1、γ2、γ3及 γ4,其相应Ig亚类有IgG1、IgG2、IgG3和IgG4;人类IgA的重链α可分为α1及α2,相应为IgA1及IgA2两个亚类,分泌性sIgA二聚体属于IgA2亚类;IgM亦有IgM1及IgM2两种亚类;目前尚未见IgD及IgE亚类的报道。
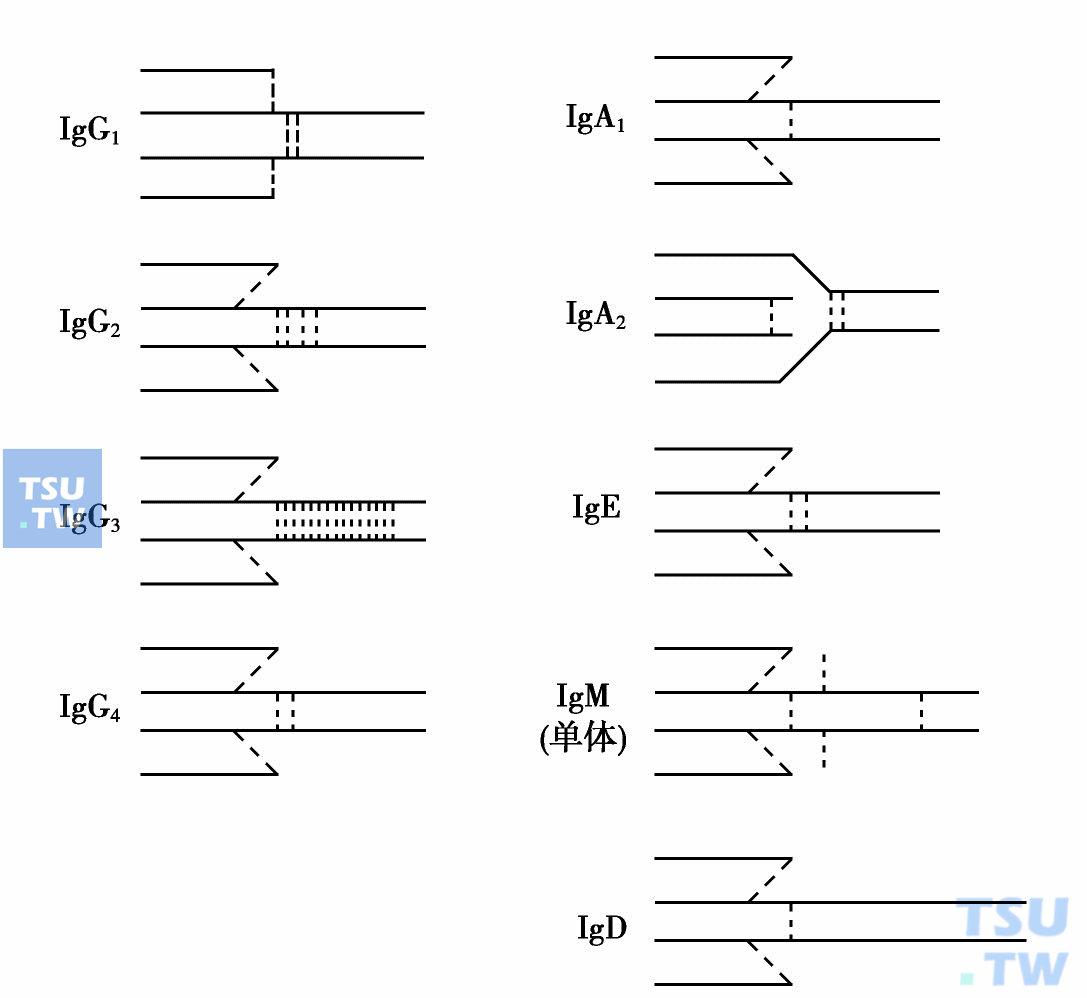
人类免疫球蛋白五类及亚类结构示意图;---表示链间二硫键
此外,亚类的重链间二硫键数目也有差异:IgG1 及IgG4重链间有2个二硫键相连,IgG2有4个,IgG3有15个。IgA2轻重链间无二硫键相连,可能2个轻链彼此很近,并插入叉状形分子的内侧面。
因此,按人类的Ig重链恒定区可划分为:IgG 1~4、IgA1~2、IgM1~2及IgD、IgE共10个亚类。而小鼠则为IgG1、IgG2a、IgG2b、IgG3、IgA、IgM、IgD及IgE共8个亚类。
二、亚型(subtype)
依据同一个体的同一型Ig轻链恒定区抗原性的差异,划分为不同的亚型。κ链恒定区只有一种,不再有亚型之分;λ链恒定区在几个位置上的氨基酸略有不同,促成抗原性差异,故又分为λ1、λ2、λ3及λ4 4个亚型。如λ链第152位为甘氨酸,则表现为抗原kern(+),换为丝氨酸则为kern(-);如λ链第190位为赖氨酸则为OZ(+),换为精氨酸则为OZ(-)。kern(-)OZ(-)为λ1亚型,kern(-)OZ(+)为λ2,kern(+)OZ(-)为λ3及kern (+)OZ(+)为λ4。故轻链恒定区共有5种:κ、λ 1~4。
从上述重链和轻链恒定区所划分的Ig类型、亚类及亚型的角度看,推测同一个人共可产生10×5= 50种重、轻链的不同组合,也就是可组成50种恒定区结构互异的Ig,且不说可变区的多样性了。
免疫球蛋白的同种异型(allotypes)
同种异型是一个物种的群体体内不同个体间免疫球蛋白重、轻链恒定区的差异。也就是体现群体中不同个体之间等位基因及其分布。目前,报道人类Ig有三类同种异型。
- 同种异型 IgG的γ链恒定区抗原性差异表现出的同种异型。其书写方法是:G1m(17),其中G1代表γ1,(17)是γ1的同种异型标记。以此类推,目前已发现的有γ1链10个同种异型:G1m(1)、(2)、(3)、(4)、(7)、(9)、(17~20)、(22);γ2链有2种:G2m(8)、G2m(23);γ3链有15种:G3m(3)、(5)、(6)、(10~16)、(21)、(24~27);γ4链有3种:G4m(4)、(4a)、(4b)。Gm分型可用于亲子鉴定和遗传学研究,也发现有些Gm表型与自身免疫病相关。
- 同种异型Am 同种异型只见于IgA2的α2链恒定区差异,有A2m(1)和A2m(2)两种,前者多见于白种人,后者以黄种及黑种人居多。
- 同种异型Km是κ轻链恒定区差异,以往用InV表示。在IgG、IgM及IgA的κ链上均可检出Km同种异型。现已肯定有三种Km同种异型决定簇。Km(1)、Km(1,2)及Km(3)。
此外,在IgE的ε链发现有Em(1)同种异型。在α1、δ、λ链尚未查到同种异型。
Gm及Am表型不合的多次妊娠妇女和接受反复输入全血、血浆或γ球蛋白制剂的患者也有产生该类同种异型抗体者。
独特型(idiotype)
独特型是指特定的单一免疫球蛋白分子上抗体结合抗原决定簇的部位,随个体及抗原不同而各有专一性。同一个体,不同抗原诱生的Ig具有不同的特异性;同一抗原在不同个体上诱生的Ig,特异性也未必相同。
为了证实独特型的存在,取A、B两只同种异型结构相同的小鼠,用抗原X免疫小鼠A,得抗X抗体,制成抗原-抗体复合物,用之免疫小鼠B,B产生抗免疫复合物中抗原部分的抗体及其抗体部分的抗体(抗-抗体)。由于两鼠同种异型是一样的,故B产生的抗-抗体只针对A的抗X抗体的抗原结合部位,其特异性为该结合部所特有。此类特异性的Ig抗原决定簇称为独特型。即抗-抗体似为抗原的“映象”。目前,已将独特型决定簇按其与抗原结合部位的位置关系分为3种:①α独特型位于抗原结合部位外侧;②β独特型与抗原结合部位紧密相连,故抗独特型抗体与之结合就会干扰抗原的结合;③γ独特型由结合部位自身形成。曾经有一些文献提出独特型特异性位点与互补决定区(CDR)是同一个。因为CDR高度可变性,故表现最大的多样性,而独特型可能就发生在这些位点上。然而近年我们的工作表明许多独特型抗原决定簇位于框架区(FR)[Cancer Immunol Immunother. 2005 Nov;54(11):1106-1114.]。很可能是细胞间调控的靶点。独特型决定区的功能涉及抗原识别:识别其他Ig分子,也被其他Ig分子所识别。这种认识构成了独特型网络学说。独特型疫苗也开始用于淋巴系统肿瘤的免疫治疗,移植排斥中用抗独特型抗体可选择性抑制或消除参与排斥作用的淋巴细胞。
