补体是一组多分子能自身装配的生物活性系统,由近20种理化性状和免疫学特性不同的血浆蛋白组成,被激活时,前体各成分分子便按一定顺序呈链锁的酶促反应。有两种活化途径:“经典途径”(抗原抗体结合而启动)及“替代途径”(被微生物等激活)。激活所产生的小肽可致炎症反应及调节免疫等。
概况
补体是一群蛋白质,在人类及动物抵御病原体感染的防御中起重要作用。
在19世纪末首次发现血清中除抗体外,还有一种不耐热物质,在它参与下可使结合抗体的红细胞显示溶血现象,后来Ehrlish等称之为补体(complement,C)。
补体是一组多分子能自身装配的生物活性系统,由将近20种理化性状和免疫学特性不同的血清蛋白所组成,通常以非活动状态的前体分子形式存在于血清中,约占血浆球蛋白总量的15%。当它因某种原因被激活时,补体各成分便按一定顺序呈链锁的酶促反应,即补体活化。补体有两种活化途径:第1或“经典”途径是依赖抗原抗体结合而启动;在无抗体情况下,可被微生物等激活,称为第2或“替代途径”或“旁路”。补体活化后参与机体防御功能及维持自我稳定。补体可直接溶解敏感的原、真核细胞或被膜病毒。对于不敏感的颗粒,则通过补体片段与巨噬细胞表面特异性受体结合起调理作用。补体激活过程中所产生的小肽对粒细胞有趋化作用,使肥大细胞脱粒而引起炎症反应,参与免疫病理过程。某些补体片段似有免疫调节作用。
1968年世界卫生组织命名委员会对补体名称作统一规定,补体缩写为C(大写)。经典途径包括9种成分。按激活顺序命名为C1~9。C1的3个亚单位为C1q、C1r、C1s。每一分子肽链用希腊字母表示,如C3α链、C3β链。替代途径的主要组分是启动因子(IF)、备解素(P)、B因子(B,C3激活剂前体)、D因子(D,C3激活剂前体转换酶)。补体组分或复合物激活形式,在符号上方画一杠线,如C1、C2、……C9、P、D、B、C2a、C4b2a。补体的裂解产物,用小写字母后标,如C3a、C3b等。失去活性的成分或片段用小写字母前标,如iC3、iC4,但亦有后标者C3i、C4i等。另如抑制C1水解蛋白活性的C1钝化物(C1INA)等。
经典途径
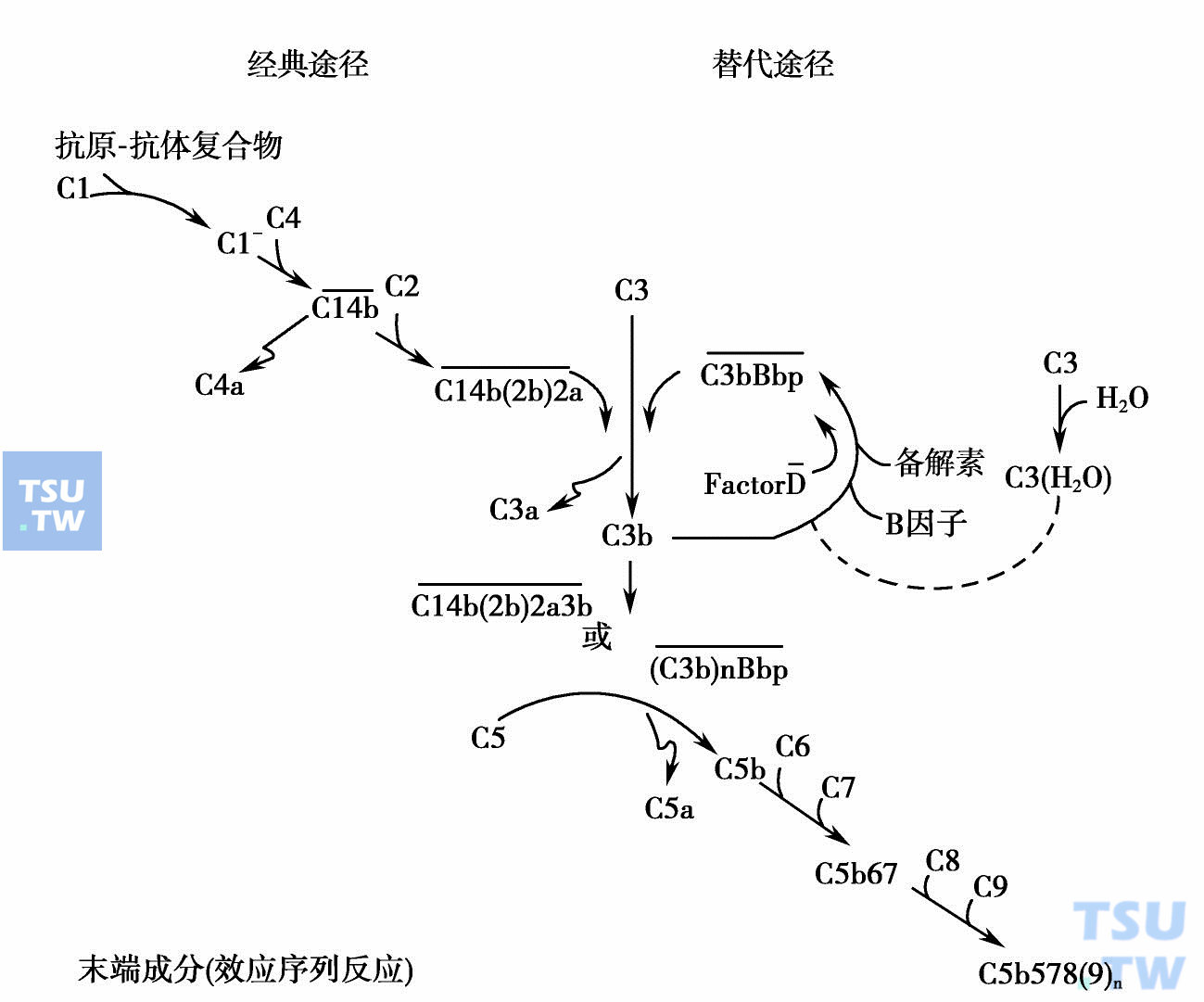
启动补体激活有两条途径都使C3转变为C5。一条是通过C42复合酶,另一条通过C3B复合酶使C3激活。接着,两条途径都使C5激活,经典途径通过C423复合酶,而替代途径则通过(C3)nB复合酶,使C5激活。激活的C5将其余的C6、C7、C8和C9形成一个溶解性复合物。
补体的三个功能部分和它们的蛋白质组成
在经典途径活化中抗原-抗体(Aq:Ab)复合物作用后形成C3转化酶,C1、4b(2b)2a。替代途径活化形成C3bBbp。两种酶具有同一的基质特异性,均能活化效应序列
在经典途径活化中抗原-抗体(Aq:Ab)复合物作用后形成C3转化酶,C1、4b(2b)2a。
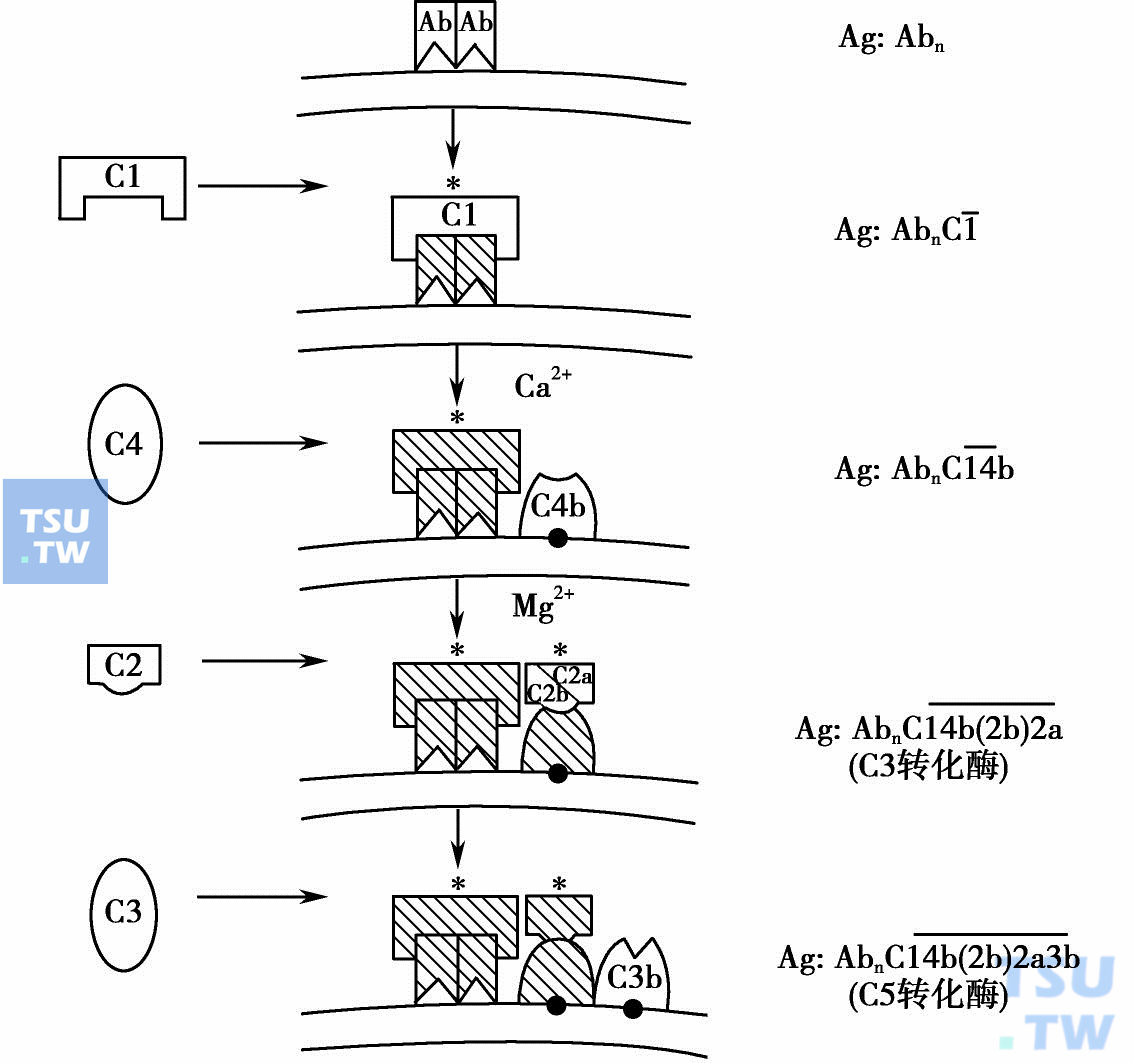
替代途径活化形成C3bBbp,两种酶具有同一的基质特异性,均能活化效应序列。经典途径(classical pathway)是一条免疫球蛋白依赖的补体激活途径,它由两个功能单位组成:C1q、C1r及C1s构成识别单位,C4、C2及C3构成活化单位(图6-22)。
一、人类IgM及IgG(除IgG4亚类外)均能结合C1q,但IgA、IgE及IgD缺乏此功能。一分子IgM结合一分子C1q就可引起红细胞溶解,而至少需要两个密切相邻的IgG分子才能达到同样效果。有时尚需更多的IgG随机形成空间对子,激活取决于细胞上表位的密度。IgG Fab臂与抗原结合时使Fc段构型改变,方可引起C1q结合,与IgG结合在Cγ2区,与IgM结合在Cμ3/CμA区。
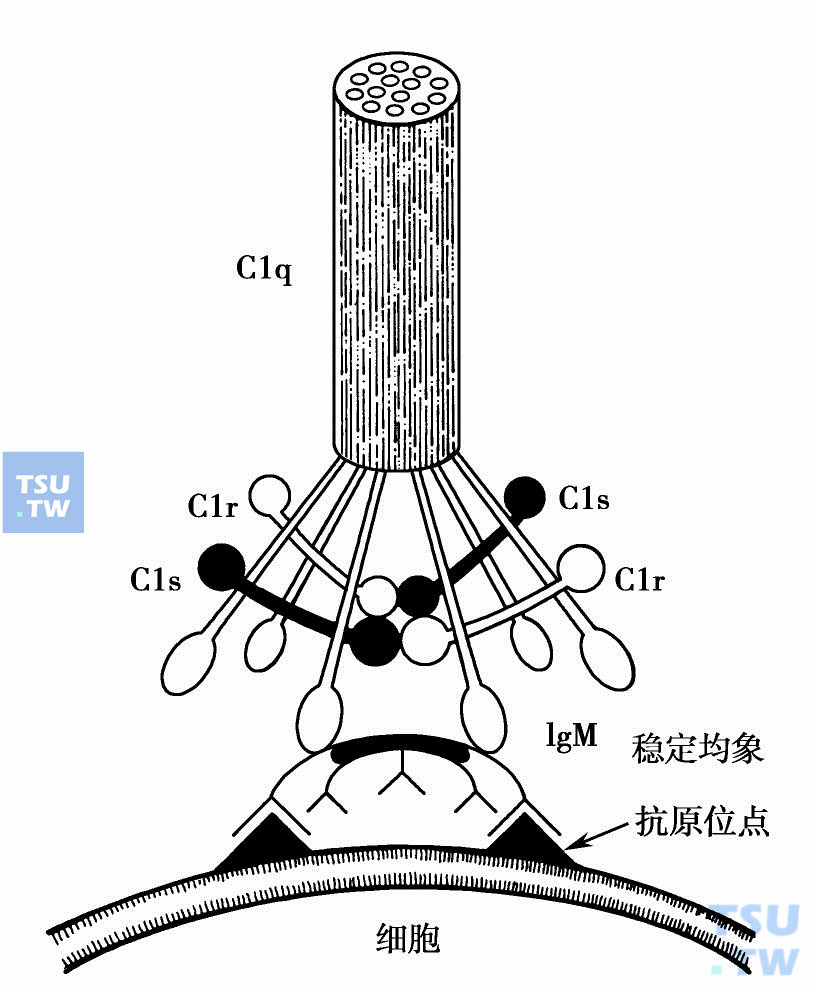
二、2-C1C1是正常血清中存在的大分子复合物,分子量740kD,包括C1q、C1r、C1s,借钙联合在一起,EDTA又可将之分解为亚单位,摩尔比为1C1q:2C1r:2C1s,功能各异。C1q最大,结构特殊,有18条肽链,每6条肽链组成1种不同的链,命名为A、B、C链,其终末氨基酸很似胶原。电镜下,C1q的结构像6枝一束的郁金花。6个球状体含有每个多肽链的羧基终末端,3条肽链组成一个球状体并自成小螺旋,组合形成大螺旋结构。C1q通过6个球状体结合到IgG或IgM的Fc段上。C1r及C1s分子结构相似,只一条多肽链,分子量相同,氨基酸组成也相似,属于丝氨酸蛋白酶原形式。Ca2+存在下,形成C1r及C1s,各含2分子的四聚体,与C1q纤维丝状区相连。C1q的6个球状区可结合抗体,只需其中2个与之结合即足以活化C1,其机制还不十分清楚。C1s酯酶形成,负责分解其天然底物C4及C2,使之活化。在没有抗体存在时,许多亚细胞成分,C-反应蛋白复合物,内毒素及尿酸单体结晶等物质也可与C1结合并使之活化。
经典途径的激活
图解中显示经典途径成分形成典型的C3及C5转化酶。星号表示酶活化成分,实圈表示共价键,其他键假定为离子键或疏水键
C1抑制剂(C1INH):它严格地控制着血清中活化的C1,按1:1,C1INH结合到C1r及C1s的链上,封闭酶的活性。
三、C4激活的C1使C4裂解。C4是β球蛋白,由α、β、γ 3个链组成。C1s分解血浆中的C4,引起α链释放一个9kD的小片段(C4a),具有微弱的过敏毒素活性。一个C1分子可裂解多个C4分子,引起一群C4b分子沉淀于激活物表面,这是C连锁反应中的放大阶段。于是,C4b 为C2提供结合位点。
四、C2结合的C4b与C2形成一依赖镁的可逆性复合物,C1s裂解此C2而活化,成为C3转化酶的酶原。C2是单链糖蛋白酶原,在血浆中浓度极低。镁离子存在时C2与C4b结合,被邻近的C1s2分裂为两个片段:分子量74kD的C2a及34kD的C2b。C2b进入液相,或与C2a呈弱的联合。C2a含有酶促活性点,能灭活DFP。C4b(2b)2a复合物是经典途径中C3转化酶,有分裂C3的功能。C4b提供C3结合位点,故C4b缺乏则C2a不能分解C3。
C1的三个亚单位及C1q与IgFc结合位置
C1酯酶复合物由一个C1q、两个C1r和两个C1s分子组成,钙离子使该复合物稳定
C2主要的控制机制及酶促性分解产物是物理性解离,即C2a及C2b只呈弱的联合。
C3被C4b(2b)2a复合物分裂而产生小片段C3a过敏毒素及大片段C3b。C3b代表经典及替代途径的转换点,并具各种生物活性。
五、C3这一成分在补体序列反应中起着中心的作用。血清中浓度最高,由两个二硫键连接着α及β链。与C4相似,C3由一单链前体(proC3)合成。经典途径(C4b2a)或替代途径(C3bBb)的C3转化酶均可激活C3,并裂解α链成为小片段C3a(77个氨基酸)及大片段C3b,借共价键附着在细胞表面。
替代途径
替代途径活化补体在几个方面不同于经典途径。
一、替代途径无需抗体,可被某些细菌、真菌、酵母、其他哺乳动物细胞及病毒感染的同种细胞所活化,该途径为无免疫性的个体提供了一种抵抗微生物的能力。而经典途径活化C必须有特异性抗体。
二、达到放大的机制不同经典途径有严格的序贯反应,达到放大则由于各阶段酶活化等作用。替代途径是循环式的:启动替代途径活化的物质也是活化方式的主要产物。放大的主要特征是阳性反馈放大环,即有效的C3转化酶形式有赖于C3裂解产物C3b的阳性反馈反应,而经典途径无阳性反馈反应。
三、替代途径由6种蛋白质组成(C3、B、D、P、H 及I),有两种类型的C3裂解酶,即C3Bb的“致敏”C3转化酶和C3bBb的“增强性”C3转化酶,后一种裂解物C3b介导阳性反馈反应,前一种只产生启动增强反应所需小量C3b。经典途径由C1至C9 9种成分11种蛋白质参与,只有1种类型的C3转化酶。
1)D因子:是血清中含量极少的蛋白水解酶,分子量小,只有一个肽链。D因子在替代途径中的功能与经典途径中C1s相同,都显示丝氨酸酯酶蛋白酶活性。D因子在替代途径第1步酶解中起作用,即B因子与C3b结合时在镁离子存在下,D因子裂解B因子。
2)B因子:是糖蛋白酶原,只有一条肽链。镁离子存在下,B因子与C3b按1:1形成复合物,则B因子被D因子裂解,释放出30kD的灭活片段Ba。大片段63kD,称为Bb,它与C3b相连,形成“替代途径中C3转化酶”,C3bBb。Bb是丝氨酸蛋白酶。C3bBb天然底物是C3。C3裂解后产生另外的C3b,这些C3b可进一步参与新的转化酶形成,引起阳性反馈,起放大作用。当替代途径转化酶在颗粒表面形成后,另外的C3b便可在邻近部位沉着,并形成C3bnBb复合物,产生了“替代途径C5转化酶”。C5如同C3,经蛋白水解而被裂解,这是Bb的一种功能。C3bBb复合物在37℃下,Bb与C3b自然解离,Bb即丧失全部活性。
C2与B因子有许多相似之处:都是酶原,被丝氨酸蛋白酶裂解而形成新的丝氨酸蛋白酶;激活形式都是二功能区结构,必须与其他成分(C4b或C3b)形成复合物才能裂解其天然底物;都需镁离子存在,在37℃下迅速衰变等。因此有人提出假说:C2及B因子可能代表基因复制中的一个例子。
3)备解素:1954年Pillemer首先描述,从而认识了替代途径。它也是该途径中1个被证实的蛋白质,由3个完全相同的亚单位组成。有天然备解素(np)及活化备解素(p)两种形式,np在正常人血清中可见到,而p则在已活化的替代途径血清中。np可结合C3bBb引起非酶性激活成为p。C3bBbp(稳定的C3转化酶)明显减少自然衰变和分解速度,使半寿期延长3~4倍。此外,p的结合减低了H 及I对C3bBbp的灭活速度。
4)H因子:替代途径的阳性反馈机制使C3 及B因子的消耗量呈指数增加,这一趋势被H及I因子严格控制着。H因子是一种单链多肽,可能是二聚体。H因子促使Bb从复合物上解离,从而加速替代途径C3转化酶的功能衰变。这是由于H因子与B因子及Bb竞争与C3b的结合,H因子与C3b的亲和力大大超过B因子与C3b的亲和力。其次,H因子结合C3b干扰了C3b结合C5的能力,并抑制经典途径及替代途径C5转化酶对C5的裂解。还有就是H因子引起C3b不可逆的改变。H因子既是I因子裂解液相C3b的强力辅助因子,也促进表面结合C3b的裂解。总之,H和I因子不是废除C3b的一切生物活性,而是结束C3b参与C3或C5转化酶的能力。
5)I因子:是一种丝氨酸蛋白酶,如同D因子一样在循环中呈活性状态。由α及β链组成I因子。天然底物是C3b及C4b。H因子和C4结合蛋白是I因子在液相系统中促酶作用的辅助因子。I因子引起C3b至少两处断裂。
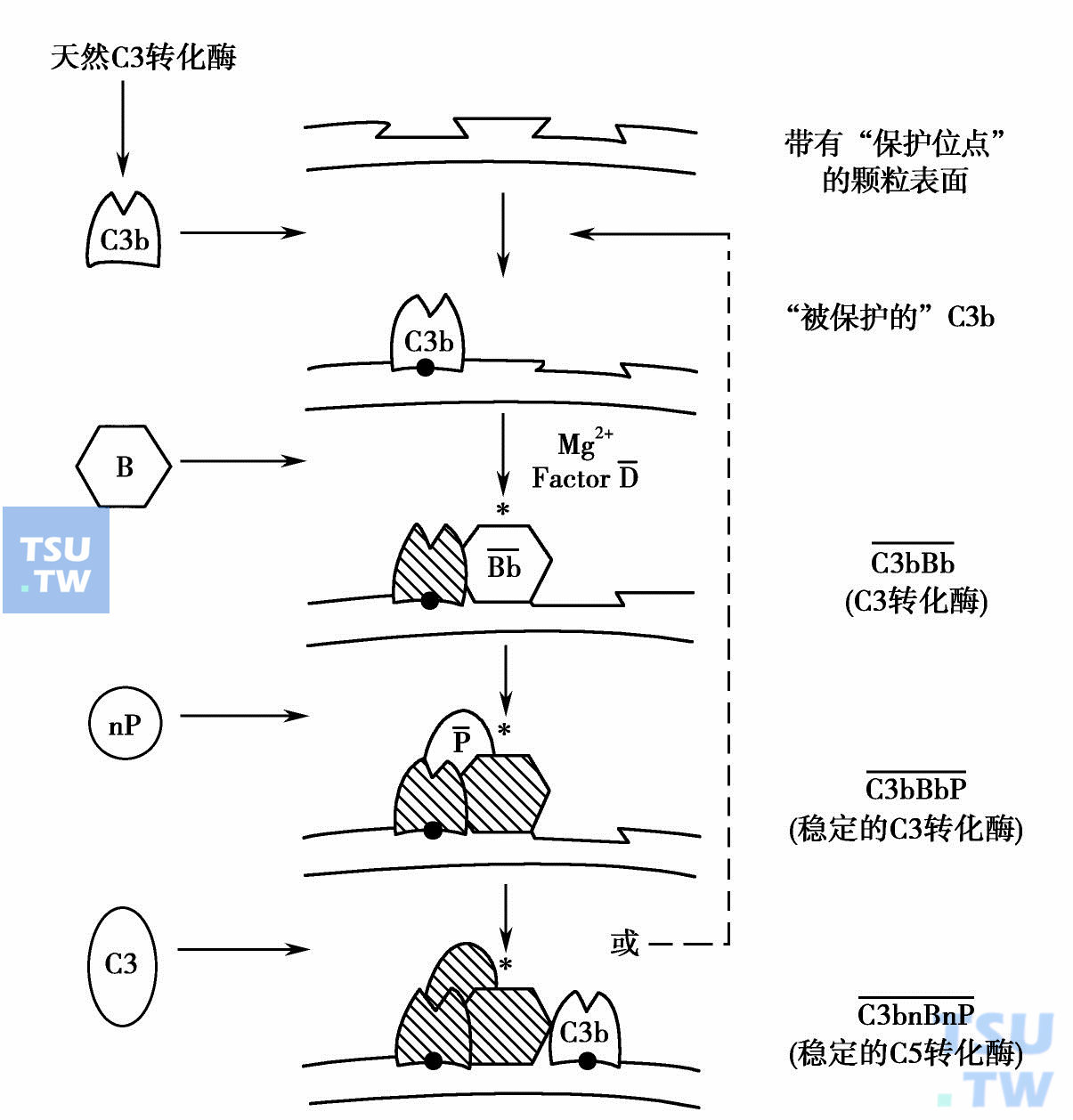
6)C替代途径的激活和控制(下图):经典途径中产生C3b可作为进入替代途径的入口点。镁离子存在下,B因子结合C3b,并被D因子分解而产生C3bBb,这是不稳定的替代途径C3转化酶。然后结合天然备解素,被活化而产生稳定的C3转化酶,C3bBbp。稳定和不稳定的C3转化酶均能使另外的C3分解成C3b。然后,此新生的部分C3b再进入放大环,形成更多的C3转化复合物。C3b加入已有的C3转化酶复合物中,也生成替代途径C5转化酶复合物(C3bnBbP)。有3种机制来控制:①Bb从C3及C3转化酶中自然衰变;②C3b与I因子作用而加快Bb的衰变、分解;③H和I因子协同作用分解C3b,使之灭活。因此,对经典途径而言,替代途径可起到一种放大系统的作用。
然而,人类的替代途径可被众多不同的物质或颗粒激活,不依赖经典途径提供C3b。那么最初的C3b从何而来?有人提出血浆中不断发生C3低水平逆转呈C3b的“C3空转”(“Tickover”)机制。37℃水溶液中C3自然水解引起硫酯键断裂,形成C3(H2O)获得了C3b的功能。此外,任何C3b残基能否支持替代途径取决于对B及H因子的相对亲和性,即辨别机制。在活化表面上C3b对H因子的亲和力是非活化细胞表面上的1/25~1/10,故易形成放大作用。有人提出:唾液酸可使C3b逃脱H及I因子的控制,称为“受保护位点”,但也非决定因素;免疫球蛋白F(ab)2及Fab片段也是新生C3b的最佳受体,可能由于抗体掩饰了唾液酸残基的保护位点作用。肾炎因子(C3NeF)是IgG抗体,与C3bBb结合后对H因子介导的退变分解有高度抵抗力。眼镜蛇毒因子(CVF)的功能类似C3b,是眼镜蛇C3的生理裂解产物,CVF与B因子形成复合物,促进D因子对B因子的分解,而形成活化C3转化酶(CVFBb),H及I因子不能灭活CVF,使血清中C3及B因子大量消耗。
补体受体
补体在激活过程中释放出许多分子,它们与细胞相互作用并调节细胞功能,这些作用是由细胞表面受体介导的。
一、C1q受体(C1q-R):存在于许多细胞表面(中性粒、单核及B淋巴细胞)。C1q-R与留在免疫复合物上的C1q胶原反应,性质不明,似促进ADCC反应;刺激中性粒细胞氧化代谢活性暴增。C1q包被的细菌与C1q-R相互作用后,中性粒细胞的杀菌能力增强。
二、CR1受体:不同的C3降解产物有几种受体。首先发现的是CR1受体(CD35),即免疫黏附受体或C3b/C4b受体。在灵长类的红细胞、中性粒、嗜酸、单个核吞噬细胞、肥大细胞、B及部分T细胞及肾小球足状突细胞均有表达。C3有4个分子量不同(MW160~250kD)的同种异型(A~D),由于硫酯键水解而产生能结合受体的C3构象。
替代途径的激活
C3及C5转化酶的图解。星号代表酶活化补体成分。实圈代表共价结合键。其他键假定为离子键及(或)疏水键。此途径产生的C3b可装配成C3转化酶,再形成C5转化酶或其本身成为新C3转化酶的“孵化”地,因此,呈阳性反馈放大
CR1首选配体是C3b,也可与C4b及iC3b结合。每个红细胞上约有500~600个CR1。系统性红斑狼疮患者红细胞上CR1数减少,肾小球足状突细胞上缺乏CR1,缺陷原因或许与遗传及疾病相关因素有关。正常中性粒细胞及单核细胞上的CR1数居中等(平均5000个/细胞),经各种刺激(C5a、白细胞三烯等)可诱导CR1表达多至50 000个位点/细胞。B细胞上有CR1 20 000~40 000个/细胞。它首先出现在前B细胞上,随细胞分化而CR1密度增高,至浆细胞时CR1消失。CR1的生物学活性较广,与C3b或C4b结合而抑制补体活化,这是CR1对补体的重要调节活性。红细胞表面CR1功能在于结合可溶性免疫复合物,并将其转运至肝脏处理。巨噬细胞表面的CR1主要功能是清除C3b、C4b及iC3b包被的细菌等颗粒。总之,对ADCC反应及吞噬功能有促进作用。
三、CR2受体:CR2受体是C3d/EB病毒受体(CD21),系糖蛋白,MW140kD,在B淋巴细胞及一些原始B淋巴细胞表面表达。CR2具有相当光谱的配体,可结合C3b碎片、C3bi、C3dg及C3d;不结合C3b,但结合EB病毒。C3d与CR2结合的那段氨基酸序列(第1205~1214残基)与EB病毒的gp350相同。已分离出cDNA克隆。CR2的生理作用目前还不太明确,可能对B细胞激活起作用。
四、CR3受体 :CR3受体结合C3bi。在中性粒、单核、B淋巴细胞和红细胞膜上均表达。CR3是异二聚体,由一个165kD的α链(CD116)及95kD 的β链(CD18)组成,且β链为2个其他膜蛋白家族共有,即LFA1(其α链为CD11a)及糖蛋白p150/95 (CD11c,亦称CR4受体)。CR3的α链有C3bi结合位点,其主要生物学功能是增强机体抵抗力,如促进抗体依赖及不依赖细胞介导细胞毒反应、促进吞噬细胞对未经调理的细菌进行吞噬处理。新近报道,严重的反复细菌感染及吞噬功能缺陷的遗传病患者,其细胞表面缺乏CR3α链,LFA-1也不能合成共同的β链,ADCC及AIDCC反应均受挫,白细胞聚集、黏附、趋化功能等均异常,故认为CR3、LFA-1及gp150/95三种蛋白均与细胞黏附现象有关。
五、CR4受体:是对iC3b有特异性的一种糖蛋白(p150/95,CD11c),它属于CD18家族的第3个成员,另两个成员是CR3(CD11b)及LFA-1(CD11a),CD18复合物包括7种其他蛋白质,如血小板糖蛋白GPⅡb/Ⅲa及VLA(T细胞极迟激活抗原)糖蛋白,这些蛋白质也称为整联蛋白,作为细胞内基质的受体,如纤联蛋白、玻连蛋白、血小板反应蛋白、纤维蛋白原及Von Willebrand因子,它们识别C3α链,所有CD18家族成员都是受体或黏附分子。已鉴定出先天性CD18复合物缺乏的患者,并患有反复的细菌感染。
六、H因子受体:该受体与H因子结合。在B细胞、单核及中性粒细胞表达。当H因子受体与H因子结合,则引起内源性I因子释放、刺激DNA合成、淋巴细胞返祖及单核细胞呼吸暴增等。
七、C5a受体:在中性粒、嗜酸、嗜碱及单核细胞表达。C5a与其受体结合后,使中性粒细胞释放颗粒相关酶,嗜碱性粒细胞释放血管活性胺等物质。
