目前已经知道有数种癌基因产物与受体有同源性(下图)。这些产物与生长受体(EGFR)相似,在细胞内都含有酪氨酸激酶PTK,与相应配体结合后PTK活性增高,催化受体自身磷酸化及底物磷酸化,导致促增殖信号的传递,促使肿瘤增殖。因此,PTK是控制细胞增殖、分化信号途径关键组分。PTK活性由于活化突变或过度表达在许多人的肿瘤出现,因此亦是抗肿瘤药物一个很好的靶点,PTK抑制剂是目前抗肿瘤新药开发的热点。
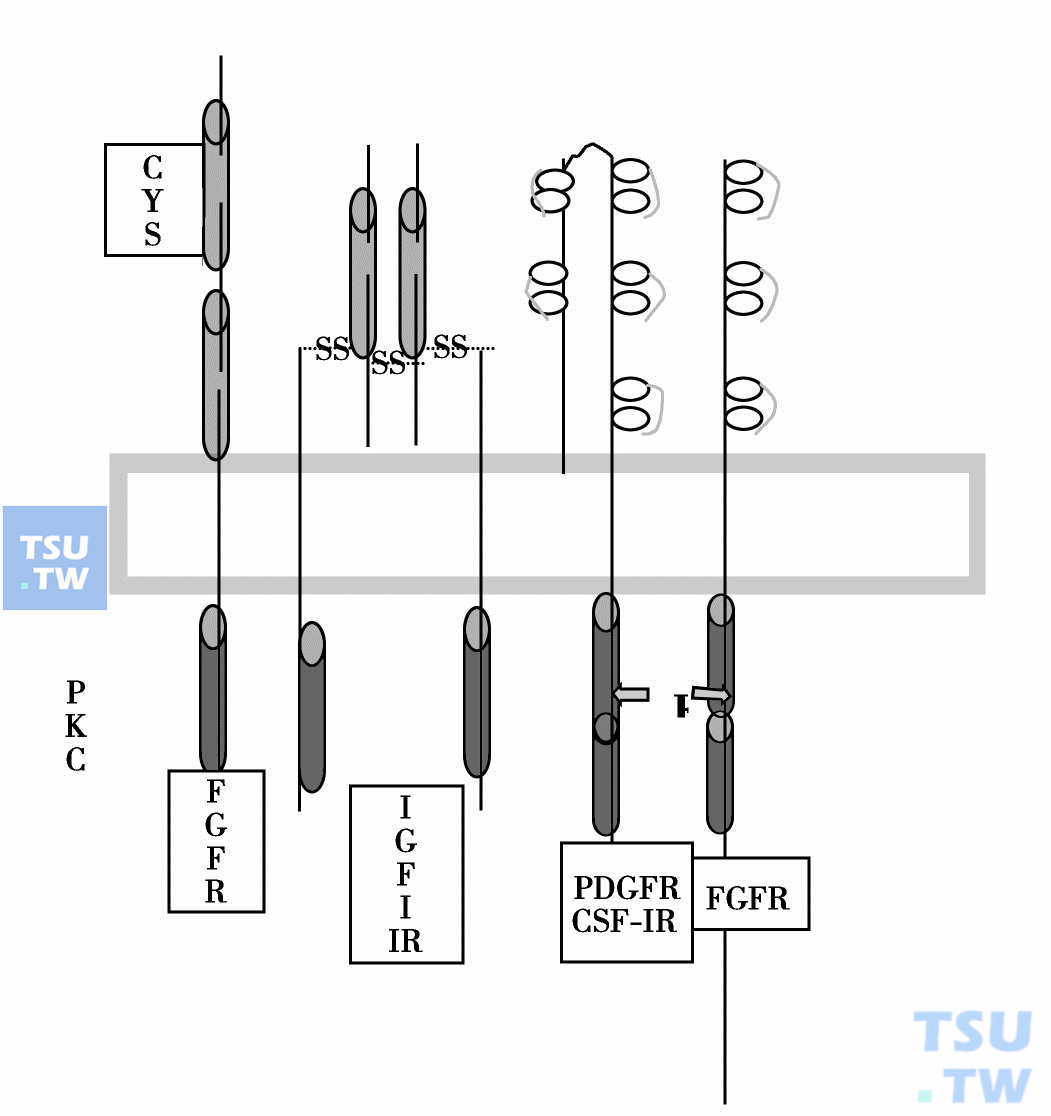
癌基因产物与受体有同源性
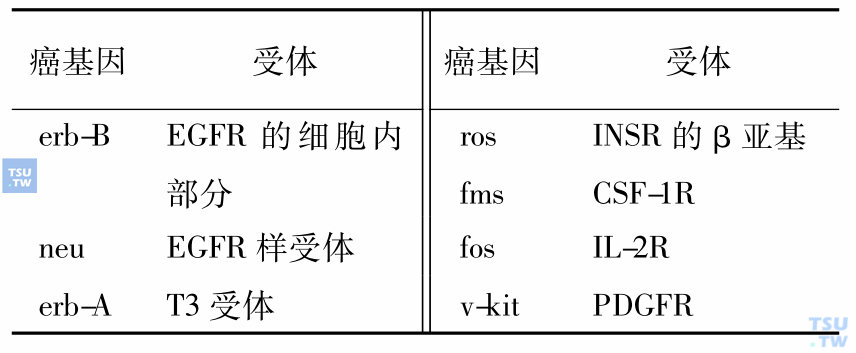
与癌基因同源的受体
目前临床开发主要通过两种途径,针对酪氨酸激酶功能区的小分子抑制剂和针对外功能区的单克隆抗体,如已在临床试验的抗EGFR的单抗C225,抗HERE2的注射用曲妥珠单抗(herceptin)以及抗KDR 的pC101。前者通过抑制自磷酸化阻断信号传递,后者阻断与配体结合。但这些酪氨酸激酶参与正常细胞信号传递。因此,开发的酪氨酸激酶抑制剂必须有高度选择性,而对其他激酶无作用或作用不大。
STI-571
STI-571是新近用于临床治疗慢性粒细胞白血病的一类双芳基咪唑药物。它的作用靶点是酪氨酸激酶家族中Abl和c-kit蛋白激酶。编码Abl蛋白的癌基因abl是过去25年鉴定几百个基因之一,它异常活化能导致肿瘤。这个蛋白提供了一个很好的药物靶点。但很多癌蛋白,包括Abl属于细胞内最大的蛋白激酶家族,它们从ATP转移一个磷酸根到蛋白上。因此,任何尝试消灭变异激酶可能很容易对肿瘤患者产生大量附带的损伤和难以接受的不良反应。但STI-571是一个很特殊的例外。它是在1990年早期筛选出对PDGF的PTK有抑制作用的一系列2-苯胺基吡啶药效基团衍生物中,经过进一步优化得到STI-571,原先命名为CGP57148,发现它同时也抑制Abl和c-kit蛋白激酶。但它对酪氨酸激酶家族中其他50多种却没有作用。
进一步的结构机制(structural mechanism)的研究,将人Abl蛋白催化区和STI-571共结晶,测定它的X线衍射结晶图的三维图像显示,Abl像其他激酶一样有一个“活化区”。它在酶添加一个磷酸基到其他蛋白前,必须有一个磷酸基在那里。这就改变了它的形状或构象,打开活化区可以与ATP与靶蛋白结合。但结晶结构显示,STI-571是与非活化构象结合,从而把它锁定在非活化构象。
当激酶活化时,它们的构象都很相似,但激酶关闭时它们的构象却极不相同。这就证明STI-571对Abl特异作用。蛋白激酶催化区采取特征的非活性构象的能力将证明是这类蛋白的印记,同时也提供了一个新的靶。
SU5416
SU5416也是以PTK作靶点开发出来的新药。它从含有十几万个化合物库中筛选出的氧化吲哚药效基团的衍生物中,采用不同取代基,以构象关系分析优化而得到的两个新的化合物SU4987和SU5402。这两个化合物能抑制成纤维细胞生长因子受体1(FGFR1)的激酶活性而且显示出对其他受体激酶分化的特异性。同时测定了FGFR1的PTK区与化合物结合的复合物的晶体结构,结构机制的研究阐明它们结合的结构特征。从SU5402进一步设计合成出这一系列衍生物中发现,SU5416(下图)对VEGF受体1(Flk-1)的PTK有特异的抑制作用。
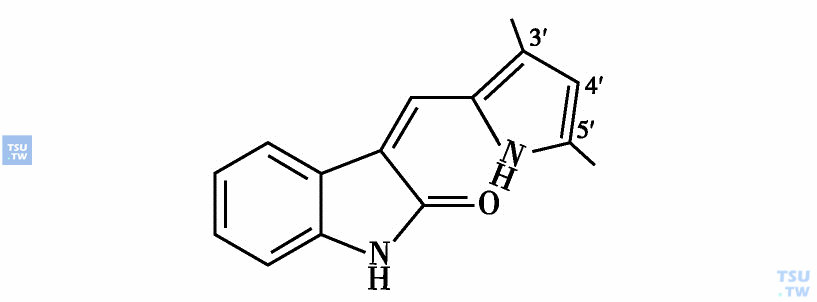
SU5416结构式
现在认为受体酪氨酸激酶(RTK)是直接或间接与血管有关。许多实体瘤的增殖与转移都与VEGF和它的受体Flt-1和Flk-1/KDR相关,因此预测对它的抑制将对肿瘤血管形成会有抑制,进而抑制肿瘤的生长。采用单克隆抗体中和VEGF或阻断VEGF与Flk-1/KDR结合,或开发能渗透过膜抑制Flk-1受体上酪氨酸残基依赖于VEGF磷酸化的小分子,都能抑制肿瘤血管形成。
SU5416就是对VEGF受体1(Flk-1)的PTK有特异的抑制作用的小分子。SU5416能抑制VEGF驱动的人脐带血管内皮细胞(HUVEC)丝裂作用,并呈剂量依赖关系IC50= 0. 04μmol/L,与此形成对照,它阻断HUVEC的FGF依赖的丝裂作用的IC50= 50μmol/L,相差1000倍的选择性(下图)。这与SU5416不能阻断游离的FGF受体自磷酸化相符,证实了SU5416能阻断人细胞VEGF信号传递,并有力地提示它也能抑制与小鼠Flk-1受体上酪氨酸的同源性的KDR的酪氨酸激酶的活性。体内实验证明它对裸鼠移植瘤的生长有抑制作用。现正在进行临床试验。
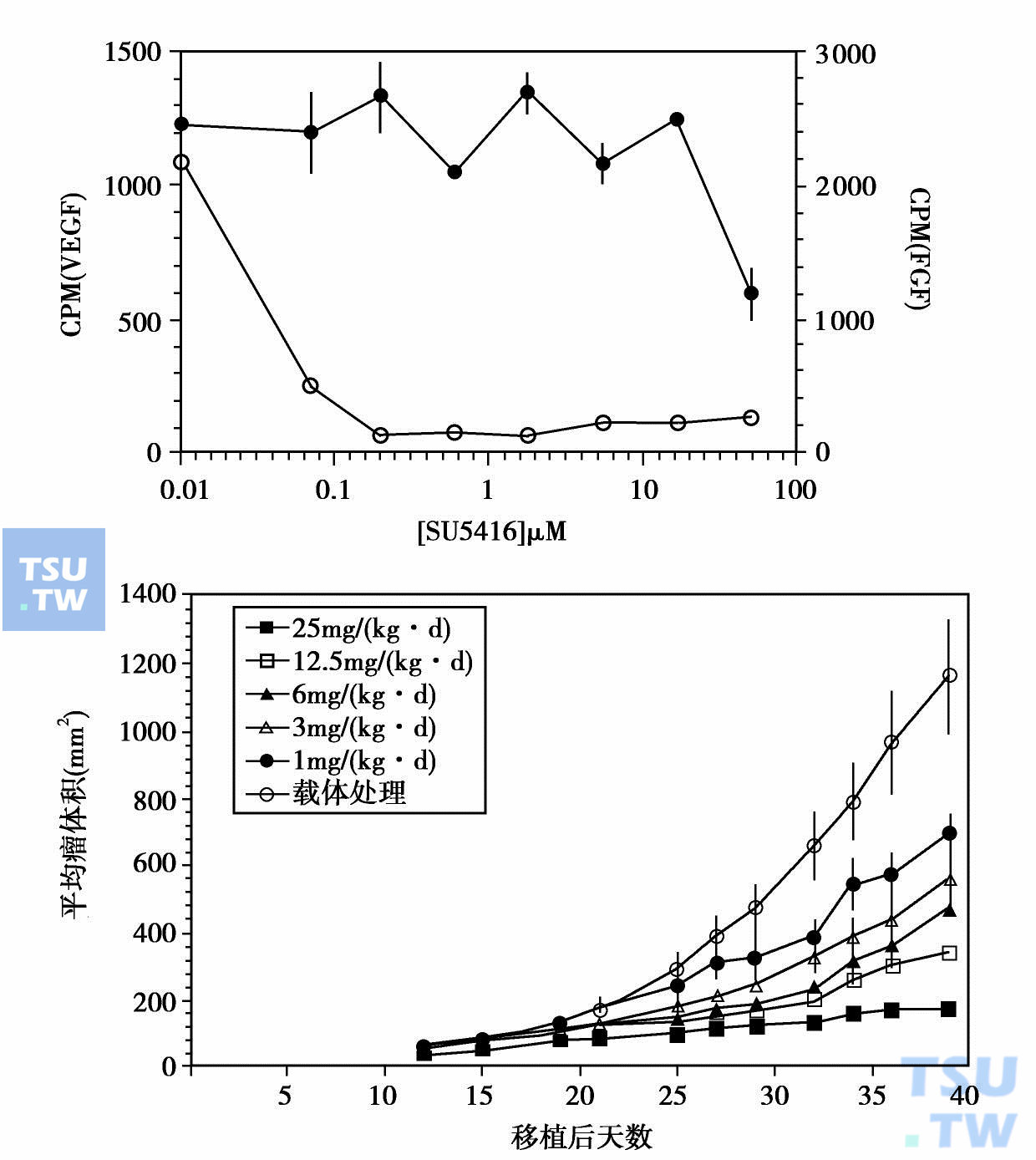
SU5416的IC50
ZD-1839
同样作用于酪氨酸激酶的抑制剂ZD-1839是一种合成的小分子药物,属苯胺喹唑啉化合物,分子量447。ZD-1839具有很好的抗肿瘤作用和很高的选择性。通过口服,ZD-1839可达到有效浓度,而且耐受性在可接受范围。目前正在进行临床试验。
