蛋白质是细胞中含量最多的生物大分子,大约占细胞干重的一半。英文Protein(蛋白质)一词源于希腊文Proteios,原意是“最重要”和“第一”,体现了蛋白质生理功能的重要性。蛋白质分子不仅催化各种代谢反应,而且参与组建细胞结构。体内的任何生理活动(如输送氧、肌肉收缩、免疫反应、凝血、基因表达调控等)几乎都离不开蛋白质。
蛋白质的主要组成元素及其百分比为:C(约50%),H(约7%),O(约23%),N(约16%),S(约1%~3%)。另外,蛋白质往往含有某些微量元素。蛋白质平均含氮16%,这是其元素组成的主要特征。
蛋白质可分成不同类型。按照组分是否单一,蛋白质分为简单蛋白质(simple proteins)和缀合蛋白质(conjugated proteins)两大类。简单蛋白质分子仅由氨基酸组成。缀合蛋白质除了蛋白质组分以外,还有辅助因子(非蛋白质组分),包括辅基、辅酶和金属离子。辅酶以非共价键与蛋白质部分结合,可通过透析或超滤除去;而辅基以共价键与蛋白质部分结合,不易分离。按照形状,蛋白质分为球蛋白和纤维蛋白两大类。大多数蛋白为球蛋白,呈椭球状,能溶于水(膜蛋白除外)。纤维蛋白呈细棒状,有的可溶(如肌球蛋白),有的不可溶(如胶原蛋白、角蛋白和丝心蛋白)。
蛋白质分子量的范围变化很大。烟草花叶病毒外壳蛋白含有2000多个亚基,分子量高达几千万。最小的蛋白质是胰岛素和某些蛇毒蛋白,分子量约6000,小于该下限者称为“肽”(peptides)。蛋白质通常称为多肽(polypeptides)。
肽键、肽平面、二面角和构象
在蛋白质分子多肽链中,每个氨基酸的α-羧基和相邻氨基酸的α-氨基之间已经缩水形成肽键(peptide bonds),每个氨基酸单位称为氨基酸残基(residues)。氨基酸残基通过肽键相连接,必然使蛋白质多肽链具有方向性,即一端(N末端)保留游离的α-氨基,而另一端(C末端)则保留游离的α-羧基。以氨基酸符号表示多肽链的组成,左首为N末端的氨基酸残基,C末端残基居右尾。
肽键中的C—N之间不再是典型的单键,具有部分双键性质,不能自由旋转;而羰基 =C O之间也不再是典型的双键,具有部分单键性质。于是,形成肽键的4个原子与其左右相邻的2个Cα原子处于同一个平面,该平面叫做肽平面(peptide plane)。蛋白质多肽链可以看作是一个个肽平面通过Cα原子连接而成。N—Cα和Cα—C均以单键相连,可以自由旋转,其旋转的角度分别以二面角φ 和ψ表示。正是这些单键的自由旋转,使多肽链折叠成特征性的三维结构,形成不同的构象(conformation)。
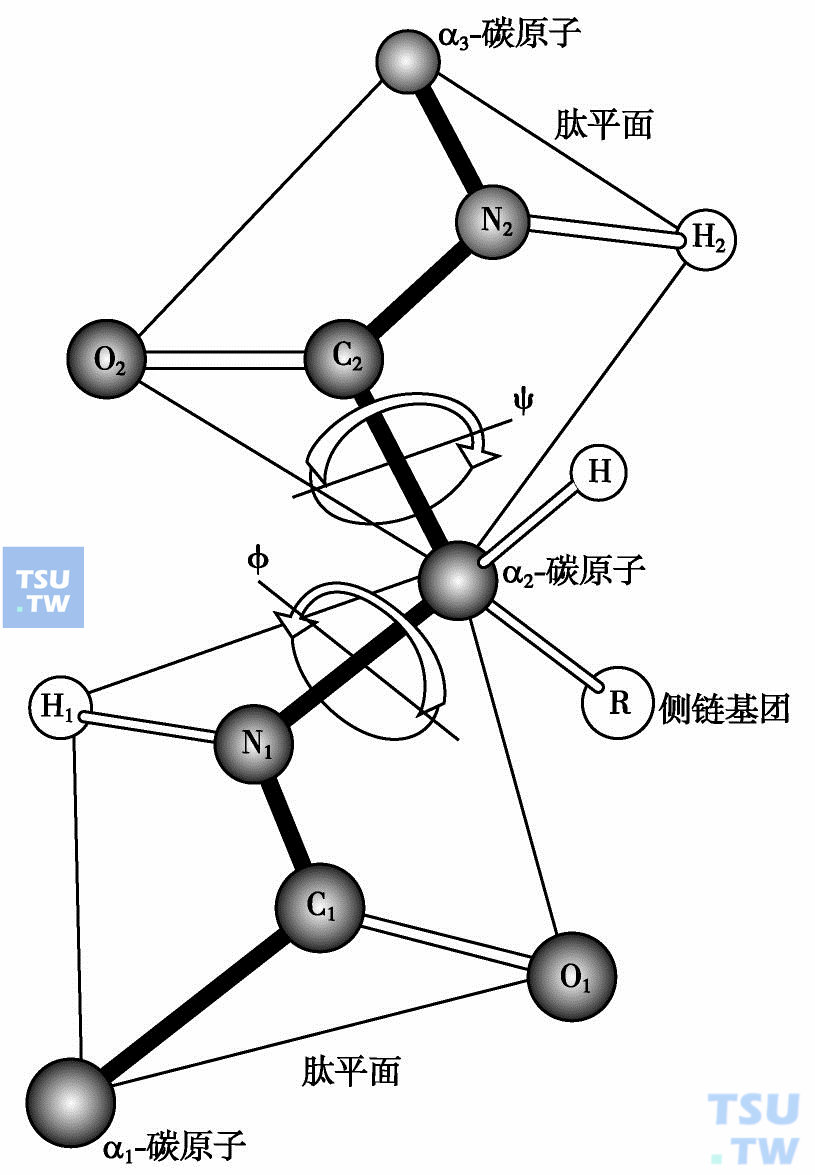
肽平面和二面角
有机分子中的单键自由旋转,导致其原子或取代基团在空间的排列位置不同而产生的立体异构体,称为“构象”。构象之间相互转换无需断裂共价键。
蛋白质分子有严格的结构层次
蛋白质分子有4个严格的结构层次,即一级、二级、三级和四级结构。
蛋白质的一级结构(primary structure)是指氨基酸残基的排列顺序。二级结构(secondary structure)是指多肽链局部的空间结构或折叠方式,常见的二级结构有α-螺旋(α-helix)、β-折叠(β-pleated sheet)和β-转角(β-turn)。三级结构(tertiary structure)是指整条多肽链所有原子的空间排列。四级结构(quaternary structure)是指在多个亚基组成的蛋白质分子中,亚基的种类、数目、在空间的相对位置及其相互作用。
形成肽键的4个原子(C、O、N、H)与其相邻的2 个Cα原子处于同一个平面——肽平面。多肽链是由一个个肽平面通过Cα原子连接而成。N—Cα和Cα—C均以单键相连,可以自由旋转,旋转的角度分别以二面角φ和ψ表示
超二级结构(supersecondary structure)和结构域(domain)介于二级和三级结构之间。超二级结构通常由氨基酸顺序相邻的二级结构单元聚集而形成,如αα、βαβ和βββ等。结构域是在超二级结构的基础上形成的,通常由100~200个氨基酸残基组成,其特点是在三维空间相对独立,往往具有一定的功能。
模体(motif)是一种特殊的折叠模式,通常由若干二级结构单元(或某些氨基酸残基)组成,并出现于多种蛋白质分子的结构域中。例如,在真核生物转录因子的DNA结合结构域中常见的几种模体有锌指、亮氨酸拉链等。
在细胞中,蛋白质分子能够结合成巨型大分子组装体(macromolecular assemblies),如病毒的蛋白外壳,肌动蛋白纤维束以及核孔复合物等。然后,这些大分子结构再和脂类、糖类或核酸等生物大分子结合,形成复杂的细胞器。
蛋白质分子的二级结构
α-螺旋、β-折叠和β-转角是最常见的蛋白质分子二级结构。缺乏特征性折叠规律者通常称为无规则卷曲。胶原蛋白纤维由特殊的胶原蛋白(tropocollagen)三股螺旋组成。
α-螺旋
α-螺旋结构的基本特征是:①多肽链呈螺旋状围绕中心轴右手方向盘绕,每圈约含3. 6个氨基酸残基,螺距约0. 54nm。②肽键的羰基氧原子和C端方向第4个氨基酸残基的酰胺氢原子形成氢键,以稳定α-螺旋。氢键方向与中心轴几乎平行。③氨基酸残基的侧链向外突出,覆盖在α-螺旋的外表面,可影响α-螺旋的亲疏水性(下图A)。
特殊氨基酸Pro和Gly往往迫使α-螺旋中断。携带同种电荷的氨基酸残基相互排斥,可导致α-螺旋不稳定。
在某些α-螺旋中,亲水的氨基酸侧链出现于同一侧,而疏水性侧链集中在另一侧,形成两性α-螺旋。在细胞膜通道蛋白(channels)中,两性α-螺旋沿通道排列,其疏水性一侧向外(朝向膜磷脂双层的疏水核心),而亲水性一侧朝向通道内,有利于亲水的离子或分子穿过通道。
胶原蛋白分子由三条多肽链组成,每条多肽链为左手螺旋(每圈约3. 4个氨基酸残基),三条拧成一股,形成右手超螺旋,每圈约30个氨基酸残基。每条胶原蛋白多肽链约含1000个氨基酸残基,其中90%以上为Gly-Pro-Hyp(或Hyl)重复顺序,Hyp和Hyl分别是羟脯氨酸和羟赖氨酸。由于Pro和Hyp为亚氨基酸,无法形成链内或链间氢键,因此其构象与右手α-螺旋和β-折叠无缘,容易形成左手螺旋。三股螺旋之间的空间只能容纳最小的Gly残基侧链(H原子)。在胶原纤维中,胶原蛋白分子按照1/4错位首尾相连。
β-折叠
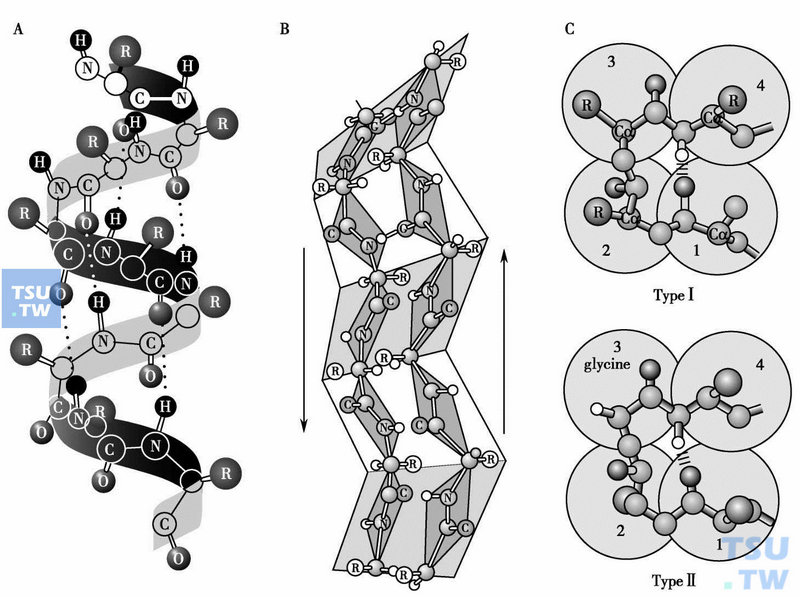
蛋白质分子的二级结构
A.α-螺旋:多肽链骨架折叠成右手螺旋形结构,靠羰基氧原子和酰胺氢原子之间的氢键(虚线)稳定之。氨基酸残基的侧链基团(R)出现于α-螺旋的外表面。B.β-折叠:图示两条反平行β-折叠链形成的β-折叠。C.β-转角:分为Ⅰ类(TypeⅠ)和Ⅱ类(TypeⅡ)两种类型。两者的主要区别是,Ⅱ类的第三个氨基酸总是甘氨酸(glycine)
β-折叠由多肽链内若干平行或反平行的片段(即β-折叠链)组成(上图B),其基本特点是:①β-折叠链几乎完全伸展,一般比较短(5~8个氨基酸残基)。②相邻的平行或反平行β-折叠链通过氢键相互结合以稳定β-折叠,羰基氧原子和酰胺氢原子均参与氢键,使多肽链像手风琴那样的折叠,形成β-折叠片层。③β-折叠链的每个肽平面基本上和相应的β折叠片层平面重叠,氨基酸残基侧链基团交替指向平面的上方和下方。
与平行的β-折叠相比,反平行β-折叠更稳定,因为形成氢键的N-H-O三个原子几乎处于一条直线,氢键更强。
平行排列的β-折叠片层具有自发的右手扭曲倾向,可形成不同形状,如圆桶形(barrel)和马鞍形(saddle)经常出现于多种蛋白质结构域。
β-转角
β-转角呈“U”形,一般由4个氨基酸残基组成(上图C),末端残基之间形成的氢键使之稳定。β-转角使多肽链的方向发生180°的回折,通常位于蛋白质分子的表面。β-转角约占蛋白质分子全部残基的1/4。特殊氨基酸Pro和Gly经常出现于β-转角。
β-转角主要分为Ⅰ和Ⅱ两种类型,Ⅰ类比Ⅱ类多1倍。两者的主要区别在于,Ⅱ类的第三个氨基酸总是Gly。
多肽链也可能发生较长的弯曲,形成环(loops),其形成机制与β-转角不同。
蛋白质分子的三级结构及其稳定因素
多数具有三级结构的蛋白质分子是球蛋白,如酶蛋白(2000多种)、肌红蛋白、珠蛋白、激素蛋白和抗体等。球蛋白的主要特征是:①多个二级结构单位(α-螺旋、β-折叠、β-转角和无规则卷曲)形成紧密的球形构象。较大的球蛋白含有若干个结构域。②多数疏水性氨基酸残基侧链埋藏在球蛋白的内部,形成疏水性核心;而多数亲水性残基侧链暴露于球蛋白表面。内在膜蛋白也是球蛋白,但其亲、疏水性残基分布与之相反。③球蛋白表面往往有一袋形空穴,以容纳1~2个配体(或底物)分子,乃酶蛋白的活性中心之所在。
维持蛋白质分子三级结构的作用力有二硫键(共价键)和次级键(非共价键)。尽管次级键的键能比较弱,但大量存在。次级键有四种类型:氢键、疏水性相互作用、范德华力和离子键(盐键)。其中,氢键、范德华力和离子键的本质均为静电相互作用,而疏水性相互作用是熵驱动的自发过程。
氢键
氢键(hydrogen bond)产生于氢键供体基团和受体基团之间的相互作用。供体基团(X—H)由电负性大的原子(X)和氢原子(H)组成,例如亚氨基N—H和羟基O—H,其中的氢原子显示正电性。受体基团中也有电负性较大的原子(Y),其外层有未共用电子对,显示负电性,例如羰基(=C O)中的氧原子。供体X—H中的H和受体基团Y原子之间产生静电吸引,形成氢键X—H…Y。
氢键具有方向性。如果形成氢键的3个原子在空间的位置接近直线(180°),则产生的氢键最强;如果有夹角(<180°),则氢键减弱。氢键还具有饱和性。供体基团X—H通常只能和1个Y原子结合。
水分子可兼氢键供体或受体,与多肽链中的基团相互作用。蛋白质在水溶液中一般比较稳定。
疏水性相互作用
疏水性相互作用(hydrophobic interaction)是指疏水性基团为避开水相而聚集在一起的集合力。在球蛋白分子的三维结构中,Leu、Ile、Phe、Trp和Pro等疏水性氨基酸残基为了尽可能避开水分子,相互聚集并埋藏于分子内部。这种自发倾向的本质并不是疏水性基团之间有吸引力,而是一种熵(entropy,即“混乱度”)驱动的热力学效应。根据热力学第二定律,自发过程往往增加反应体系的熵,而熵减的过程不能自发进行。
在水的不同状态中,冰的结构最有序,每个水分子和周围的4个水分子通过氢键形成三角锥(正四面体)结构。一旦疏水性基团进入水相,水分子将其团团围住,水分子之间通过氢键排列成高度有序的二十面体笼形结构,每一面为五边形。这种结构比冰更加有序,以致水分子熵减,因此不能自发产生。当多个疏水性基团存在于水相时,这些基团必然相互接近,只有这样才能破坏水分子的笼形结构,增加水分子的混乱度(熵增加)。所以,疏水性相互作用是一个熵驱动的自发过程。
范德华力
范德华力(Van der Waals force)是一种较弱的静电相互作用,包括以下三种作用力:①取向力,产生于永久偶极(极性基团)之间。②诱导力,发生于永久偶极和诱导偶极(非极性基团)之间。③色散力,出现于瞬时偶极(非极性基团)之间,通常是范德华力的主要形式。在非极性基团中,由于电子运动的不对称性,造成电荷密度产生波动,可形成瞬时偶极,并诱导周围的非极性基团形成诱导偶极,后者又能使前者稳定。
离子键
携带正电荷的氨基酸残基(Arg、Lys和His)侧链基团与带负电荷的残基(Asp和Glu)侧链之间可以形成离子键。多数带电荷的侧链基团分布在球蛋白的表面,与介质水分子的偶极相互作用,形成有序的水化层,有利于稳定蛋白质的构象。带电荷基团也能出现于球蛋白内部的疏水环境中,同其他基团形成较强的氢键,并产生少量离子键。由于疏水环境中的介电常数比水中低,故静电相互作用较强,可增加疏水环境中水分子的混乱度,这在热力学上是有利的。
二硫键
多肽链中(或肽链间)的两个Cys残基侧链之间形成的共价键叫做二硫键,可将多肽链的不同部分(或不同的多肽链)连接起来。二硫键一般出现在球蛋白分子表面的β-转角附近,对于三维结构的稳定具有举足轻重的作用。如果二硫键被破坏(还原),往往引起蛋白质天然构象改变,丧失生物活性。但有的二硫键并非蛋白质生物活性所必需。
膜蛋白
生物膜磷脂双层(phospholipid bilayer)结合形形色色的膜蛋白。膜蛋白往往被糖基化修饰。
膜蛋白分为两大类:①内在膜蛋白(integral membrane protein);②周边膜蛋白(peripheral membrane protein)。
内在膜蛋白通常有一个或多个疏水性α-螺旋插入并跨越磷脂双层,膜两侧水相介质还可能有其他结构域。插入膜内的结构域可形成通道(channels),成为跨膜转运蛋白。在细胞膜外侧的结构域可参与细胞信号转导或蛋白质相互作用。在细胞质一侧的结构域的功能广泛,如将细胞骨架蛋白锚定于膜,或介导信号转导等。少数内在膜蛋白通过共价键锚定于磷脂双层中的脂肪酸,但膜蛋白本身并没有插入磷脂双层。
周边膜蛋白仅结合于膜表面,或通过和内在膜蛋白相互作用,或直接与磷脂极性头部基团相互作用,但不和磷脂双层的疏水核心作用。红细胞骨架蛋白血影蛋白(spectrin)和肌动蛋白以及蛋白激酶C(PKC)定位于膜胞质侧。某些周边蛋白定位于膜外侧。
一个重要的内在膜蛋白大家族以含有7个跨膜α-螺旋为特征,其成员已经超过150个,包括:细菌视紫红质(bacteriorhodopsin)、视蛋白、激素受体、味觉和嗅觉受体等。其氨基酸顺序分析结果显示,在同一个位置上没有发现相同的氨基酸残基,仅有少量保守残基。
革兰阴性菌(如大肠杆菌)外膜中的孔蛋白(porins)也是跨膜蛋白,其结构特征与其他内在膜蛋白不同,跨膜区以极性氨基酸为主。孔蛋白由3个相同的亚基组成,每个亚基由16条β折叠链围成圆桶形结构,形成跨膜孔。
在真核细胞中,某些内在膜蛋白并不进入膜磷脂双层,而是以插入磷脂双层中的糖基化磷脂复合物为“锚(anchor)”,将自己的C端共价连接在质膜外侧。糖基磷脂酰肌醇(GPI)是一种常见的锚,含2个脂肪酸酰基基团、N-乙酰葡萄糖胺(GlcNAc)、甘露糖和肌醇。碱性磷酸酶等酶蛋白和Thy-1蛋白通过GPI结合于质膜外侧。某些胞质蛋白锚定于磷脂双层的胞质侧,方法是将C端附近的Cys残基共价连接于磷脂层中的烃基锚(如异戊二烯基、法尼基、牻牛儿基)。有的胞质蛋白以脂类(软脂酸、豆蔻酸等脂肪酸酰基)为锚,其N端Gly残基和锚形成酰胺键,从而结合于磷脂双层的胞质侧。例如,v-Src蛋白结合于磷脂双层的胞质侧,其N端发生豆蔻酸化,才能形成N端锚。
蛋白质结构与功能的一致性
观察蛋白质分子的三维结构,通常可以估计它如何工作。例如,位于核膜的核孔复合物呈桶形,成为分子进出核的双向通道。细菌伴侣蛋白Gro EL/ ES有另一种桶式结构,在其中央空腔中发生蛋白质折叠。某些蛋白质的表面有沟(grooves),成为各种棒形或纤维形分子的特异结合位点。如反转录酶分子表面的沟允许模板RNA沿着酶蛋白表面滑动。DNA拓扑异构酶Ⅱ是一种DNA结合蛋白,其形状如同夹子,顶部和底部可开关,供有缺口(nicked)的DNA链穿过。
很多蛋白质发挥功能涉及构象发生改变。配体(ligands)结合、改变环境或化学修饰都可能诱导蛋白质构象改变。
蛋白质分子的功能往往高度依赖于特异结合其他分子(或配体)的能力。例如,酶蛋白结合特异的底物,抗体结合特异的抗原,激素受体结合特异的激素等。蛋白质分子与其配体间的相互作用有两个特点:一是亲和力(affinity),即两者的结合强度,可用解离常数示之;二是特异性(specificity),即优先结合某分子的能力。这两个特点均取决于蛋白质-配体结合位点的结构。酶促反应和抗体-抗原结合等均证明,为了产生高度的亲和力和特异性,蛋白质分子的配体结合位点的形状和表面必须和配体高度互补。
蛋白质的变性和复性
某些物理因素或化学因素能够破坏次级键,从而破坏蛋白质分子的天然构象,使之变性(denaturation),失去生物活性。例如,加热可以破坏次级键;环境pH的急剧变化能改变氨基酸残基侧链的电荷,破坏离子键和氢键;一定浓度的尿素和盐酸胍(6~8mol/L)能够竞争性破坏氢键;去污剂SDS(十二烷基硫酸钠)破坏疏水性相互作用。另外,有机溶剂、重金属离子、辐射和某些机械力等均可能造成蛋白质变性。变性因素一般不会破坏多肽链的肽键,所以变性蛋白质的一级结构通常保持不变,但它的紧密的三维结构和生物活性均丧失。绝大多数变性蛋白质在水溶液中沉淀,因为在正常情况下埋藏在分子内部的疏水基团暴露出来,并同其他伸展分子的相似基团相互作用,形成不可溶的聚集体。
很多蛋白质在8mol/L尿素和β-巯基乙醇(还原二硫键)的条件下完全伸展。通过透析除去变性剂,蛋白质能够复性(renaturation),重建天然构象所有的二硫键和次级键,恢复蛋白质特有的天然构象和生物活性。
