由于人们在分子水平上对一些疾病发病机制的逐步认识,并有了改变基因结构和功能的手段,使人类用基因治疗来征服过去束手无策的遗传病与肿瘤等将成为可能。
最初基因治疗的研究集中于单基因遗传病,因此Friedman将以正常有功能的基因置换增补缺陷基因的治疗方法称为基因治疗。现在基因治疗的范围已不限于此,也包括获得者得性疾病的治疗,如肿瘤、病毒感染和最近提出的由神经退行性变引起的神经疾病。
至2009年3月,已注册的基因治疗方案1405个(美国占64. 8%),这些方案的临床试验期(trial phases)绝大多数为Ⅰ期,Ⅲ期者仅52个方案。其中癌症治疗居首位(占64. 6%),其次是新血管病(8. 9%)、多种单基因遗传病(8. 1%)、传染性疾病(7. 9%,如acquired immuno-deficiency syndrome,AIDS)、基因标记和其他疾病。
单基因遗传病
单基因遗传病的治疗目前主要采用体细胞基因治疗。一种策略是基因补偿,即把目的基因导入有基因缺陷的患者适当的细胞或组织中,以便为患者提供所缺少的正常基因表达产物,以达到治病的目的。另一种策略是基因替代,即应用同源重组技术使外源正常基因定位导入,修复原有基因的缺陷。由于同源重组率极低以及受精卵基因缺陷的困难,尚不能用于基因治疗。目前采取的主要是基因补偿策略。常通过间接体内(ex vivo)基因转移途径,基本途径是:
- 从个体供者中收集组织或细胞移植物,进行组织培养以确立原始的细胞培养物;
- 把实验的治疗基因转移到这些细胞;
- 把转基因的细胞进行选择或富集培养;
- 自体移植这些转染的细胞到受试患者的靶器官。
基因治疗的成功与否,涉及两个基因问题的解决——载体和受体细胞。载体系统必须安全,不能引发免疫反应或病理过程,且导入率要高。目前病毒载体仍然是转移基因最有效的方法,但不同病毒载体都有其优缺点。至今应用最多的反转录病毒(RV)载体有广泛的宿主范围,感染力高,能稳定地以低拷贝或单拷贝整人宿主细胞等优点。其主要缺点是由于病毒随机整合入基因组,有激活原癌基因和使功能基因失活的可能;另外的缺点是不能整合入非分裂状态细胞,受体细胞必须处于活跃复制增殖状态。
腺病毒也被认为是一种有希望的载体系统,具有感染多种静止细胞的能力,尤其对呼吸道上皮细胞有特殊亲和力。国外已用雾化吸入携带CFTR(囊性纤维变膜通道调节物)基因的腺病毒载体进行基因治疗。动物实验有明显疗效。但临床初步试验表明,转入CFTR基因的量不足和有激发免疫反应的危险。有复制缺陷的重组腺病毒不整合入宿主细胞基因组内,虽减少了插入突变的危险,但导致腺病毒不能在细胞内长期存在,转入基因表达不稳定,故在基因治疗中需多次导入腺病毒,可能会产生免疫反应,从而阻止重复感染。近年来第三代腺病毒载体研究已相当成功,这种新型载体除保留了第一代载体的优点外,还有容量增大、细胞毒性和免疫原性大幅度减弱而目的基因表达时间大大延长等优点,不足之处是辅助病毒产量很高,有个别实验室报道研究已相当成功。
目前引人注意的载体系统是腺病毒相关病毒(adeno-associated virus,AAV)属细小病毒(parvovirus)科,有裂解和潜伏两种生活周期,进行一次完整的裂解周期需要腺病毒或疱疹病毒作为辅助病毒。所以是一种天然的缺陷病毒,不致病。AAV基因组为单链DNA,长约4600bp。AAV令人感兴趣的另一特点,它能高效整合入人类19号染色体长臂,在完全了解定位整入的分子基础后,可以进一步应用于人基因组的其他位点。
单纯疱疹病毒(herpes simplex virus,HSV)是一个很有希望的载体。它可以作为附加体(episome)稳定地存在于静止细胞中,尤其是对神经元细胞亲和力高,对今后神经系统肿瘤的基因治疗会有良好的应用前景。HSV的另一个特点是可以包装多个基因,达35kb。有人认为肿瘤的有效治疗需要转入多种基因,有的基因可以活化药物前体和加强吸收,有的可以活化和增加特异免疫细胞等。应用HSV载体转入多个基因有希望用于肿瘤的治疗。现在已获得可供生长复制缺陷突变体的细胞株,因此已有可能构建没有致病性,不带活病毒的重组体和大量制备高滴度的HSV载体。
近年来,载体系统的研究虽然进展很快,但仍然存在不少问题,所以转移系统仍然是基因治疗的重点。
基因治疗的另一个基本问题是受体细胞,对受体细胞的选择:
- 能使外源基因高效导入及表达;导入率的高低与载体系统的特异性有关,如反转录病毒对分裂旺盛的细胞才有较高的转移率,造血细胞、成纤维细胞较适宜;腺病毒对呼吸道上皮细胞有特殊的亲和力,单纯疱疹病毒对神经细胞亲和力高;
- 转移基因在受体细胞内的表达水平取决于受体细胞是否适宜适合转移基因的表达,转移基因有否足够的序列以及在细胞内的整合状态;
- 体内的基因治疗还应考虑受体细胞易于从体内取出和植回,有增殖优势,生命周期长。
造血干细胞(HSC)是公认最理想的基因治疗靶细胞之一。就造血系统来讲,当然造血细胞是最好的受体细胞。由于HSC具有自我增殖、更新和分化的能力,目的基因导入干细胞如果能长期表达,患者可终生受益。HSC在骨髓或在血液循环之中,目的基因产物都能通过血液循环达到靶器官;尤其是近年来HSC从采集、分离纯化、体外培养、扩增及移植等技术已日趋成熟,为HSC在基因治疗中的应用提供了技术保证,有望成为人类疾病的治疗一种全新的手段。因此HSC介导的基因治疗是近年来研究十分活跃和进展甚快的领域,HSC对载体系统有特殊要求,目前载体系统的缺陷,使得HSC基因治疗仍然存在很多问题有待克服。试用于HSC基因治疗的载体系统主要有以下一些:
一、反转录病毒系统
它仍是目前HSC基因治疗中应用最多的一个。早期在小鼠的实验结果表明,HSC可有20%~30%的基因转移率。意想不到的是以后在大动物及人类的试验中,RV介导的基因转移率,仅为1%~2%,甚至低到0. 1%。两者相差如此之大,主要是RV只能在细胞处于分裂期才能进入核内,而HSC中的90%以上处于非增殖期(G0/G1)期,因此RV不能有效地进入细胞核。另一方面人类HSC表面RV的受体较少,也不利RV的进入。针对上述问题人们做了一些尝试来提高其转移率:
- 加入细胞转移因子3和6进行体外培养,以增加其转移率,但从回输转染过的细胞临床试验,效果不佳。这说明细胞因子可能促进细胞分化,丧失了干细胞的特性。
- 应用骨髓基质支持培养模拟体内环境,使HSC进入细胞周期后,不是进行增殖而是进行自我更新,但现在还做不到。
- 采用新的促分化抑制剂,以阻止HSC向晚期细胞的分化,如应用TGF-β抗体以抑制TGF-β对HSC的促分化作用。
- 采用脐血干细胞或动员外周血干细胞替代骨髓,据观察RV介导脐血干细胞的基因转移率比骨髓干细胞高。这是因为更多地处于细胞周期之中。
- 其他尚有刺激RV受体的表达、增加RV与HSC的接触等的尝试。以上一些尝试,有的有进展但未到完全可用的程度。
二、腺病毒相关病毒(AAV)系统
对HSC来讲,与RV相比,AAV的最大优势在于能感染分裂或非分裂细胞,但仍有很多问题:①大规模制备困难;②定点整合特征的丧失,野生型AAV可特异地定点整合人的19号染色体,重组以后往往丧失这一特性;③AAV载体的宿主范围大,导致了靶向性问题。体内应用常难以获得足够数量的转染细胞数,因此大动物应用后,目的基因在体内的总表达水平仍很低,难以满足临床需要;④AAV导入细胞的机制十分复杂,也缺少有效的包装系统。
三、SV40系统
它是乳多空病毒属的一种为大约5. 2kb的双链病毒,对人体无害。SV40对HSC具有极高的转染率,有报道可高达95%,而且转导过程简单快速。体内回输后可检测到大约20%~30%的转染细胞阳性率,但在早期SV40载体的制备过程有严重污染,污染率高达90%。如能解决制备野生型病毒污染及整合等问题,SV40用于HSC基因治疗将是极有前途的。近年来有人报道SV40包装蛋白有其独特的包装特点,它可包装小至150bp 的SV40序列的基因片段,在体外可由昆虫细胞系统提供包装蛋白来包装由E. coli制备的质粒DNA,为体外包装安全的基因载体提供了可能。
四、慢病毒系统
由于HIV具有可以感染非分裂细胞的特点,尤其对艾滋病的基因治疗有其独特的优点。因此,近年来,人们的眼光投向HIV介导的HSC细胞基因转移。HIV基因治疗的最大问题还是安全性问题,所以人们从开始就着重于研究HIV-1载体系统安全性的改进,主要是设法除去转导不需要的HIV-1本身的基因,以减少病毒的重组及对细胞的毒性。HIV基因编码3个结构蛋白(Gag、Pol与Env)和6个调节蛋白(Vif、Vpr、Vpu、Tat、Rev与Nef)。构建第三代HIV-1载体除保留了Gag、Pol与Rev外,其他均被成功的除去。自身灭活的HIV-1病毒载体已构建成功,去掉了HIV-1 LTR,进一步增加了载体的安全性。从安全角度考虑,构建致病性较弱的HIV-2载体以及非灵长类慢病毒载体的工作已经开始。
随着造血干细胞基础科学的进展,使HSC的基因转移效率在猴子试验中有所增加。新载体如AAV和慢病毒的应用,将会进一步提高HSC的转导效率。这些改进的方法正在应用于临床试验,也初见成效。我们有理由相信,人们多年来的梦想,用HSC基因转移来纠正造血细胞与免疫系统的疾病将逐渐成为现实。
第1例成功的遗传病的基因治疗是一种血液系统的疾病,患者是由于腺苷脱氨酶(adenosine deaminase,ADA)基因缺陷而导致严重的先天性免疫缺陷综合征。美国国立卫生研究院于1990年开始对患者进行治疗。他们采用半体内的方法,取出本人的T淋巴细胞,培养活化,以带有人正常ADA基因和选择标记的反转录病毒感染细胞,然后输回给患者。经过10个月8次治疗,患者血液中ADA水平从2%增至正常的20%,淋巴细胞从570/μl上升至2100/ μl,免疫功能明显改善。此后,又对5例ADA患者进行了基因治疗,后3例采用了造血干细胞,希望得到永久能产生ADA的T细胞。初步的结果表明,已有10%组织中的T细胞携带有正常ADA基因,令人鼓舞。
乙型血友病的治疗是我国复旦大学遗传所与长海医院首先开展的。他们将人Ⅸ因子cDNA转入乙型血友病患者的皮肤成纤维细胞,体外培养扩增后,与胶原混合皮下注射,也初见成效。
肿瘤
由于肿瘤基因治疗基本不涉及社会论理问题,也可以不考虑外源基因终身表达的问题,加之肿瘤发病率高与临床的迫切需要,近年来发展甚快,新方法也层出不究。下表列出了一些肿瘤基因治疗的策略。
肿瘤基因治疗的策略

RAC已经批准的肿瘤基因治疗实验方案中的许多为免疫相关基因治疗。患者的肿瘤细胞在体外导入细胞因子后,再经体外培养,注回患者体内,激活其免疫系统,杀伤肿瘤细胞和免疫患者,从而防止肿瘤复发。使用的细胞因子基因至少有12种,如IL-2、IL-4、IL-6、肿瘤坏死因子(TNF)、巨噬细胞粒细胞集落刺激因子(GM-CSF)、γ-干扰素等。动物实验表明,细胞因子导入肿瘤后,宿主的免疫系统对肿瘤的识别及杀伤能力都有所改善,所作用机制稍有差别,主要表现在效应细胞不同,如IL-2诱导抗肿瘤作用的细胞主要是细胞毒淋巴细胞(CTL),而IL-4则是巨噬细胞及嗜酸性粒细胞。有些细胞因子可使肿瘤细胞MHCI型抗原表达量增加和肿瘤免疫原性增强。免疫治疗的临床试验主要是将IL-2、INF 或GM-CSF基因在体外导入黑色素瘤、大肠癌、肾细胞癌、神经母细胞瘤或乳腺癌细胞。最初的治疗集中于黑色素瘤和肾细胞癌,因为人们认为二者较其他肿瘤有较强的免疫原性,对免疫治疗会有较好的效果。
肿瘤基因治疗方案中的一些,应用了导入自杀基因的策略。“自杀”基因是指编码使细胞产生致死性内毒素的蛋白质基因。一般靶细胞中导入非哺乳动物的代谢酶,使相对无毒的前体药物转变为高毒性的药物。所以只有导入“自杀”基因的细胞才能产生毒性药物而不会有全身性的毒性。至今自杀基因体系仅用于肿瘤与HIV的治疗。单纯疱疹病毒胸苷激酶(HSVtk)是研究得最多的酶前体药物体系,其他在发展中的体系尚有胞嘧啶脱氨酶与水痘带状病毒胸苷激酶。HSVtk的底物特异性与正常细胞不同,它作用于鸟便嘌呤类似物阿昔洛韦(acyclovir)与更昔洛韦(ganciclovir,GCV)。用携带HSVtk基因的逆转录反转录病毒感染肿瘤细胞,将其导入机体并注射前体药物GCV。HSVtk酶使GCV磷酸化生成高度毒性的三磷酸酯(GCV-TP)。它可以抑制α-DNA聚合酶并渗入DNA以阻断DNA合成。靶细胞产生的GCV-TP,也可导致其周围肿瘤细胞的死亡,称为旁观者效应(bystander effect)。其机制尚不清楚。体外与体内的实验都显示HSVtk体系对不同肿瘤都是有效的,但对来自造血细胞的肿瘤效果较差。如Mocllen等用反转录病毒载体导入HSVtk基因于小鼠淋巴瘤体外有效,但体内不能使肿瘤消失。修正肿瘤的相关基因也是肿瘤基因的重要策略。许多研究表明,癌基因的过量表达、抑癌基因的丢失与肿瘤的恶性表型密切相关。
天然的反义RNA是mRNA的互补链,广泛存在于自然界,是生物体内的一种重要调控物质。它能特异地与mRNA互补而抑制特定基因的表达。人们模仿天然存在的反义RNA,合成反义基因,或反义寡核苷酸,导入细胞后,对特定的基因产生抑制作用。应用反义寡核苷酸(长度为10~20bp)抑制过量表达的癌基因,可以使肿瘤细胞生长减慢,软琼脂集落形成及裸鼠致瘤能力的显著下降,甚至完全丧失。如反义Ki-ras可使非小细胞肺癌细胞生长减慢4倍,裸鼠致瘤能力明显减弱。以bcr/abl连接处的反义寡核苷酸处理CML患者的原始细胞,可以抑制白血病细胞的集落形成。如以反义bcl-2反义寡核苷酸或修饰的寡核苷酸与淋巴瘤和白血病细胞共同培养,两者均可抑制瘤细胞的增长,而后者的效力更高。许多肿瘤如多形神经胶母细胞肿瘤(glioblastoma multiform)、乳腺癌均有高水平的胰岛素生长因子-1(insulin-like growth factor-1,IGF-1)。导入IGF-1反义基因可以停止IGF-1的产生。此项治疗已批准进行临床试验。
反义寡核苷酸在体内易被降解,所以必须加以修饰。如以S或CH3取代磷酸基上的氧,以增加对核酸酶的抗力。反义寡核苷酸设计在不同的作用位点,可以在转录和转录后加工等不同阶段产生抑制作用(下图)。反义寡核苷酸的研究结果,多数是体外实验得到的。动物试验表明它的毒性低,但对临床来说,只有在它的摄取、细胞内运转、药代动力学以及毒副作用等问题进一步解决和澄清后,才能应用于临床。
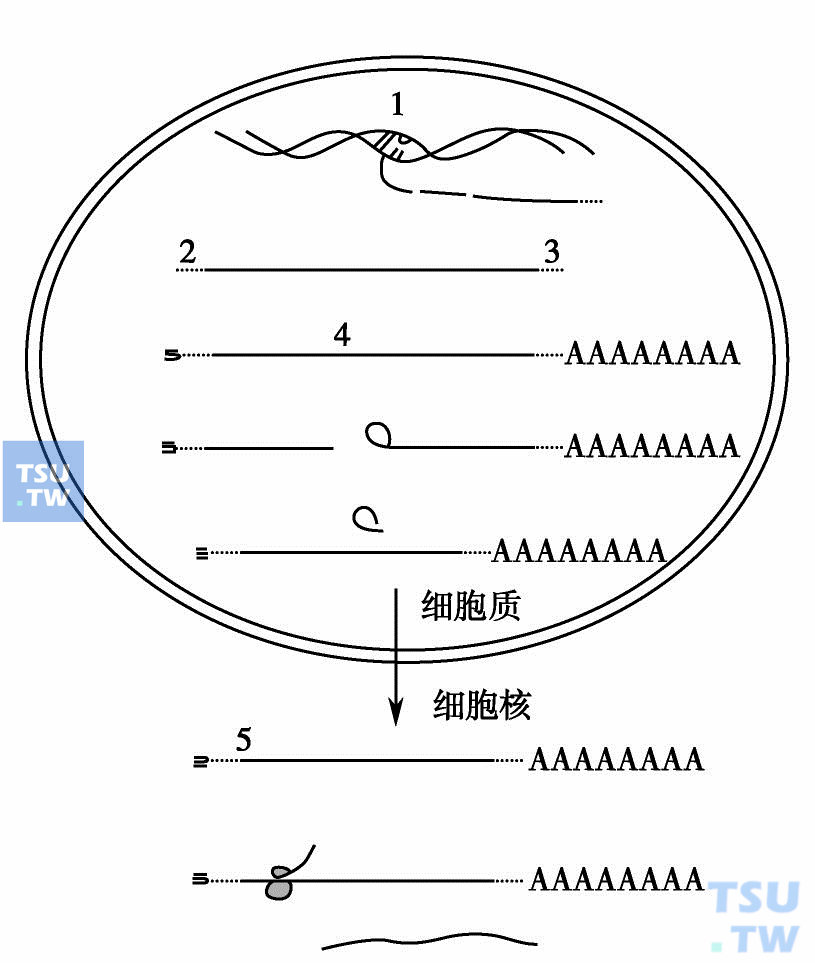
反义寡核苷酸可能作用的位点
图中:1. DNA双螺旋,形成三聚体抑制转录;2. 5'帽位点,抑制与40S核糖体的结合;3. 3' polyA位点,抑制polyA尾的形成;4.切接位点,抑制切接;5.转译起始位点,抑制与80S核糖体的结合
在肿瘤细胞中输入野生型抑癌基因以使肿瘤细胞恶性表型逆转。如急性淋巴母细胞瘤恢复野生型p53基因的功能,可使其失去琼脂集落形成能力及致瘤能力。4项采用抑癌基因导入肿瘤进行治疗的临床试验已获批准。如导入正常p53基因于p53基因缺陷的非小细胞肺癌进行治疗。
到目前为止,很多基因治疗是用载体介导,以ex vivo方式进行的,这种方式步骤多,费用大,较难在临床上广泛应用。因此,有不少工作者对体内(in vivo)基因治疗进行了试验。in vivo基因转移,是一种将插入目的基因的表达载体稍加处理后就直接导入体内细胞的方法。皮肤、肌肉、肝、血流、肺等可能作为基因转移的靶子位点。应用脂质体转移基因有几个优点:①与病毒载体相比,较为安全;②易于制备;③携带的核苷酸分子没有长度的限制;④可以导入处于静止状态的细胞。DNA与脂质体的结合可以包裹在脂质体的水相部分,也可以与脂质体结合制成阳离子脂质体。脂质体还需要加入辅助脂质以使脂质体稳定分散和改善细胞质中DNA的转运。这类脂质体已有不少公司生产供应。最早这方面的试验是直接原位注射带有编码HLA-BT的基因脂质体。这是一种外来抗原,短暂的表达于细胞表面,可诱导出对肿瘤细胞的免疫反应。动物试验与上述结果类似。初步临床试验结果3位黑色素瘤受试者,其中1位产生全身性的抗黑色素瘤的免疫反应。进一步的试验已得到批准。
反转录病毒的原位体内基因转移已试用了治疗肿瘤。方法是把产生反转录病毒的细胞(VPCs)直接植入生长的脑瘤,在肿瘤细胞周围用反转录病毒导入HSVtk基因。由于反转录病毒只能感染分裂细胞,HSVtk基因也只能整入到增生旺盛的肿瘤细胞。应用大鼠模型有30%~60%HSVtk基因导入肿瘤细胞,但有80%的肿瘤细胞遭到破坏,说明一部分肿瘤细胞是通过旁观者效应致死的。没有见到全身性的毒性反应。对12名脑瘤患者进行了此项试验。在注射VPCs 1周后每日静脉注射2次GCV,连续14天。初步观察,其中8个多形神经胶母细胞瘤复发或转移患者有不同程度的抗肿瘤反应。更完善的进一步临床试验已获批准。
血栓性疾病的基因治疗
用基因工程生产的药用组织纤溶酶原激活剂(t-PA)已在血栓性疾病的治疗中取得了巨大成功。不足之处是生产成本高,体内的半衰期短,因此需要的治疗剂量高和长期给药。为此许多研究工作者对t-PA的基因治疗作了尝试。目前认为较有希望的方法是借反转录病毒在内皮细胞或平滑肌细胞导入t-PA cDNA,然后将细胞种植在血管内支架、人造血管移植物、人造心脏、人造瓣膜的腔面或缝线。这种方法的动物试验已取得较好结果,在支架后移植物上的内皮细胞有外源基因的表达,为今后在人体上的试用打下基础。
虽然基因治疗研究取得了不少进展,但从总体上说仍不够理想,在几千名受试者中,很少有治愈,绝大多数是病情改善的报告。基因治疗遇到的主要困难是在转移基因到足够数量的靶细胞并使基因得以表达方面。这个问题围绕着基因治疗的整个领域。基因治疗的安全性问题近来也引起人们极大的关注。如在利用反转录病毒介导的基因转移方法,治疗镰刀型细胞贫血和X-连锁重症联合免疫缺陷性疾病(X-SCID)时,都发现过产生白血病样副作用现象的情况。尽管如此,由于基因治疗的重要意义,并没有减少科学家们的研究热情及有关国家部门和企业界的投入,因此基因治疗研究有着光明的前景。
(吴冠芸 张俊武 沈岩)
