红细胞膜的结构符合“流动镶嵌模型”理论,以脂质双层为主要支架,蛋白质嵌于或贯穿脂双层(内在性蛋白),或者处于脂双层的两侧(外在性蛋白)。红细胞膜的理化性质亦遵循生物膜的一般规律,详见生物膜结构与功能。
红细胞膜有很多特点,它有很强的变形性、柔韧性及可塑性。因为成熟正常红细胞寿命120天,在生存期间大约行程50万米,每周身循环一次,一方面要穿过小于自身一半的微小通道(脾窦),在脾内氧少、pH低,条件不利;另一方面又经过心脏内瓣膜涡流冲击。可想红细胞有比其他任何一种膜具有更大的变形性、柔韧性及可塑性,才能使红细胞有此特殊功能,其所以有如此特性,是由于红细胞膜的骨架蛋白起着重要的作用。此节着重介绍骨架蛋白的组装。
在红细胞生成过程中骨架的组装
从干/祖细胞发育成红细胞的过程中,骨架蛋白也同样不断合成与组装。在CFU-E阶段时,收缩蛋白、4.1及2.1蛋白已合成,但代谢很快,没等网形成即分解了。到原始红细胞阶段,收缩蛋白的两个亚基合成的速度不同,α亚基合成的速度又快又多,大约是β亚基的4倍。α及β亚基合成后,由于它们有许多螺旋区,很易自身集聚形成α2β4,这些聚体很快被酶水解。只有当带3蛋白、2.1及4.1蛋白合成后,才形成真正的网状骨架结构。从原始红细胞到网织红细胞阶段,逐渐脱去细胞核。在有核存在时,核膜外有弹丝蛋白(vimentin)及韧蛋白(desmin)组成的中间丝,这些中间丝盘成一个套,围绕在核的周围,核膜内侧有层粘连蛋白通过核孔与弹丝蛋白相互联结,中间丝的另一侧与骨架蛋白相连。脱核时,弹丝蛋白与韧蛋白和核一起脱落,所以成熟红细胞没有这两种蛋白。
红细胞膜骨架的组装
在红细胞膜的胞质面有一个由骨架蛋白联结形成的网——膜骨架。Palek曾提出红细胞骨架形成横向竖向的相互作用的假说,横向是指与膜平面平行网,主要由收缩蛋白四聚体及收缩蛋白-肌动蛋白-4.1蛋白复合体的接头所形成的网,当膜受压,支撑着膜使其不受损;竖向是指与膜垂直方向的网,稳定膜脂双层的作用,包括收缩蛋白-2.1蛋白-带3蛋白之间的相互作用,4.1蛋白-血型糖蛋白3的作用及骨架蛋白和脂双层内层带负电荷脂质之间的作用。Sung用电镜观察到红细胞内的骨架是由33 000个蛋白质组成6角形结构,其中心点是复合蛋白质称原丝(protofilament)主要由肌动蛋白组成37纳米大小的球状,以它为中心悬挂着6条收缩蛋白,这6条收缩蛋白可使原丝有弹性,又可自由的从左到右与膜平行方向移动,与膜垂直方向也可运动但比平行方向稍差。这种运动可加速氧的运输,更重要的是变形性非常好,所以红细胞才可自由穿过比它小很多倍的脾窦。
一、收缩蛋白与2.1蛋白及带3蛋白的相互作用
2.1蛋白结构中的90kD区可结合带3蛋白,72kD区可与收缩蛋白结合。带3蛋白是个跨膜蛋白,所以2.1蛋白是个靶,把收缩蛋白锚固在细胞的质膜上。带3蛋白伸向胞质部分与2.1蛋白结合,亲和力很强,有人用带3蛋白抗体处理红细胞,同样可抑制与2.1蛋白的结合。
二、收缩蛋白与4.1蛋白及肌动蛋白的相互作用
电镜下观察红细胞膜骨架为一个由多角形组成的网,中心有球状结构。经分析网架为收缩蛋白β亚基,球状物为肌动蛋白、4.1蛋白及收缩蛋白四聚体尾部相互结合形成的三元复合体。如没有4.1蛋白的存在,收缩蛋白不能与肌动蛋白结合。一般认为12~17个肌动蛋白寡聚体与4.9蛋白及原肌球蛋白组成一个基本结构单位,然后再结合到收缩蛋白和4.1蛋白的复合体上。4.9蛋白及原肌球蛋白可能起稳定肌动蛋白寡聚体的作用。
三、4.1蛋白与血型糖蛋白的相互作用
4.1蛋白的N-端,30kD的区域,由于等电点为7.8,生理状态下带有正电荷;血型糖蛋白A及C带有大量唾液酸,带有负电荷,磷脂酰肌醇(PI)也带负荷,4.1蛋白可能以静电与血型糖蛋白A、C及肌醇磷脂结合。如将血型糖蛋白A及C嵌入人工脂质体,与同位素标记的4.1保温,在人工脂质体中可测出同位素,证明4.1可与血型糖蛋白A、C结合。
四、肌动蛋白与凝溶胶蛋白之间的相互作用
凝溶胶蛋白(gelsolin)是存在胞质内的蛋白,分子量为95kD。用糜蛋白酶处理可得两个片段,N端分子量为45kD,C-端分子量为47kD,这段可与肌动蛋白及Ca2+结合。
凝溶胶蛋白与肌动蛋白作用很复杂,可能有两种作用:①凝溶胶蛋白将与肌动蛋白纤维(F-肌动蛋白)断裂成肌动蛋白单体(G-肌动蛋白);②凝溶胶蛋白结合到肌动蛋白的生长端,似是给肌动蛋白戴上一个帽子,抑制肌动蛋白成纤维状。从以上两种作用看,凝溶胶蛋白主要是抑制肌动蛋白成为长纤维,也就是使它不形成网,从凝胶相(gel phase)转变为溶胶相(sol phase)。
凝溶胶蛋白与肌动蛋白的作用依赖Ca2+的浓度,与Ca2+的亲和力很强,μmol的浓度即可促进凝溶胶蛋白与肌动蛋白的结合。PIP2可抑制它们的结合。
骨架蛋白的磷酸化
骨架蛋白的网根据生理情况有时松散,有时紧密,现知主要是由磷酸化和脱磷酸化的调节,如将完整的红细胞与32P保温,检测骨架蛋白磷酸化的情况,结果发现除肌动蛋白外,其他的蛋白都可磷酸化,磷酸化时,骨架趋于松散,脱磷酸化时网比较紧密。将各蛋白磷酸化的情况列见表:
红细胞膜骨架蛋白的磷酸化
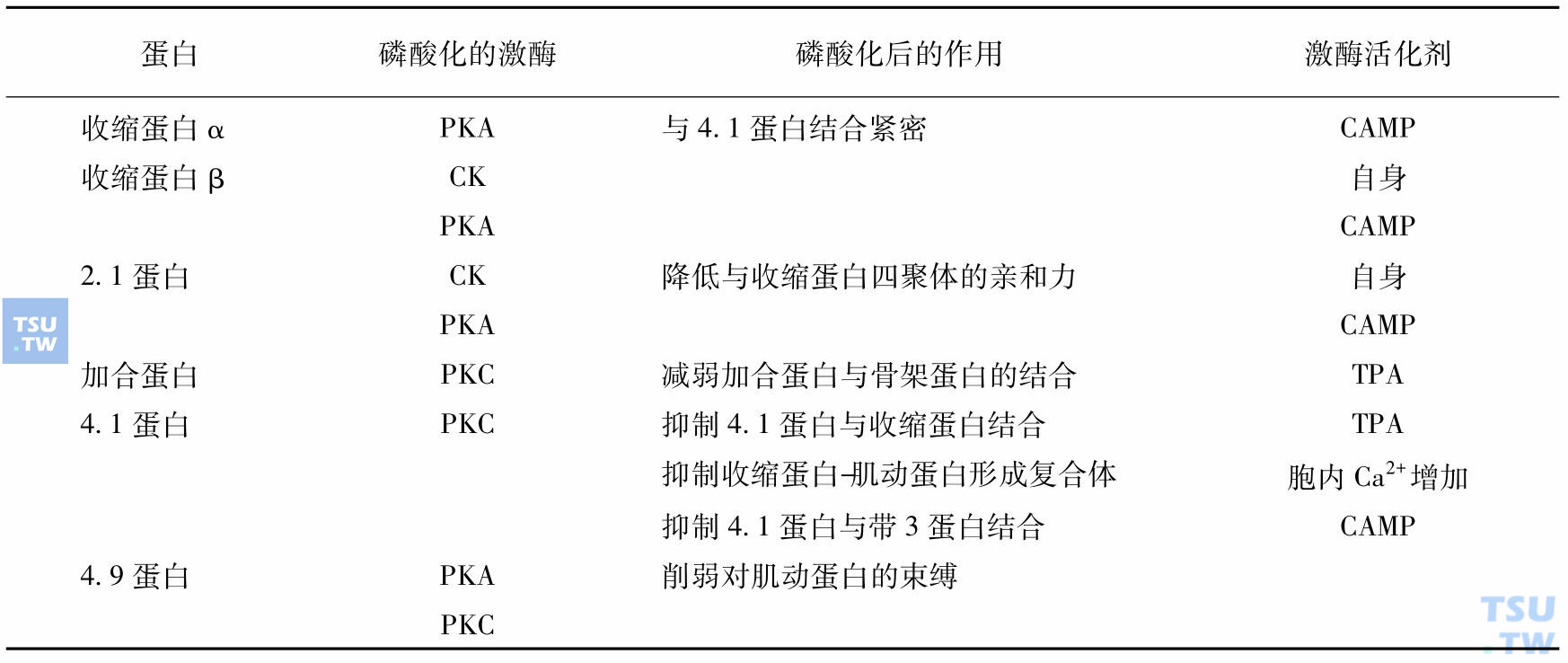
注:PKA:蛋白激酶A;PKC:蛋白激酶C;CK:酪蛋白激酶
肌醇磷脂对骨架蛋白的调节作用
肌醇磷脂有多种:磷脂酰肌醇;4,1-磷酸磷脂酰肌醇(PIP);4,5,2-磷酸磷脂酰肌醇。虽然它们在红细胞膜上含量很少(占总磷脂的2%~5%),但在信息传递中起着很重要的作用。膜内的肌醇磷脂分布在脂双层的内侧,红细胞内有各种肌醇磷脂的激酶,可使肌醇磷脂磷酸化,又有磷酸酶使它们脱磷酸化,形成一个循环,依生理情况进行反应。4,5,2-磷酸磷脂酰肌醇主要是促进血型糖蛋白与4.1蛋白的结合。
