本栏开头已述血红蛋白是一种双向呼吸载体,它既能将O2由肺运到组织,又能将CO2由组织运至肺部。血液中O2的运输有两种形式,一种是以物理溶解形式运输的O2,由于O2在血液中溶解度很小(在动脉血中的溶解量约为0. 3mg/100ml),故只有极小部分的O2是以这种形式运输的(3. 6%);另一种是O2和红细胞中的血红蛋白结合而运输的,占血液中O2运输的绝大部分(96. 4%)。此外,人体在代谢过程中产生的CO2,其中约30%是由Hb(HbNHCOOH)运输到肺部排出体外的。
氧合血红蛋白的生成及氧解离曲线
血红蛋白与O2结合形成氧合血红蛋白(HbO2),两者既能迅速结合,也能迅速解离,结合与解离取决于氧分压(PO2)的高低。在肺部,血液O2分压增高,血液中大部分Hb与O2结合生成HbO2。在组织,O2从血液弥散进入组织细胞,血液O2分压降低,使一部分HbO2解离成Hb和O2,所释放出的O2供组织和细胞利用,这个过程可用下式表示:

氧合Hb是鲜红的,脱氧Hb是暗红的。动脉血中绝大部分是HbO2,所以动脉血是鲜红的。静脉血中未结合O2的Hb较多,所以静脉血是暗红的。据测,1分子Hb能和4分子O2结合生成HbO2,也就是说1mol Hb能结合4mol O2。在标准状况下4mol O2的体积为22. 4L×4=89. 6L,即1g Hb能和1. 34ml O2结合。正常人每100ml血液含14~15g Hb,氧结合量可达19~20ml/100ml,是动脉血中溶解O2量的67倍多(20/0. 3)。可见Hb分子携带O2的能力是很强的。实际上,如上所述,O2在血液中运输约96%是和红细胞的Hb结合而运输的,只有较小部分的O2是以物理溶解形式运输过来的。据测,每100ml血液每循环一次释放O25ml,能够满足组织细胞对氧的需要。现在已知结合了O2和未结合O2 的Hb分子在空间构象和性能上是有不同的。当Hb氧合时,其分子结构发生一系列变化,其中有若干盐键的断裂,某些小分子化合物的出入以及亚单位的移动。血红素平面中央的Fe原子半径减小,比脱氧时体积减少13%,从而使Fe原子进入卟啉环平面内,导致Hb分子空间上构象发生变化。当O2与Hb分子中的一个血红素结合,会使血红素平面另一侧的近位(F8)组氨酸残基位置发生变化,这样就引起了这条肽链的空间构象发生变化,随之使肽链之间的盐键断裂,四条多肽链彼此松开,从而使血红蛋白四聚体在氧合作用中从T构象逐步变成为R构象。R构象比T构象对O2的亲和力要大300倍。组成Hb分子的4个亚单位并非同时与O2结合,而是有先后顺序的。
一般认为首先与O2结合的是α珠蛋白链,然后才是β珠蛋白链,因为X射线晶体衍射分析结果证明α珠蛋白链的血红素窑洞比β珠蛋白链较宽敞,氧分子容易进入并与血红素铁结合。那条最先与O2结合的α链,空间构象的改变又会引起另外三条肽链构象的改变,而分子构象的改变又会引起分子性能的改变,这就是说当Hb分子的一个部分结合O2后,会改变Hb分子别的部位结合O2、H+、CO2和有机磷酸酯(如2,3-二磷酸甘油酸,简称2,3-DPG)等的性能。反之亦然,当H+、CO2 或2,3-DPG和Hb分子上的一个部位结合时,也会改变Hb分子别的部位的构象和性能。这就是Hb的变构效应。因为Hb是一种变构蛋白质,其变构性能来自亚基之间的协同作用(血红素与血红素之间的相互作用)、亚基与H+、CO2或与2,3-DPG之间的作用。Hb这种变构效应使Hb的各种功能相互影响、相互制约,赋予生物更能适应环境中的各种因素的变化能力。
O2和血红蛋白结合与解离的变化并不呈直线的比例关系,而是呈“S”形曲线,称为Hb氧合或HbO2解离曲线(下图),它是通过血液O2饱和度对氧分压(PO2)作图得出的。所谓血液O2饱和度即为氧合部位的占有率,具体来说就是HbO2的量和Hb总量的比值(HbO2/HbO2+Hb)。而氧合肌红蛋白的氧解离曲线为双曲线,对任何给定的PO2,肌红蛋白的Y值总是比血红蛋白者高,也就是说肌红蛋白对氧比Hb对氧有较高的亲和性。通常用一个称为P50的量来表示Hb对O2的亲和性或氧解离曲线的位置。P50是指Hb的氧饱和度为50%(而Y=0. 5)时相应的PO2值。肌红蛋白的P50为1,而Hb的P50为26. 0,这表明P50减少,Hb对O2的亲和力增大,HbO2氧解离曲线向左移动;P50增大,Hb对O2的亲和力减小,HbO2氧解离曲线向右移动,HbO2易于释放出O2。
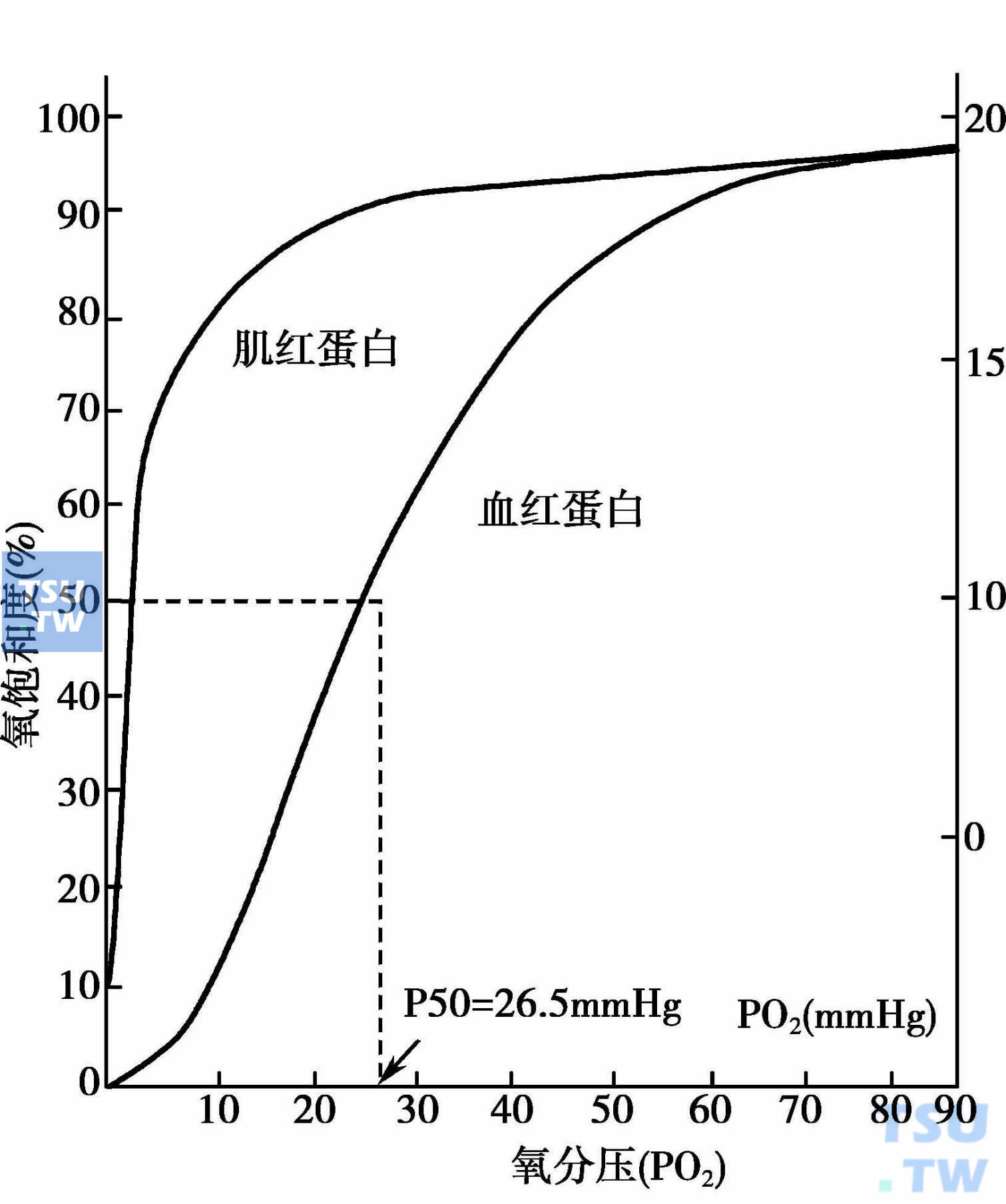
氧合血红蛋白的氧解离曲线
HbO2氧解离曲线的S型特征具有重要的生理意义。曲线的两端斜率较小(较平坦),曲线中段斜率较大(较陡直),这说明Hb与O2结合随PO2的增高而加快;HbO2释出O2则随PO2的下降而加快,其机制可用前面所述的Hb的变构效应来说明。从曲线可见,PO2从100mmHg降至80mmHg时,O2饱和度仅下降0. 02(0. 95~0. 93),故当血液流经PO2高的肺部时(Hb最大限度地与O2结合)即使PO2可能有相当大的变化(如人从平原进入高原地区),血液O2饱和度并不受多大影响,仍能保证较多的Hb与O2结合。但当PO2自40mmHg降至20mmHg时,血O2饱和度可自0. 6降至0. 3,保证了血液流经PO2低的组织时即使PO2有较小变化,HbO2的氧解离曲线有明显增加,从而释出更多的O2供组织需要。
H+浓度和CO2的效应
波尔(Bohr 1910年)早已发现血红蛋白的氧亲和力随着血液中H+浓度增加和CO2分压(PCO2)的增高而减弱,Hb分子由R型转化为T型,促使HbO2解离释出O2;反之也然。当PO2增高时,由于O2和Hb结合使Hb分子由T型转化为R型,促使Hb释放H+和CO2。此现象最早由Bohr发现,故又称为Bohr效应。其过程可用下式表示:

Bohr效应具有重要生理意义。如当血液流经组织时,因细胞的pH较血液低而PCO2较血液高,有利于HbO2释放O2,使细胞获得充足的O2,同时HbO2释放O2又促进了Hb和H+、CO2结合。当血液流经肺部时,PO2高,HbO2的生成促使Hb释出H+和CO2。CO2的呼出又有利于HbO2的形成。H+ 与Hb的结合能影响Hb的分子构象,使Hb对O2的亲和力降低。下图所示,当血液的H+浓度增高(pH由7. 4降至7. 2)时,Hb对O2的亲和力降低,氧解离曲线向右移动,P50值增大;当血液的H+浓度下降(pH由7. 4增至7. 6)时,Hb对O2的亲和力增加,氧解离曲线向左移动,P50值减小。故在同一PO2下,pH越低,Hb对O2的亲和力越小,血氧饱和度也越小。PCO2分压对Hb结合O2的影响基本上与pH相似。PCO2增高所产生的效应和pH下降完全一样,能使Hb对O2的亲和力和O2饱和度下降,氧解离曲线向右移动。研究结果表明,在有氧代谢中,每消耗一个O2分子,约生成0. 8个分子CO2。大多数CO2是作为碳酸氢根运载的,而后者在红细胞中通过碳酸酐酶的作用形成的(CO2+ H2O→HCO3-+H+),在这个反应中产生的H+可参与脱氧Hb的Bohr效应,换句话说CO2形成的碳酸能使红细胞中的pH下降,故CO2对Hb与O2结合的影响主要是通过降低pH而实现的。此外,CO2还被Hb以氨基甲酸(HbNHCOOH)形式运载。Hb的氨基未电离的形式能与CO2进行可逆反应:
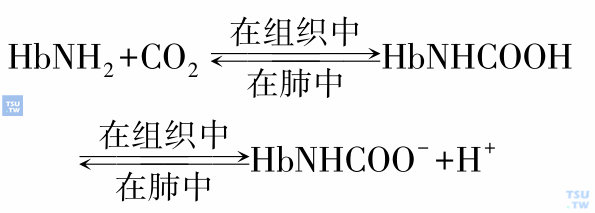
在此反应中释放出的H+,也可参与脱氧Hb的Bohr效应。故有人认为这可能是CO2降低血液pH的主要原因。
需要进一步讨论的问题是从氧合转化为脱氧形式时,血红蛋白是如何吸收质子(H+)的?质子与Hb哪些部位结合?又如何影响Hb结合O2的能力?其中有些问题至今尚未完全弄清楚。但是有研究结果表明,Bohr效应产生的原因主要是由于H+的正电荷与脱氧Hb的负电荷基团相互作用而配偶形成盐桥,从而增加脱氧形式Hb的稳定,降低Hb对 O2的亲和力。Hb分子α链的末端氨基和α122,β146位组氨酸的咪唑环能和H+结合,其中β146位组氨酸残基的咪唑基离子化对Bohr效应产生起着重要作用,大约40%的Bohr效应由其产生,20%由α 链N-末端缬氨酸残基的氨基(—NH2)与H+结合的结果,其余40%可能是由于α122位组氨酸残基或肽链上其他组氨酸残基的共同作用结果。X线衍射分析得出的结果表明在氧合Hb中,β146位组氨酸残基可以自由转动,而在脱氧Hb中,这个末端残基的咪唑环与同一β链上的第94位天冬氨酸负电荷之间相互作用,促使咪唑基与H+结合。α链的末端氨基在Hb脱氧作用后也有相似的变化。在HbO2分子中,这些基团是自由的,在脱氧Hb中,一条α链的末端氨基与另一条α链的羧基发生相互作用,增加了这个末端氨基对H+的亲和性。此外,α122位的组氨酸残基也参与这个效应。综上所述,三对结合质子的基团(一个末端氨基和两个组氨酸)在氧合和脱氧Hb分子具有不同的环境,在脱氧Hb中它们直接接触的环境荷负电更多,因此,一旦氧脱下来,这些基团就吸收H+了。
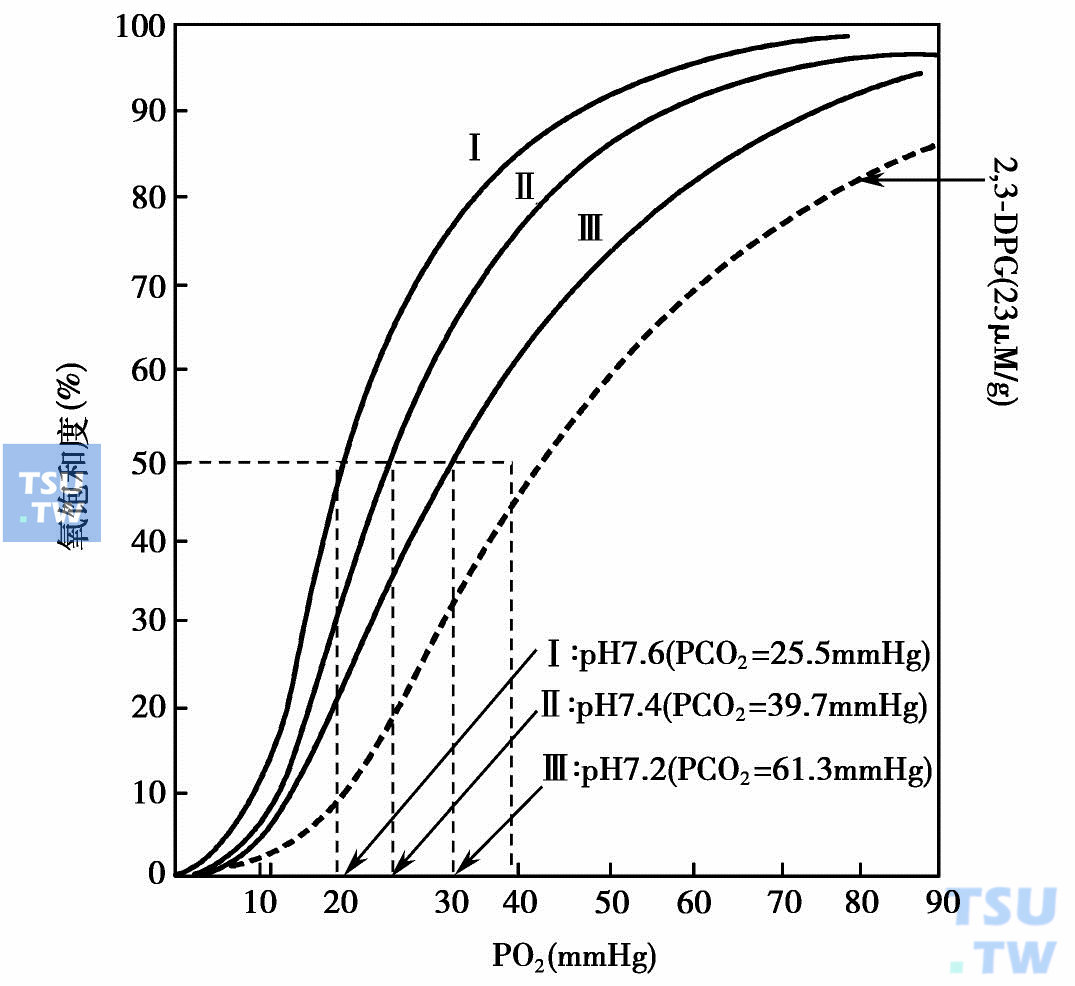
pH和PCO2对血红蛋白氧解离曲线的影响
2,3-二磷酸甘油酯的效应
2,3-二磷酸甘油酯(2,3-DPG,以DPG表示)是红细胞中糖无氧酵解途径支路的中间产物,其分子特点是分子量小(263D),但荷有高密度的负电。红细胞中DPG浓度是调节Hb对O2亲和力的重要因素。DPG能和Hb分子结合,其原则是一个DPG分子专一地与一个分子Hb结合。前面已提到,脱氧的低亲和力的HbA中央间隙比氧合HbA的间隙大,DPG结合部位就在这个中央间隙内(下图),荷负电强的DPG和每条β链上三个荷正电基团(β2组氨酸残基的α-氨基,β82赖氨酸残基的侧链和β143位组氨酸残基的咪唑基)结合(下图2)。因在这个间隙中配体DPG的存在而倾向于固定Hb分子在低亲和力“T”构象,从而降低了Hb对O2的亲和力,使氧解离曲线向右移动,P50值增加。DPG浓度越高,它从这个位置被替换越困难,因而HbA与氧亲和力越低。相反,在DPG浓度降低时,可使Hb与氧亲和力增高,氧解离曲线向左移动,P50值减小。但结合了氧的HbO2就不能和DPG结合了,因为氧合Hb分子的中央间隙比脱氧的Hb间隙小,容纳不下DPG。胎儿红细胞中的血红蛋白主要是HbF(α2γ2),现已查明HbF对O2的亲和力比Hb A高的原因主要是γ链的143位是丝氨酸(β143位是组氨酸),使HbF结合DPG的能力减弱,不能与DPG形成盐键,因而对O2的亲和力增高。

DPG结合于Hb分子的中央空穴中
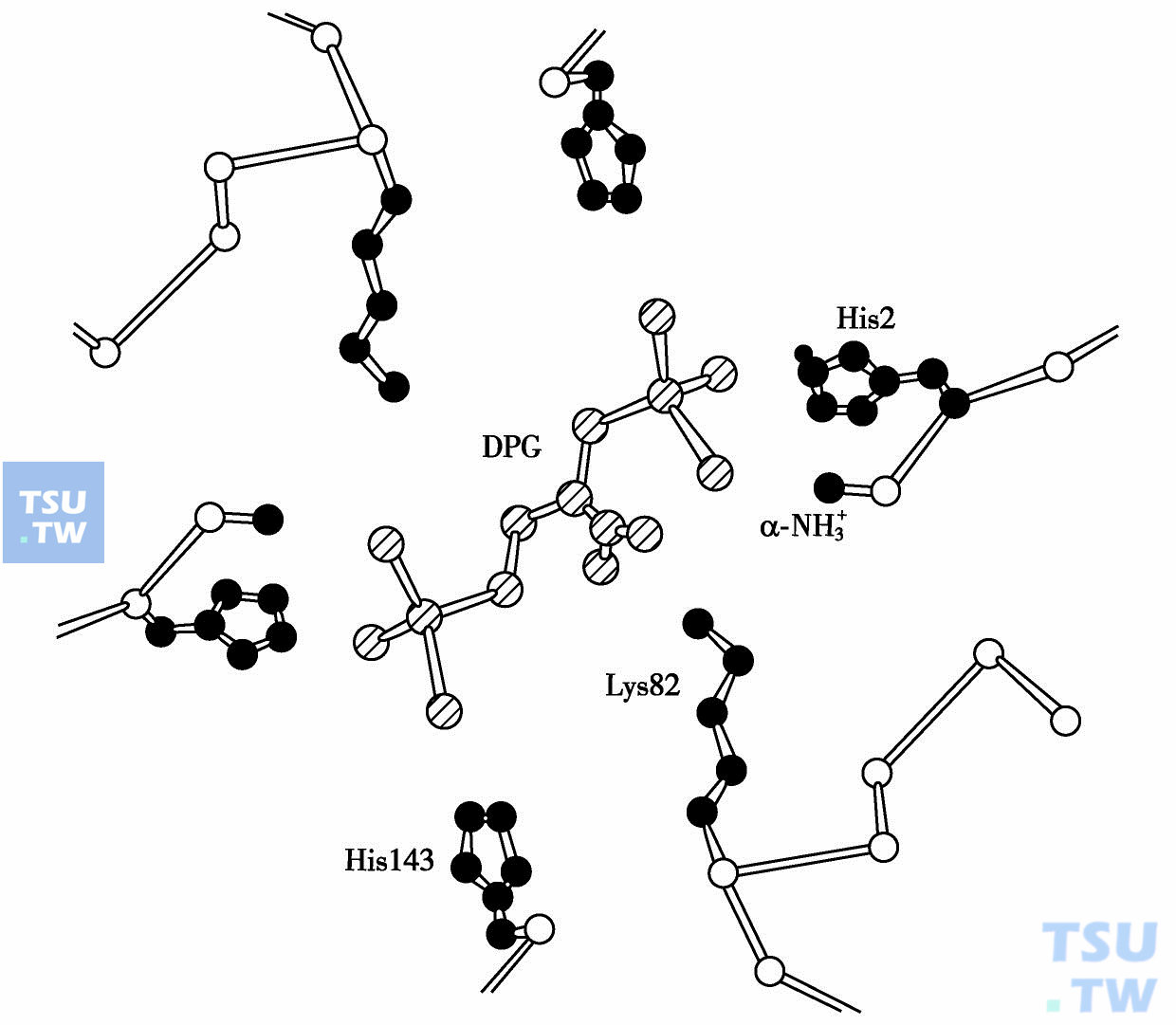
DPG与人脱氧Hb结合方式(DPG与每条键上三个正电基团结合)
DPG与Hb结合降低Hb对O2亲和力这一现象具有重要的生理意义。因为人体可通过红细胞中DPG浓度的改变来调节组织的获O2量,这对人体在某些缺O2情况下的代偿有重要意义。
严重阻塞性肺气肿患者有肺部换气困难,动脉血PO2可降至50mmHg,动脉血O2饱和度降低,此时血细胞内的DPG浓度可代偿性增加(从正常的4. 5mmol/L增到8mmol/L),使氧解离曲线向右移动,释放较多的O2供组织需要。
高山适应呼吸生理研究表明,红细胞内DPG浓度变化是调节其适应的主要因素。当正常人(如登山运动员、高原考察人员等)在短时间内由平原进入海拔数千米的高原和高空时,红细胞中DPG浓度增加,在数天中可达最高值,然后下降但仍维持较高水平,使Hb对O2亲和力下降,释放较多的O2供组织细胞新陈代谢之用。当他们回到平原地区时又随之恢复。
CO2的运输问题
成年人在安静时,每分钟约产生200ml CO2。这些CO2必须通过血液的运输并由肺部排出体外。血液中CO2主要有三种形式运输:①物理溶解于血液中的CO2量很少(2. 4ml/ 100ml动脉血,2. 7ml/100ml静脉血),约占总量的7. 3%;②结合成HCO3-形式存在于血浆和红细胞中,约占总量的68. 3%;③与Hb结合成氨基甲酸血红蛋白(HbNHCOOH)的约占总量的24. 4%。它说明Hb在CO2的运输中起着重要作用。在红细胞中以HbNHCOOH形式运输的CO2在肺部分解为HbNH2和CO2,后者由肺呼出。但HbNHCOOH的形成与分解受CO2分压(PCO2)的影响,其形成量取决于PCO2。研究结果表明,CO2与β珠蛋白链末端的氨基结合,其亲和力为α珠蛋白链末端的三倍。在相同PCO2下,脱氧Hb比氧合Hb更多与CO2结合,因此在肺中血氧饱和度增加可促进HbNHCOOH分解,有利于以此形式运输的CO2从肺呼出。Hb运输O2和CO2是相互协调、相互促进和相互制约的,显示其“双向呼吸载体”的作用。
胎儿期Hb(HbF)和成人期Hb(HbA,HbA2)
已经得到了大量的研究,对其在生理学上的重要意义及特征,积累了丰富的知识。但是胚胎期三种Hb却与之不同,其中两种称为半胚胎Hb:HbGower-Ⅱ(α2ε2)和HbPortland(ζ2β2),组成它们完整的分子中有一半是成年α-珠蛋白亚基或β-珠蛋白亚基,HbGower-Ⅰ(ζ2ε2)全部由胚胎期珠蛋白亚基组成,所以称为全胚胎Hb。现有研究表明,胚胎发育早期表达这三种Hb的原始红细胞数量少,从早期原始红细胞中分离纯化这三种Hb非常困难,无法获得足够量的高纯度的胚胎Hb制品进行其功能与特性的研究,除知道它们与O2结合力强外,其他特性尚未清楚。最近何振宁等人成功地构建和培育出高效表达人α、β、ζ和ε珠蛋白的转基因鼠,这种转基因鼠是建立在基因“敲除”(knockout)鼠内源性α-珠蛋白基因(基因型mα+/-)或β-珠蛋白基因(基因型mβ+/ -)杂合子基础上。在这种复合基因“敲除”转基因鼠特定红细胞内高水平表达人胚胎型和半胚胎型Hb,表达量介于总细胞蛋白的24%~70%。用离子交换层析等方法从转基因鼠特定红细胞中分离纯化Hb-Gower-Ⅰ、HbGower-Ⅱ和HbPortland,并且对它们的主要生理特性包括P50,Hill系数,Bohr效应与2,3-DPG结合力以及稳定性等进行测定,结果见表:
人血红蛋白的特性
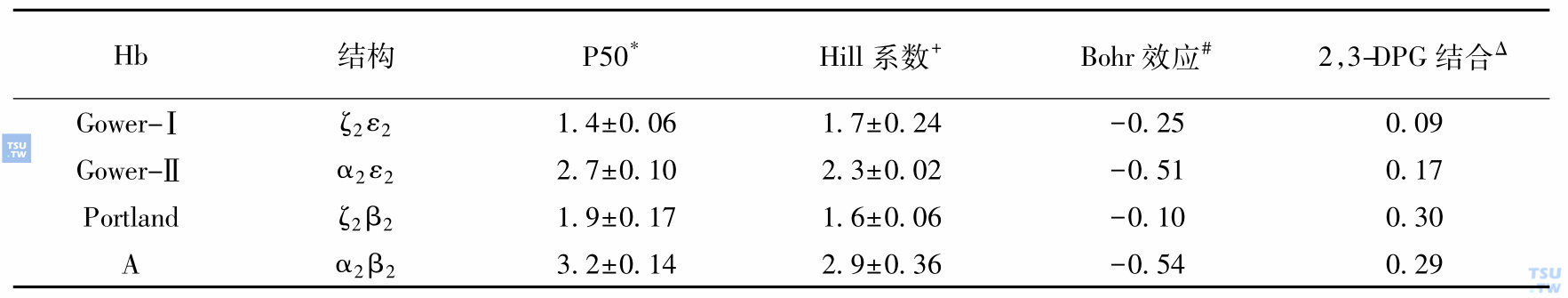
注:*Torr,+log(Y/1-Y)logPO2;#ΔlogP50/ΔpH(在碱性区);Δ结合常数(mmol/L)
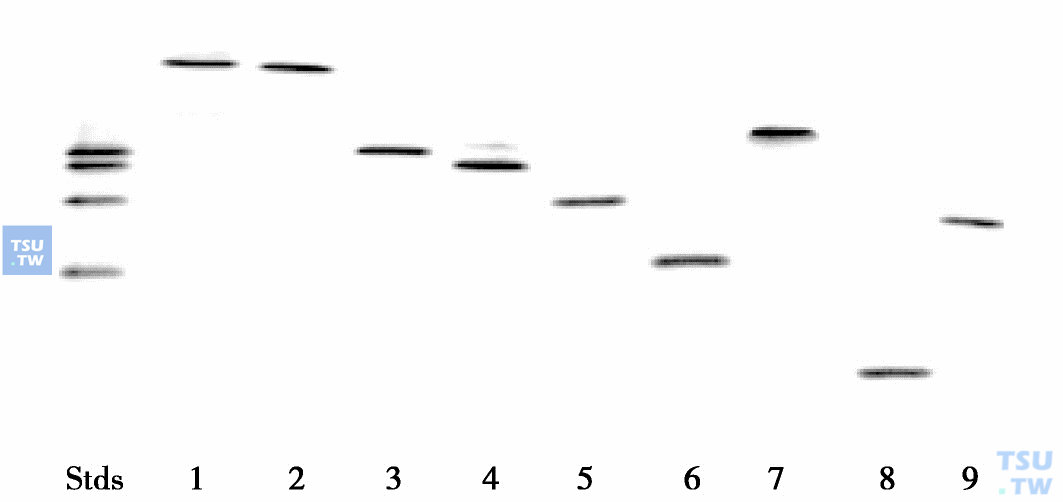
人类血红蛋白凝胶等电点聚焦电泳(摘自Manning LR et al.2007)
Stds:标准人血红蛋白A,F,S和C(从上→下),正极(上),负极(下)1. Hb Portland-1;2. Hb Portland-2;3. HbA;4. HbF;5. HbS;6. HbA2;7. Hb Gower-Ⅰ;8. Hb Gower-Ⅱ;9. Hb Rothschild
从上表可见,两种含有ζ-珠蛋白亚基的Hb显示较强的氧亲和力(P50值低)和较弱Bohr效应,而HbGower-Ⅱ的氧亲和力(P50为2. 7±0. 10)和Bohr效应与HbA基本相同。在稳定性方面,这三种Hb和HbA有较多不同,具体表现在:①机械振荡耐受性,HbA>HbGower-Ⅱ>HbGower-Ⅰ>HbPortland,即这三种Hb机械振荡稳定性均差于HbA,其中Hb-Portland最差;②对12%异丙醇稳定性:HbA>Hb-Gower-Ⅱ>HbPortland>HbGower-Ⅰ;③热稳定性,Hb-Portland>HbGower-Ⅰ>HbGower-Ⅱ>HbA。近年来,学者们较为系统地研究了正常人Hb(包括胎儿Hb和胚胎Hb)中各珠蛋白亚基界面的性质。前面已述,在个体发育过程中,人各珠蛋白亚基是以单体形式表达的,然后以多种方式组合形成杂二聚体,进而组装成具有结合氧功能的人类Hb(X2Y2),如公式所示:2X+ 
 2Y 2XY X2Y2,这里的X代表α-或ξ-珠蛋白亚基,Y代表β-、γ-、δ-或ε-珠蛋白亚基。虽然X和Y亚基极易结合形成二聚体,但由于自身竞争组装反应所致,β或γ亚基也能分别形成β亚基和γ亚基的同源四聚体β4(HbH)和γ4(Hb Bart)。HbH和Hb Bart都是非协同Hb,可作为某些α-地中海贫血病例的临床诊断指标之一。HbH与其他正常人Hb不一样,在β4中,亚基界面结合力弱,β4容易解离为4β,所以很容易获得单体的β珠蛋白亚基,质谱和氨基酸序列分析结果显示β4中β亚基与正常人β珠蛋白亚基完全一致。在人类红细胞中可能存在8种不同Hb组分。表中所示的三种胚胎型Hb,已经进行些研究,积累了有意义的资料。但是另一种胚胎型Hb-HbPortland-2 (ξ2β2)在红细胞中很少出现,只存在重型α-地中海贫血患者(缺α亚基生成)中才可发现。
2Y 2XY X2Y2,这里的X代表α-或ξ-珠蛋白亚基,Y代表β-、γ-、δ-或ε-珠蛋白亚基。虽然X和Y亚基极易结合形成二聚体,但由于自身竞争组装反应所致,β或γ亚基也能分别形成β亚基和γ亚基的同源四聚体β4(HbH)和γ4(Hb Bart)。HbH和Hb Bart都是非协同Hb,可作为某些α-地中海贫血病例的临床诊断指标之一。HbH与其他正常人Hb不一样,在β4中,亚基界面结合力弱,β4容易解离为4β,所以很容易获得单体的β珠蛋白亚基,质谱和氨基酸序列分析结果显示β4中β亚基与正常人β珠蛋白亚基完全一致。在人类红细胞中可能存在8种不同Hb组分。表中所示的三种胚胎型Hb,已经进行些研究,积累了有意义的资料。但是另一种胚胎型Hb-HbPortland-2 (ξ2β2)在红细胞中很少出现,只存在重型α-地中海贫血患者(缺α亚基生成)中才可发现。
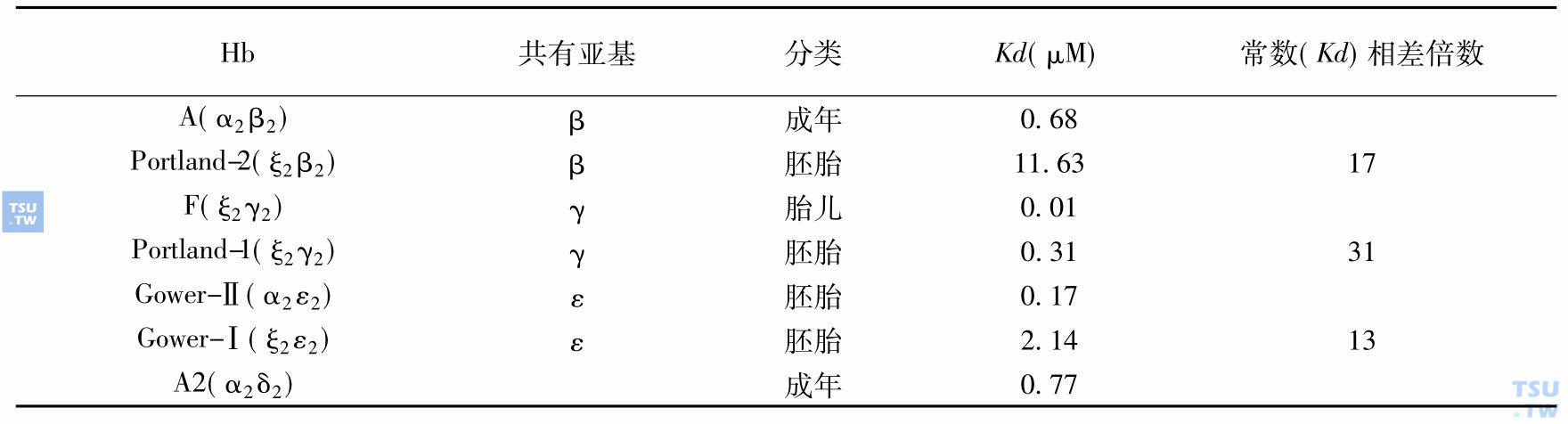
有关Hb-Portland-2除上表中所知的信息外,尚缺少更多这种Hb性质的资料。8种不同人Hb组分的等电点聚焦电泳结果(上图)显示,HbPortland-1和 HbPortland-2等电点(pI)相近,具有低pI,而HbGower-Ⅱ具有高pI。Manning等人用高分辨力凝胶过滤法测定在溶液pH 7. 5时四聚体→二聚体的解离常数(Kd),结果见下表。含有ε-亚基的Hb-Gower-Ⅰ和HbGower-Ⅱ,由四聚体→二聚体的Kd值分别为2. 14μmol/L和0. 17μmol/L,这样,前者的Kd值高于后者的Kd值13倍。HbPortland-1和HbF都含有γ-亚基,它们由四聚体→二聚体时的Kd值分别为0. 31μmol/L和0. 01μmol/L,两者相差近31倍。HbPortland-2与大多数人Hb(包括HbA)不同,它由四聚体→二聚体,然后将继续解离为单体,此时其Kd值为1. 4μmol/L(pH 7. 5)。研究发现低pH值能增加Hb四聚体的解离效应,降低1个单位pH值,HbA由四聚体→二聚体的Kd值增加10倍,在pH6. 3时,HbPortland-2(0. 2μmol/L)完全解离为单体,而HbA基本上保持在二聚体状态,浓度为60μmol/L时,HbA和HbPortland-2均形成四聚体和二聚体混合状态,说明ξβ是相当弱的二聚体,两亚基之间界面效应弱于HbA中αβ界面效应。圆二色谱(CD)和质谱分析结果证明HbPortland-2未见有异常构象,具有正确的氨基酸序列结构,UV可见光谱也是正常的,与其他Hb相比,它的最大特点是由四聚体→二聚体和由二聚体→单体的亚基界面效应很弱,这种异常效应可能是造成其在人体发育过程中很为罕见出现的主要原因。分析α2β2和ξ2γ2中α-和ξ-亚基的结构发现两者的骨架结构是非常相似的,各种氨基酸侧链置换确实能影响每种结构静电学差异。两者静电表面电势存在三个差别:
- 螺旋段G和H结合区,ξ-亚基的负电性强于α-亚基;
- 螺旋段F和G结合区,α-亚基的正电性强于ξ-亚基;
- ξ-亚基C-末端氨基酸的方向使其比α-亚基更强的正电性。
这些差别将增加含有ξ-亚基的亚基界面解离作用,也就是说ξ2γ2或ξ2ε2或ξ2β2要比α2β2或α2γ2或α2ε2更容易解离,其中HbPortland-2(ξ2β2)最易解离,其次是HbGower-Ⅰ。在二聚体ξγ中单体间界面存在二条氢键,一条位于残基Arg-30(γ)-Phe-117(ξ)之间,另一条位于Ile-116(γ)-Pro-114(ξ)之间,在残基Lys-120(γ)-Arg-112(ξ)之间存在一条不稳定相互作用键,而在α-亚基中第112位则是His,而不是Arg。在αβ二聚体结构中,单体间不存在不稳定相互作用键,但是含有四条氢键,它们是Phe-112(β)-Arg-31(α)、Gln-131(β)-His-103(α)、His-116-(β)-Pro-114(α)和Arg-30 (β)-Phe-117(β)。由此人们可做出如下结论:αβ结构中单体间的稳定性大于ξγ结构中单体间的稳定性。根据各珠蛋白亚基间界面效应的研究结果显示单体亚基间接触效应力由弱变强的次序是:Hb-Portland-2(ξ2β2)<HbPortland-1(ξ2γ2=≌HbGower-Ⅰ(ξ2ε2)<HbGower-Ⅱ(ξ2ε2)<HbF1<Hb F(α2γ2)<HbA2(α2δ2),即它们基本上代表了由胚胎→胎儿→成年期各珠蛋白亚基表达成熟次序,这样,可认为各珠蛋白亚基自身与竞争亚基形成界面效应力的内在结合特性在蛋白质组装网络的动态学中起着重要作用。现在,虽然我们还不能确定HbGower-Ⅱ和Hb-Portland在人体发育中是否起重要作用,但是全面了解它们的特性将是很有价值的。
人类血红蛋白由四聚体→二聚体的解离效应
(陈松森)
