酶代谢途径及致病机制
红细胞酶病相关代谢途径
- 无氧糖酵解:丙酮酸激酶(PK)、己糖激酶(HK)、葡萄糖磷酸异构酶(GPI)、磷酸果糖激酶(PFK)、醛缩酶(ALD)、磷酸丙糖异构酶(TPI)、磷酸甘油酸激酶(PGK)、2,3-二磷酸甘油酸变位酶(DPGM)。
- 磷酸戊糖旁路:葡萄糖-6-磷酸脱氢酶(G-6-PD),6-磷酸葡萄糖酸脱氢酶(6PGD)。
- 谷胱甘肽代谢:谷胱甘肽还原酶(GR)、谷胱甘肽过氧化物酶(GPx)、谷胱甘肽合成酶(GSS)、r-谷氨酰半胱氨酸合成酶(GCS)。
- 核苷酸代谢:嘧啶5'-核苷酸酶(P5'N)、腺苷酸激酶(AK)、腺苷脱氨酶(ADA)。
- 其他:乙酰胆碱酯酶(ACE)、Na+-K+-ATP酶(Na+-K+-ATPase)、细胞色素b5还原酶(Cb5R)、尿卟啉原Ⅲ同合酶(UⅢC)。
在上述酶中,全球发病率居第一、第二位的分别是G-6-PD和PK,第三位为P5'N。GPI曾与P5'N并列第三,但近十余年P5'N病例报告明显增多。我国已有G-6-PD、PK、P5'N、GPI、PFK、ALD、GR和Cb5R缺陷的溶贫病例报告。各酶参与的催化途径见图31-1。
遗传性红细胞酶病溶血机制
成熟红细胞无细胞核和细胞器,不能合成新的蛋白质,而要维持红细胞120天寿命,需依赖于上述红细胞各代谢途径,尤其是其中4种重要中间代谢产物,即三磷腺苷(ATP)、还原型辅酶Ⅱ(NADPH)、还原型辅酶Ⅰ(NADH)和2,3-二磷酸甘油酸(2,3-DPG),这些产物为红细胞生命活动所必需,以保证红细胞能量供应、离子泵功能、携氧功能、还原状态维持及膜变形运动等功能。重要中间代谢产物生成不足或失衡是导致遗传性红细胞酶病的常见原因。由于红细胞内各种酶参与代谢的途径不同、作用底物不同,酶病变引起溶血的机制也不尽相同,主要有以下三类溶血机制,可以单独出现,也可并存。
一、细胞能量代谢障碍
糖酵解酶类异常均可影响红细胞内ATP合成;核苷酸代谢酶类病变可直接或间接干扰ATP能量池的平衡;磷酸戊糖通路障碍影响ATP前体核糖生成;糖酵解酶异常(PK缺陷除外)还可影响储备能源2,3-DPG的相应功能。这些酶病变均可使细胞能量合成不足或耗竭,影响细
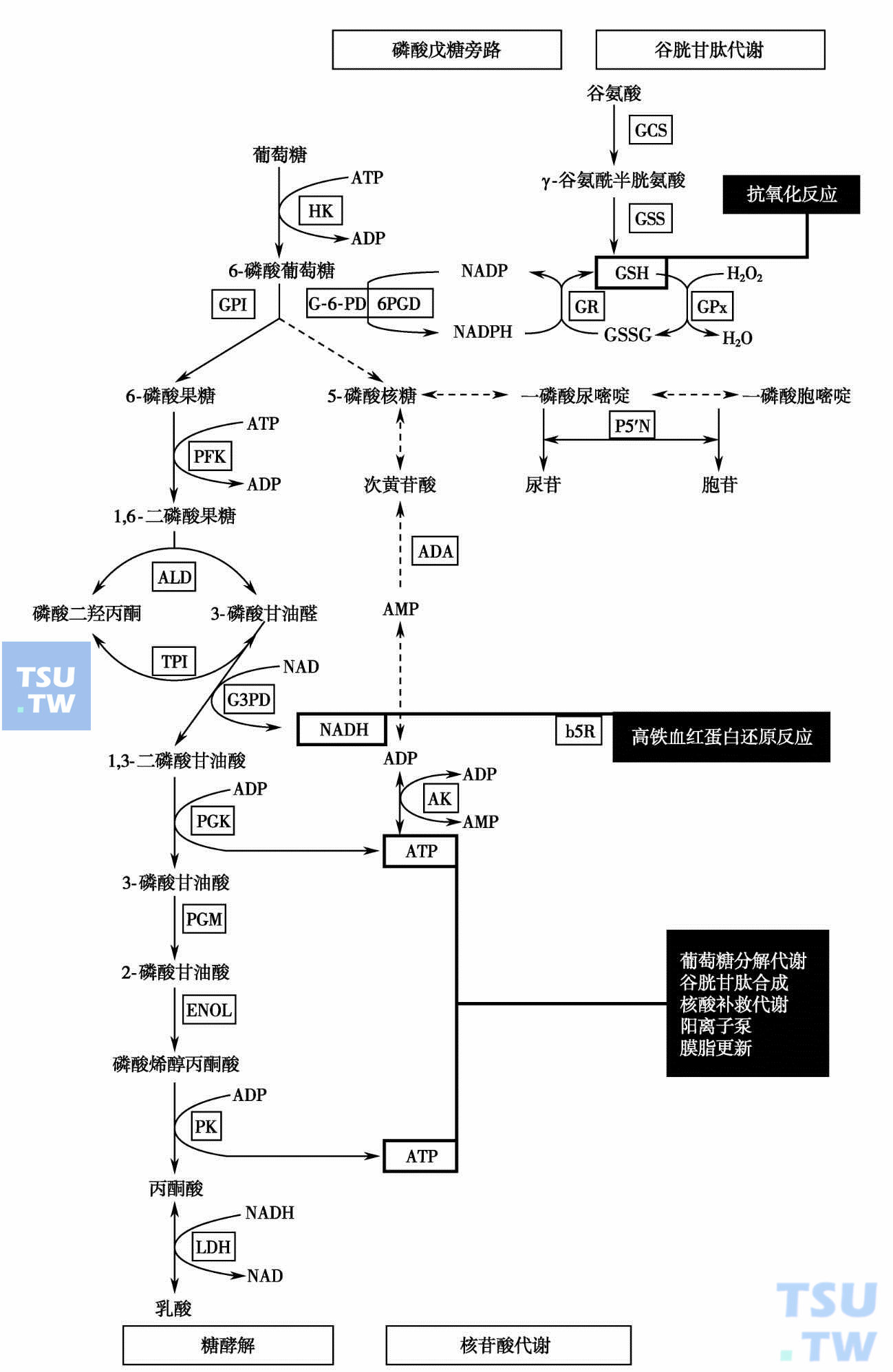
红细胞酶病相关代谢酶的催化途径及其重要产物的主要功能(各酶的中文全称见正文)
二、细胞氧化还原状态失衡
胞内ATP参与的代谢反应如阳离子转运,并损伤红细胞膜的结构与功能,受损红细胞易被单核-巨噬细胞系统吞噬破坏而溶血。 戊糖旁路酶、谷胱甘肽代谢酶、高铁血红蛋白还原酶等酶变异时,不能维持高比例还原物质的含量(NADPH/NADP+、GSH/GSSH、NADH/NAD+),ATP耗竭进一步使还原物质的合成障碍,结果红细胞受氧化损伤而溶血破坏。
三、细胞代谢产物蓄积中毒
核苷酸代谢酶类异常时除干扰ATP合成以外,还因为核苷酸池平衡被破坏、核苷酸代谢产物蓄积,致使细胞中毒、损伤红细胞功能,使红细胞易被吞噬破坏、寿命缩短,产生溶血症状。
绝大多数酶的基因突变发生在酶蛋白的结构基因,导致酶蛋白结构与功能改变,表现为酶活力降低或酶蛋白稳定性下降。突变发生在调控基因的酶目前仅见于腺苷脱氨酶(ADA),其调控基因突变使结构正常的酶蛋白合成失控,结果酶活力过高而破坏核苷酸池平衡而导致红细胞溶破。
遗传性红细胞酶病临床表现
先天性非球形红细胞溶血性贫血
先天性非球形红细胞溶血性贫血(congenital nonspherocytic hemolytic anemia,CNSHA)也称作遗传性非球形红细胞溶血性贫血(hereditary nonspherocytic hemolytic anemia,HNSHA),是绝大多数红细胞酶病的共有表现。患者有黄疸、脾大和慢性血管外溶血症状,间或急性发作。在形态学上,CNSHA红细胞通常没有明显的形态改变。在血常规指标和溶血常规试验中也没有特征性的变化。
患者多有新生儿溶血史,也可在其他年龄段发病。感冒、感染、服氧化性的药物或食物以及妊娠等情况均可加重溶血,溶血严重者可出现溶血危象,感染也可诱发再障危象。酶病患者的黄疸、脾大和贫血的程度在不同患者、不同缺陷酶差异很大,可能由于酶的不同变异型特性所决定。
遗传性红细胞酶病大多数为常染色体隐性遗传,杂合子可无临床症状,先证者多为双亲血缘婚配的纯合子或是遗传来自双亲各自异常等位基因的双重杂合子。ADA、GR等少数酶呈常染色体显性遗传,有明确家族史。G-6-PD、PGK为性染色体连锁遗传,男性酶缺乏者为半合子,溶血性贫血症状明显。
多系统症状
有核细胞可以维持合成代谢酶,因此,某一酶病变时,其他组织和血液有核细胞仍能维持正常功能,红细胞则出现病变,发生溶血。如果其他部位、其他系统的同工酶发生与红细胞酶相同的病变,可出现全身症状,即多系统症状;PFK、TPI、HK、GPI、PGK、DPGM、P5'N、GR、GSH-Px、GS、γ-GCS等酶缺陷者可出现溶血伴智力低下、惊厥等神经系统症状和肌肉痉挛、肌痛等肌肉系统症状。肾脏、心脏、眼等部位的伴发病症也有个案报告。
新近研究提示,红细胞酶还具有一些非催化酶的功能,包括调节转录、刺激细胞运动、调控凋亡、调控原癌基因和肿瘤转移等,如GPI可作为自分泌运动因子(autocrine motility factor,AMF)参与细胞迁移,在黑色素瘤则是参与癌细胞转移。其他多种糖酵解酶有调节凋亡的作用。线粒体HK通过与前凋亡蛋白BAD反应而抑制凋亡,而磷酸甘油醛脱氢酶(GAPD)显示具有前凋亡功能。GAPD、HK、烯醇酶(ENOL)和乳酸脱氢酶(LDH)等糖酵解酶可通过多种机制影响基因排列从而调节转录。这些研究结果提示,红细胞酶的非酶功能可能与遗传性红细胞酶病多系统症状有关。
遗传性红细胞酶病的诊断
红细胞酶病多在临床症状、溶血指征和溶血常规试验上与其他溶血性疾病有诸多共性,而通常缺乏独特性表现,诊断步骤以排查为主,直接测定酶活力是红细胞酶病的确诊依据,家系调查数据是确诊的重要佐证。
不明原因的CNSHA
病史:有新生儿黄疸史;有不明原因的CNSHA;有不明原因的药物性溶血史;感冒、感染、妊娠等因素会加重贫血与黄疸。
并发症和症状提示:常见生长发育迟缓、胆结石,溶血急性发作时可有腹痛等症状。溶血同时伴有智力低下、运动障碍等神经、肌肉系统症状,提示为引发多系统病症的酶病变;同时出现脊髓小脑变性及氨基酸尿,则提示有谷胱甘肽代谢酶类的改变;接触氧化性药物、试剂或进食蚕豆等而诱发急性溶血者应考虑戊糖旁路代谢酶或谷胱甘肽代谢酶等氧化还原通路代谢酶缺陷。家系中男性溶血症状明显严重的应考虑X性染色体连锁遗传缺陷的酶病。特别应询问家庭籍贯,首先排查高发于我国华南、华西地区的G-6-PD缺乏症。
排除溶血性疾病的其他病因
排除红细胞膜病、血红蛋白病以及各种后天获得性和继发性溶血因素后,仍然病因未明者,提示红细胞酶病疑诊。
酶活力专项测定
早年将不明原因的CNSHA分为两型,CNSHAⅠ型的红细胞可以在体外实验中用葡萄糖纠正可减轻溶血,CNSHAⅡ型则不能被葡萄糖纠正。现已明确,Ⅰ型CNSHA是磷酸戊糖通路代谢酶缺陷,Ⅱ型是糖酵解为主的其他酶的病变所致。以葡萄糖纠正试验进行分类的方法不能确定具体是哪一种酶的病变导致溶血,只能大致区别病变酶参与的代谢通路。
国际血液学标准委员会(International Committee for Standardization in Haematology,ICSH)首推根据酶的专一底物设计的酶活力测定方法,直接定量测定酶活力是特异性强、最直接可靠的酶病诊断依据。酶缺陷杂合子的酶活力常为正常值的50%~75%,显性遗传酶病杂合子溶血症状较轻,隐性遗传酶病杂合子一般无临床症状。酶缺陷纯合子的酶活力常在正常值的20%~50%,低于20%的多见于重症患者。红细胞酶活力正常参考值见表:
红细胞酶活力正常参考值
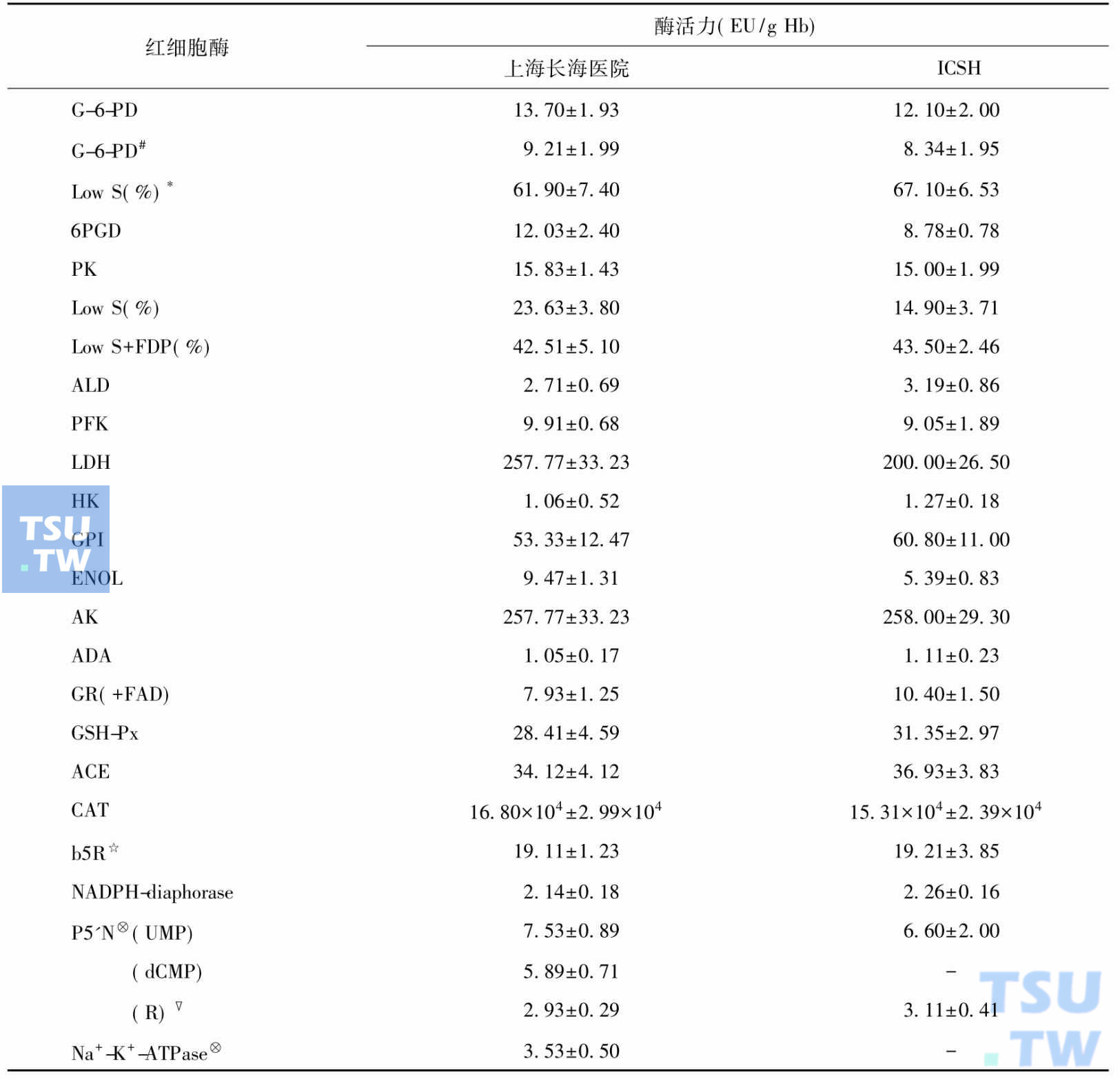
#6PGD校正后的G-6-PD活力、*低底物利用率、☆30℃测值,其余各酶为37℃测值、⊗酶活力单位:每小时μmol/g Hb
2P5'N初筛试验
P5'N和Na+-K+-ATPase为终点法测定,其他酶为速率法测定
ICSH推荐的其他的红细胞酶病检测指标:荧光发光法定性试验、紫外分光光度法筛查试验、低底物利用率(L%)、同类底物利用率、米氏常数(Km)和最大反应速度(Vmax)、抑制剂或激活剂敏感性、热稳定性(TST)、pH曲线与最适pH(Opt pH)、电泳迁移率等。
遗传性红细胞酶病的治疗原则
目前缺乏红细胞酶病的有效对因治疗方法,主要处理措施为去除诱因、对症治疗和输血。贫血严重者应辅以补充叶酸,避免溶血危象。及时治疗与预防严重并发症如心衰、肾衰竭、酸中毒、严重感染等,新生儿溶血期注意防治核黄疸。
切脾与否应慎重考虑。脾切除对红细胞酶病效果不一,总体疗效不如对红细胞膜病。下列情况时可考虑脾切除术:巨脾、依赖输血者。
造血干细胞移植用于PK缺乏症、C5bR缺乏症已有成功病例,预示基因疗法可能是根治遗传性红细胞酶病的有效疗法。
