本病是指因骨髓中红系显著减少或缺如所致的一种贫血。发病原因是由于胸腺瘤、病毒、感染、淋巴系统增殖性疾病及药物等所诱发;有些病例原因不明,多与免疫有关。贫血是唯一的症状和体征。治疗包括红细胞输注支持、免疫抑制治疗和原发病治疗等。
定义和发病情况
纯红细胞再生障碍性贫血(纯红再障,PRCA)是一以正细胞正色素贫血、网织红细胞减低和骨髓幼红细胞显著减少或缺如为特征的综合征。1922 年Kaznelson首先对此病进行描述,此后陆续以各种不同名称见诸文献并逐渐受到关注,包括纯正再生障碍性贫血(pure aplastic anemia)、慢性低增生性贫血(chronic hypoplastic anemia)、再生障碍危象(aplastic crisis)、幼红细胞减少症(erythroblastopenia)、红细胞生成缺陷症(erythrogenesis imperfecta)、Blackfan-Diamond综合征、纯红细胞发育不全(pure red cell agenesis)及原发性红细胞贫血(primary red cell anemia)等。现今纯红再障用于本病成人患者,而Diamond-Blackfan贫血(DBA)和儿童一过性幼红细胞减少症(transient erythroblastopenia of childhood,TEC)主要用于先天性和获得性婴儿和儿童本病患者。
Diamond-Blackfan贫血即先天性纯红细胞再生障碍性贫血,由核糖体蛋白结构基因突变导致核糖体生物合成异常,为红细胞内源性生成缺陷所致,呈常染色体显性或隐性遗传,绝大多数发生于1岁以内,表现为大细胞贫血、骨髓红系细胞明显减少、发育畸形和肿瘤易感性增高等,该病将在本书其他章节详细介绍。本章介绍获得性纯红再障。
纯红再障临床相对少见,但确切发病率不祥。本病可见于各不同种族和不同年龄人群,男女发病大体相同。
病因和分类
纯红再障为一获得性贫血,可无明显病因或诱因可查,为原发性纯红再障;或继发于各种不同疾病,如实体肿瘤、大颗粒淋巴细胞白血病(LGLL)和其他淋巴增殖性疾病、胸腺瘤、药物应用、自身免疫性疾病、异基因造血干细胞移植和微小病毒B19感染等(表41-1)。根据病因不同,纯红再障临床可呈急性自限性或慢性持续性。原发性纯红再障可见于各不同年龄患者,儿童患者TEC多呈急性,能自发恢复;成人患者以慢性持续性贫血最为多见,极少自发缓解,仅少数呈急性自限性疾病过程。
纯红再障病因和分类


发病机制
纯红再障骨髓红系祖细胞数量正常或接近正常,但红系前体细胞明显减少或缺如。红系祖细胞不能正常成熟分化产生成熟红细胞的机制包括:红系细胞内源性缺陷(如DBA)、体液或细胞免疫因素抑制红系细胞、外源因素损伤幼红细胞,以及促红细胞生成素减少或功能异常。
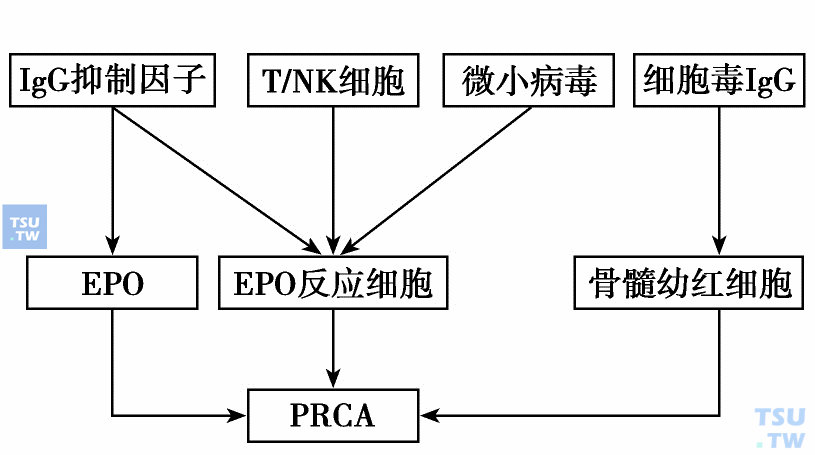
纯红再障红系造血抑制机制
获得性纯红再障大多由免疫发病机制所致。进行体外红系细胞造血分析,加入纯红再障患者血浆,骨髓幼红细胞对EPO反应差,红细胞血红素合成明显低下;而加入正常人血浆,纯红再障患者骨髓幼红细胞对EPO呈正常反应,提示患者血浆中存在抑制红系细胞造血的物质。这种物质被证明是IgG组分,可作用于红系细胞从BFU-E至晚幼红细胞的各个阶段,协同补体以细胞毒方式或以非补体依赖方式直接抑制红系细胞造血,或抑制EPO。当纯红再障经治疗缓解后,该组分也随之消失。
不少原发性纯红再障患者难以确定这种机制,分类为特发性纯红再障。这些所谓特发性纯红再障经免疫抑制治疗多可获得良好疗效,表明其发病也多为免疫机制所致。
少数骨髓增生异常综合征也可以获得性纯红再障作为其初始表现,而骨髓增生异常综合征相关的其他血液学表现不甚明显;通常这些患者按照原发性纯红再障进行免疫抑制治疗无效,可进展为急性白血病,分类为白血病前期或骨髓增生异常综合征。
大约4%左右的胸腺瘤可继发纯红再障,而纯红再障患者中约9%为胸腺瘤继发纯红再障。纯红再障可与胸腺瘤同时发生,也可先表现纯红再障尔后出现胸腺瘤,或可先有胸腺瘤后出现纯红再障,甚至胸腺瘤切除后才发生纯红再障。胸腺瘤在纯红再障发病中的作用尚未完全清楚,有证据表明在胸腺瘤继发纯红再障患者体内检测到寡克隆T淋巴细胞增殖,多数患者免疫抑制治疗有效。因而,认为胸腺瘤相关纯红再障是通过自身免疫机制导致的,纯红再障的发生可能与其不能抑制活动性自身反应性T淋巴细胞克隆有关。
T/NK细胞也可介导纯红再障的发生。大颗粒淋巴细胞增多可为T细胞大颗粒淋巴细胞白血病或慢性NK细胞增多症,是最常继发纯红再障基础疾病。大颗粒淋巴细胞通过以下机制溶解幼红细胞:
- T细胞受体(TCR)识别红系祖细胞表达的未知配基;
- 抗红系祖细胞抗体与颗粒淋巴细胞CD16结合;
- 幼红细胞HLA-Ⅰ类抗原表达逐渐减少,不能与大颗粒淋巴细胞杀伤抑制受体结合阻止其溶细胞作用,为“抑制缺失”。
纯红再障可继发于各种不同的自身免疫性疾病,现认为主要与体液免疫机制相关。在自身免疫性溶血性贫血,自身抗体也可直接抑制红系祖细胞或红系前体细胞导致纯红再障。自身免疫性疾病继发纯红再障患者血浆可抑制体外自身骨髓细胞红系集落形成。应用基因重组人EPO治疗的患者产生抗重组EPO抗体也可作用于内源性EPO,从而抑制红系祖细胞生长。抗体依赖的纯红再障尚可发生于异基因造血干细胞移植患者,而以ABO血型主要不合的移植最为多见。患者体内原有的同型血凝素与植入的不相合红系祖细胞血型抗原结合,抑制红系细胞生长产生纯红再障。不相合同型血凝素也可由移植患者体内长期存活的浆细胞产生。
微小病毒B19是一单链DNA病毒,通过细胞表面P血型抗原进入幼红细胞,并在细胞内进行复制,直接损伤红系祖细胞或抑制CFU-E生长发育,选择性抑制红系造血。在免疫功能正常者,微小病毒B19引起的红系造血抑制通常持续15天左右,一旦机体产生抗体,这种抑制作用即被清除。由于红细胞寿命较长,正常人感染微小病毒B19引起短暂骨髓红系造血停滞,并不表现明显的贫血症状;在溶血性贫血患者则可导致一过性再障危象(transient aplastic crisis,TAC),孕妇感染引起死胎,免疫缺陷患者感染不能产生针对微小病毒B19的特异性抗体以清除病毒,表现为慢性持续性纯红再障。
另外,文献报告肝炎病毒和EB病毒等多种病毒和细菌感染,也可通过细胞毒T淋巴细胞介导引起纯红再障。
文献报告多达50余种药物可导致纯红再障,不同药物诱发的纯红再障其发病机制也不尽相同,可为药物直接抑制或通过机体产生IgG以体液免疫形式抑制红系造血。实体瘤、感染、妊娠、严重营养不良和肾功能不全等也可继发纯红再障。
临床表现
贫血常是本病患者唯一的症状和体征。贫血呈缓慢进行性加重,诊断时患者多已达中重度贫血。儿童一过性幼红细胞减少症多由发热就诊或其他不适时检查血常规发现和诊断。原发性纯红再障除贫血症状体征外,查体一般无明显其他阳性体征。患者出现肝、脾、淋巴结肿大,常提示为继发性纯红再障。继发性纯红再障则可表现相应基础病症状和体征。依赖输血的慢性难治性纯红再障可表现输血相关继发血色病或肝炎等。目前尚无有效手段鉴别慢性持续性纯红再障和急性自限性纯红再障。急性纯红再障呈短暂疾病过程,虽各年龄均可发生,但更常见于儿童患者,成年人极少。另外,急性纯红再障主要由病毒感染所致,也可见于某些药物和化学品接触,故仔细询问病史常能获得重要诊断线索。
诊断
纯红再障诊断主要依据血液学检查。凡单纯贫血、网织红细胞减少和病史不支持营养性贫血者均应疑及纯红再障,需进一步骨髓细胞学检查以诊断或排除。
纯红再障外周血呈正细胞正色素性贫血,网织红细胞绝对值减少;白细胞分类计数正常,偶可出现轻度白细胞减少、淋巴细胞增多或嗜酸性粒细胞增多。血小板计数正常,也可轻度减少或反应性增高。纯红再障特征性骨髓表现为幼红细胞明显减少,甚至完全缺如,但粒系细胞和巨核细胞不减少,偶有嗜酸性粒细胞增多,各系细胞形态无明显异常。在活动性微小病毒B19感染患者骨髓中有时可发现体积大、胞质有空泡的原始红细胞。
患者血清铁和血清铁饱和度增加,铁动力学研究血浆59Fe的清除时间显著延长,铁利用率降低,与骨髓中红细胞系统减少的发现是一致的。红细胞生存时间正常。多数患者血清蛋白电泳正常,但有些患者γ-球蛋白增高或降低。
诊断明确后尚需评价纯红再障可能的原因,包括:仔细病史询问,尤其近期用药史和感染病史;肝肾功能;自身抗体检测,包括抗核抗体和抗EPO抗体等;骨髓造血细胞遗传学分析;T细胞受体(TCR)基因重排;外周血流式细胞术检测CD2、CD3、CD4、CD5、CD8、CD16、CD56和CD57;病毒学检测,包括微小病毒B19 DNA;CT或MRI检查除外胸腺瘤或其他淋巴瘤。
鉴别诊断
纯红再障不难诊断,但由于各类型患者治疗和转归不尽相同,仍需仔细鉴别。
在成人,原发性纯红再障主要应与以纯红再障为初始表现的MDS相鉴别。表现为纯红再障的MDS有以下表现,可用于与原发性者进行鉴别。网织红细胞通常>1%,平均红细胞体积轻度增大,仔细分析外周血涂片可能发现单核细胞增多、Pelger-Huet畸形;骨髓幼红细胞减少,但很少<5%,且通常表现巨幼样变特征,可有粒系和巨核细胞形态改变,粒系细胞核左移,原始细胞增多,单圆核巨核细胞或小巨核细胞增多;骨髓造血细胞染色体核型可异常。对于免疫抑制治疗无反应的原发性纯红再障,应特别注意复查以除外MDS。
儿童纯红再障需鉴别为先天性抑或获得性,即DBA与TEC鉴别。
先天性纯红再障与儿童获得性纯红再障鉴别

CMV:平均红细胞体积;HbF:胎儿血红蛋白;ADA:腺苷脱氨酶
治疗
一、支持治疗:为了减轻贫血症状,多数患者在获得治疗反应前需输注红细胞。治疗无效患者多持续红细胞输注依赖,易继发血色病需去铁治疗。
二、免疫抑制治疗:免疫抑制治疗适用于原发性纯红再障、胸腺瘤继发纯红再障、抗EPO抗体所致纯红再障,以及其他继发性纯红再障经针对原发病治疗4周骨髓红系造血无恢复迹象者。常用药物包括肾上腺糖皮质激素、环孢素和环磷酰胺等。泼尼松一般以1mg/ (kg•d)剂量起始口服,直至贫血缓解,文献报告缓解率30%~62%。大约40%患者应用泼尼松4周内即可表现治疗反应,网织红细胞明显上升;若用药12周仍无缓解迹象则需改换方案,不应继续应用。血红蛋白达正常水平后可缓慢减量泼尼松,最终以小剂量维持或完全停药。环孢素诱导缓解治疗可采用口服3~5mg/(kg•d)剂量起始,缓解率可达65%~87%。环磷酰胺治疗纯红再障缓解率20%左右,但患者缓解时间明显长于泼尼松治疗。环孢素和环磷酰胺分别与泼尼松联合治疗纯红再障反应率与单药应用相近,但患者疗效持续时间更长,复发减少,各单药应用剂量也可减少,因而药物不良反应减轻。
难治性患者也可采用抗胸腺细胞球蛋白、抗CD20单克隆抗体(利妥昔单抗,rituximab)和抗CD52单克隆抗体,部分患者仍可有效,但长期疗效不祥。
三、雄性激素治疗及脾脏切除治疗在某些患者也可获得一定疗效。
四、静脉注射大剂量丙种球蛋白含有中和抗体,用于免疫缺陷患者微小病毒B19感染引起的慢性持续性纯红再障,可获得良好疗效。
(张凤奎)
