调理素受体包括免疫球蛋白(IgG,IgA)受体和补体C3受体。这类受体与IgG(或IgA)和C3补体分子中的Fc结构域相结合,从而使中性粒细胞识别经它们调理了的病原体颗粒或免疫复合体。免疫球蛋白受体也称Fc受体,近年又分为若干亚型:属IgG的有FcγRⅡ(CD32),FcγRⅢ(FcγRⅠ是巨噬细胞的受体组分)。属IgA的有FcαR,补体C3受体有CR1(CD35)和CR3(CD11b/CD18,Mac-1),CR1是分子量为205 000~250 000的膜糖蛋白分子。CR1 对C3b有高亲和性,CR3对C3bi有高亲和性,FMLP等激活中性粒细胞的因子能迅速增加补体受体的表达。JOHN等(1985)证明中性粒细胞中存在补体受体库。调理素受体具有介导吞噬作用的能力,补体受体CR1主要促使对病原体等的黏附作用,增进对由CR3介导的C3b/C3bi调理的颗粒的吞噬。Fc受体也增进细胞对病原体颗粒的吞噬和消化。进一步研究证明,FcγR亚型中的FcγRⅢ型是FcγR中的主体,富集于中性粒细胞的质膜表面,约占FcγR的80%,在与IgG调理颗粒的结合中占首位。在炎症反应中,FcγRⅢ与补体、FMLP的受体和甘露醇相关联,此外,FcγRⅢ具有磷酸肌醇锚的作用,可能在信息传递至微丝,引起吞噬体形成中有重要意义。佛波酯能引起FcαR表达增加,GM-CSF和G-CSF能减少FcαR数量(每个中性粒细胞约104个FcαR分子),但可增加FcαR的亲和性,因而可增进其吞噬作用。Fc受体的结构已基本清楚。Petty(1993)等认为CR可能是其他膜受体的组成素材。
FcγR的性质和功能
近年研究表明,FcγR参与对免疫复合体的清除、抗体包被的病原体的吞噬、促进抗原活性、分泌活性氧中间体、抗体依存性细胞的细胞毒作用(ADCC)和抗体包被的肿瘤细胞的细胞毒作用,可能还在动脉粥样硬化中起作用。
这类受体分子似只在人髓系细胞(单核细胞、巨噬细胞、嗜酸性粒细胞和中性粒细胞)上表达,具有介导肿瘤细胞ADCC的性能,而且在肿瘤的抗体治疗中起重要作用。FcγR在免疫系统的抗病原体防御中更为重要。人白细胞FcγR的表达已用单克隆抗体(mAbs)测定。已有三类不同的人FcγR被鉴别,即FcγRⅠ、FcγRⅡ和FcγRⅢ。所有这三种FcγR均属染色体1,它们是结构上互有关联、功能上完全不同的免疫球蛋白超家族成员。FcγR在骨髓细胞上的表达见表:
FcγR在骨髓细胞上的表达(每1000个细胞上的受体数)
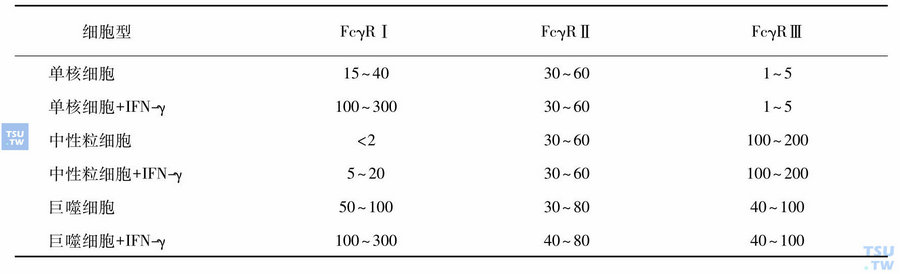
体内用G-CSF刺激中性粒细胞后FcγRⅠ的表达可增至5000~10 000倍。已发现FcγR有若干异型体存在,这表明FcγR呈多型性(polymorphism)。现在认为FcγR的多型性,可能反映了细胞对抗体包被的“靶子”的多种识别和对免疫复合体吞噬、杀死等功能的完整性。至少有两种FcγR的异型体存在,用cDNA探针已鉴别了三种FcγRⅡ相关分子,它们具有完全相同的胞外结构域和不同的胞内微区。在表型上,无论是单核细胞的还是中性粒细胞上的FcγRⅡ均有LR(low-responder)型和HR(highresponder)型二种异型体。LR型细胞在与IgG2抗体亲和性方面比HR型的高得多。因此,具LR型的吞噬细胞对IgG2调理的“靶子”的消化比HR型的吞噬细胞快得多。由于IgG2是一些特定抗原(细菌和多糖等)的主要抗体,可能HR型细胞对免疫复合体的结合能力和吞噬能力不如LR型细胞。LR型的中性粒细胞吞噬IgG2调理的细菌的能力始终强于HR型。
FcγRⅢB也具有NA1和NA2两种异型体,NA2型的中性粒细胞比NA1型中性粒细胞有更强的吞噬能力,尤其是对IgG调理的“靶子”。另一种FcγR的异型体是FcγRⅢA,它表达在单核细胞和LGL/ NK细胞上。对FcγRⅠ的异型体目前尚不清楚。FcγR的分布及其有关异型体列于表:
人FcγR的一般特性及IgG异型性
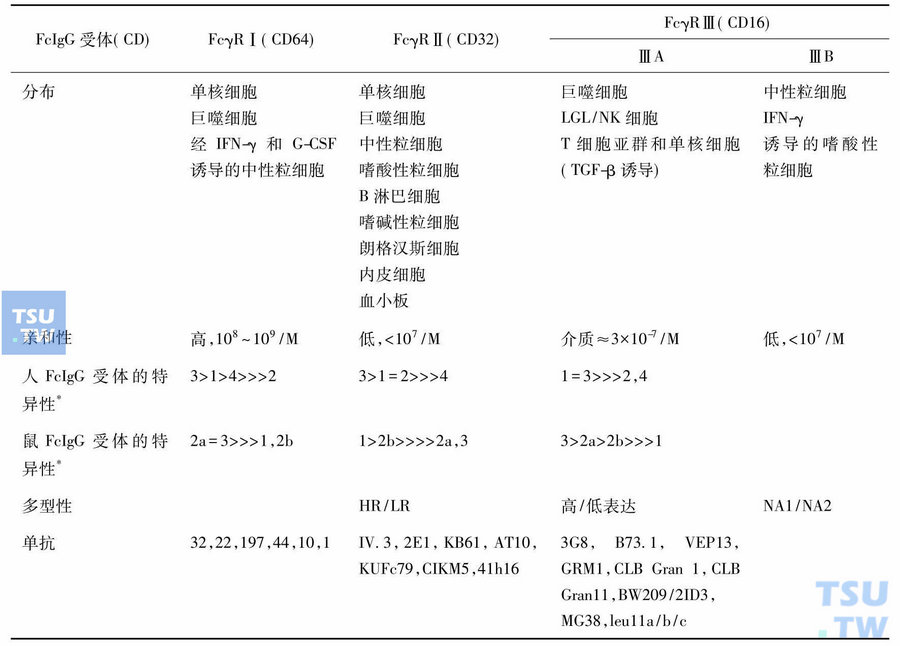
*1、2a、2b、3、4分别指FcIgG的不同亚型(IgG1、IgG2a、IgG2b、IgG3和IgG4)
不同FcγR异型体的吞噬细胞在功能上明显不同,HR异型体的中性粒细胞和单核细胞对IgG2调理的细菌的结合能力,即使在补体存在时也不如LR异型体的细胞。临床发现具有HR异型细胞的儿童反复感染细菌,表明FcγR的多型性可能对保持对细菌感染的敏感性有重要性。
应用各类FcγR单抗与细胞表面FcγR交联,随即测定相应细胞的吞噬功能,ADCC、ROI和细胞因子的释放是研究吞噬细胞FcγR功能的常用方法。用FcγRⅠ单抗的研究表明,其抗原决定部位的结合点不在其与配体的结合点上,但同样可激活ADCC、吞噬作用、酶的释放及超氧化物生成。用单抗的F(ab')片段与FcγRⅠ交联,发现在交联的受体数与产生的超氧化物量之间存在数量关系,表明配体位点外的受体交联也是FcγR功能所必需的重要环节。人单核细胞的FcγRⅠ、FcγRⅡ和FcγRⅢ均能介导杂交瘤细胞的杀灭作用,而细胞表面的其他分子则不能。表明FcγR可能是介导ADCC杀灭这些细胞的唯一分子。IFN-γ不仅能促进FcγRⅠ的表达又能通过FcγRⅠ增强单核细胞的ADCC。中性粒细胞没有通过FcγRⅠ、FcγRⅡ或FcγRⅢ溶解杂交瘤细胞的功能,但当用IFN-γ与之共培育时,FcγRⅠ和FcγRⅡ就具有触发细胞毒功能的的扳机功能,而FcγRⅢ则不能,说明FcγRⅠ引发的中性粒细胞杀菌作用与IFN-γ的受体诱导作用相关联,但IFN-γ不能增进FcγRⅡ的表达但可引起内在细胞毒机构的明显变化。中性粒细胞的FcγRⅢ不能介导对杂交瘤细胞的细胞毒作用,即使与IFN-γ共培育也不能。
近年对FcγR功能研究得最多和最深入的是FcγRⅡ,特别是在对多种激酶的激活作用方面更有新的进展。FcγRⅡ的交联反应能够引起人中性粒细胞、自然杀伤细胞、V937细胞、B细胞、嗜酸性粒细胞和巨噬细胞Ca2+的流动和磷酸肌醇的翻转,表明在FcγRⅡ激活过程中激活了PKC。FcγRⅡ交联引起的胞内Ca2+的流动,磷脂酶C-r1的酪氨酸磷酸化可能起主要作用。已有报告指出,与FcγRⅡ相关联的酪氨酸激酶Fgr和酪氨酸激酶P72SYK参与经FcγR的信息传递。FcγRⅡ有一跨膜区和胞质尾部,FcγRⅢ则通过PI-多糖锚合于细胞表面。无论哪种受体均不含有蛋白激酶催化微区,因此它们必须通过耦联方式间接传递信息。FcγRⅡ的交联效应所引起的PKC的激活和酪氨酸激酶磷酸化即是此例,这些反应可为木黄酮(genistein)强烈抑制。虽然酪氨酸激酶的活化是激活信号瀑布系统的主要环节,但近年研究表明,另一些激酶如苏氨酸和丝氨酸激酶的活化也是非常重要的。研究表明,当用趋化因子激活中性粒细胞时会引起多种激酶的活化:FMLP刺激中性粒细胞时,发现除酪氨酸磷酸化作用外,PKC、丝裂原依存性蛋白激酶(mitogenactivated protein kinase,MAPK)、钙离子/钙调蛋白依存性蛋白激酶Ⅱ(CAMPKⅡ)、S6-激酶Ⅱ和组蛋白H4蛋白激酶(PKH4)也被激活。进一步又发现一些重要的中性粒细胞激酶可被FMLP与FcγRⅡ交联所激活,其中一些激酶可能与PKH4相似,也是以组蛋白H4为底物,这些结果鼓舞了学者们通过FcγRⅡ的交联(包括用木黄酮等抑制剂)进一步探索FcγRⅡ诱导产生的细胞内代谢进程。
补体受体Ⅲ(CR3)的功能
CR3(CD11b/CD18,Mac-1)是白细胞整合蛋白,参与多种细胞功能,CR3还可能与其他质膜受体一起互通信息以实现多种细胞功能,因而CR3的生化特性和其功能研究十分重要。
CR3属细胞黏附分子整合蛋白超家族的β亚属,主要参与有关白细胞黏附功能的活动,包括细胞黏附、细胞溶解、吞噬作用和趋化作用等。经SDSPAGE分析CR3是由155和94kD二个亚基组成的异二聚体,每个亚基均跨越膜双脂层。CR3与细胞骨架作用并促进胞质信息释放。CR3是一种多能性的膜识别装置,起到扳机的作用。此外,也是补体片段C3bi的受体。可识别酵母多糖、β-葡聚糖、大肠菌、脂多糖、利什曼原虫和纤维蛋白原,CR3的糖链已通过ConA和大肠菌凝集素识别。
若干证据表明,CR3与FcγR受体相互作用,较早的研究显示,抗CR3单克隆抗体Fab片段可抑制IgG依存性吞噬作用,进一步又证明患有白细胞黏附性缺陷(LAD)的病人与对照相比,其中性粒细胞IgG依存性吞噬作用和胞溶作用大为削弱。玫瑰花结等试验表明CR3可能与FcγR作用,果然,稍后的结果表明CR3和FcγRⅡ(CDW32)在产生LTB4中耦联。当中性粒细胞与包被的免疫复合体发生黏附时,接近免疫表面的是CR3而不是FcγR,而且也触发了细胞骨架,这为证明CR3参与抗体依存性功能活动提供了依据。CR3可与FcγRⅢ(CD16)产生共成冠(cocapping)反应,为CR3与FcγR相互作用提供了更可靠的依据。而且还发现一种作用于CR3的凝集素样位点的特殊糖类,可以抑制共成冠反应。同时,这种糖类还可降低免疫复合体依存性跨膜信息传递和超氧化物产生。这说明在共成冠反应中证明的受体与受体间的相互作用参与了信息的跨膜传递和超氧化物的生成。对转化的成纤维细胞研究的结果又证明无论是CR3还是FcγRⅢB,均不能单独触发抗体依存性吞噬作用,而只有共同表达这些受体的细胞才具有抗体依存性吞噬作用。
糖基磷脂酰肌醇(GPI)结合蛋白是一种膜转换器,CR3也可能有这种功能。CR3的膜转换器功能可包括膜外和膜内两部分,可归纳为蛋白依存性和糖类依存性两种。蛋白依存性转换器功能已如前述,其糖类依存性识别机制包括由其凝集素样位点的介导作用和通过糖链与其他凝集素作用两种方式。已有证据证明CR3能与膜平面上的其他膜蛋白分子通讯,如CR3-FcγRⅢ或CR3-FcγRⅡ之间的相互作用,它们协同升调节或降调节参与受体之间的内运作(interplay)。除了与FcγRs外,CR3还能与尿激酶型血纤维蛋白溶酶原活化因子受体(UPaR)和另一些糖基化的GPI结合蛋白相互作用。还证明FcγRⅢB与FMLP受体有通讯关系。CR3具有膜转器的功能对解释受体间的相互作用和受体缺陷病等有重要意义。
中性粒细胞的趋化作用、吞噬作用和黏附作用等功能需要细胞骨架参与,已证实整合蛋白分子与细胞骨架相关联;CR3与细胞骨架间有通讯关系,整合蛋白传送机械信息(mechanical signal)至细胞骨架。当CR3与C3bi结合时,CR3与细胞骨架的肌动蛋白微丝的接近度明显增加。以前曾揭示免疫复合体可增加CR3与微丝的接触,而FcγR则不能,这表明若干受体分子可能影响化学信息的跨膜传递和经由CR3传递的机械传动(mechanotransduction)。细胞骨架可能像在受体-受体相互作用中那样也在其他跨膜蛋白间起某种作用,尽管CR3-CR3相互作用的详细内容还不清楚,但CR3在膜上的群集也许反映了其细胞骨架的结构状态。另一些特殊跨膜蛋白如FMLP受体也可能在驱动与CR3的作用中牵制细胞骨架。受体与受体的相互作用不是单一性的,它们彼此间有不同的亲和性,而这种亲和性又受胞内信息或配体状态的调节或受膜平面缩减的限制。由CR3和其各种配体形成的多种复合体产生了各种各样的信息,如上述三种跨膜蛋白中的每一种都产生一种胞内信息,则就有七种不同的胞内复合反应。此外,CR3可能向另一些膜受体如FcγRⅢB和UPaR提供了一个机械传动装置,从而可以影响吞噬细胞的吞噬和迁移。整合蛋白受体-受体间的相互作用还可见于T细胞。
黏附性蛋白
CD11/CD18复合体是白细胞表面极重要的功能蛋白,对白细胞的多种重要功能皆有影响。该复合体的构成都是由一个分子量较大的α亚基(CD11)与一个分子量较小的β亚基(CD18)通过非共价键连接形成的二聚体糖蛋白。整合蛋白家族黏附分子均由α、β亚基组成异二聚体。α、β亚基都由细胞外区、跨膜区和细胞质区组成,α亚基上有Mg2+/Ca2+结合区。β亚基上富含胱氨酸重复区,β亚基因组成不同,又可分为β1、β2和β3三个亚族,中性粒细胞的CD11属β2亚族,分子量较大的CD11(α亚基)可分为CD11a、CD11b和CD11c。可分别与分子量较小的CD18(β亚基)形成各自的复合体:CD11a/CD18、CD11b/CD18和CD11c/CD18,分别又称为淋巴细胞功能相关抗原-1(LFA-1)、巨噬细胞抗原-1(Mac-1)和GP150,95。含有150、95kD二种肽的CD11c/CD18二聚体也称Ⅳ型补体受体CR4。CD11b/CD18是前述之CR3。三种受体统称为CR3糖蛋白家族或CD11/CD18糖蛋白。这些黏附分子在白细胞的免疫和炎症反应中起关键作用,白细胞整合蛋白家族是整合蛋白超家族的一部分。已发现有30余种成员的整合蛋白家族分布在白细胞、内皮细胞和血小板表面。在进化发育系统方面,家族成员之间在结构与功能上相互关联。黏附性蛋白主要介导细胞-细胞及细胞-胞外基质的相互作用。CR3表达不足或缺乏直接影响中性粒细胞的吞噬作用和趋化作用。
LFA-1除了某些组织的巨噬细胞外在所有免疫细胞上均有表达。
Mac-1在粒细胞、单核细胞、巨噬细胞和某些未成熟的CD5+Ve B细胞上均有表达。
GP150,45表达大体同Mac-1,并在某些细胞如T细胞和活化淋巴细胞上也有表达,并且也是毛细胞白血病(hairy cell leukemia)的标志。
白细胞整合蛋白的表达和结合活性受多种因素调控:①表达与造血促红细胞生成素(haemopoietin)成熟度相关联。②与细胞激活的状态相关联。③活化细胞可增强这些受体的结合活性和功能活性,从而导致受体分子本身数量上的变化。
Mac-1的主要配体是C3bi,近年又发现若干种。Mac-1至少有两个不同的结合位点:其一可识别含有RGD(精-甘-天冬)序列的多肽,其二则识别脂多糖(LPS)和有关糖类,这是介导粒细胞和内皮细胞黏附的位点。LFA-1的配体主要是免疫球蛋白超家族的黏附性受体成员之一的细胞内黏附分子-1(ICAM-1),后者是T和B细胞的抗原特异性受体。
G蛋白的结构与功能
鸟嘌呤核苷酸结合蛋白(guanine nucleotide binding protein)简称G蛋白,广泛存在于原核和真核细胞生物中,是一类能与鸟嘌呤核苷酸(GTP)可逆结合的异三聚体膜蛋白。它参与细胞内一系列的信息传递,如跨膜信使物质的信号传递、蛋白质生物合成和细胞骨架的形成等。在结构上,它是一个庞大的家族,异三聚体G蛋白由α、β和γ三个亚基组成,它主要参与跨膜信号的传递,其传递途径一般包括受体、G蛋白和效应器三个环节。中性粒细胞介导的跨膜信号主要通过异三聚体G蛋白与磷脂酶耦联进行,从而引起细胞广泛的生理、生化反应。G蛋白是一种GTP酶,通过结合并利用GTP在刺激耦联中传递信息。百日咳毒素(pertussis toxin)可有效抑制G蛋白活性,故称这种对百日咳毒素敏感的G蛋白为GE或GO。G蛋白上存在GTP/GDP的结合位点。已有证据表明G蛋白的α亚基C端α螺旋结构是受体接触的位点。百日咳毒素催化G蛋白α亚基靠近C端处的CYS ADP-核糖基化。这样就阻止了G蛋白与受体分子的相互作用。G蛋白对腺苷酸环化酶的活性有调控作用,调控作用通过两种不同的G蛋白Gs(stimulatory G protein)和Gi(inhibitory G protein)进行;不同的信号传递到不同的受体上,再分别通过Gi和Gs控制腺苷酸环化酶的活性,双重调节cAMP的量,发挥第二信使作用。已知Gsα亚基中激活腺苷酸环化酶的位点在235~365残基之间。定点突变的结果表明,靠近保守序列Asn-Lys-X-Asp的一个环状结构参与了与腺苷酸环化酶的相互作用。近年研究还表明,各种G蛋白的一级结构中不存在任何经典的转膜螺旋序列。一般认为G蛋白与质膜的内表面结合,而β、γ亚基作为抛锚结构,固位G蛋白,当α亚基被激活时,就从G蛋白上解离下来。
ras蛋白是G蛋白的一种,广泛存在于从酵母到人类的真核细胞中,具有高度的同源性。从酵母中已鉴定出二种ras相关性低分子量G蛋白(LMWGBPs),它们是Sec4p和Ypt4p。后来又发现另一种属rab家族的LMW-GBPS,而且与哺乳动物Sec4p 和Ypt1p同源。1990年自中性粒细胞质膜分离并克隆了若干种LMW-GBPS,它们是rapl、rac1和rac2,并知它们与rasp2121高度同源,更重要的是知道了rapl与产生超氧化物的NADPH氧化酶的主要组分细胞色素b558耦联。
