过去二十多年,FDA批准的抗肿瘤药物(包括靶向药物)已有30多个。虽然这些药物都能取得一定临床效果,但大多数癌症患者生存期增加是有限的。最近证实肿瘤中含有由极少数能自我更新、迅速增殖和分化能力的肿瘤干细胞,它维持肿瘤的生长、复发和耐药。现行的抗肿瘤药,包括靶向药物针对的是肿瘤的大部病灶,它能降低肿块(即分化癌细胞)的大小,虽可产生明显的临床效果,但如果没有同时靶向肿瘤干细胞的话,也不可能取得长期缓解。反过来,只选择性攻击肿瘤干细胞也不可能立即消除分化的癌细胞,如果单独按照以肿瘤病灶的大小改变的传统标准来判定疗效的话,靶向干细胞的新药就会过早地被淘汰。合理的治疗策略应该是杀灭增殖、分化的癌细胞和肿瘤干细胞相结合的靶向治疗。
白血病是严重威胁人类生命和健康的恶性疾病,白血病的治疗已经由单纯的传统细胞毒药物发展到干细胞移植、靶点药物的应用等多种方式和手段的综合治疗,使白血病缓解率大大提高。尽管如此,难治、残留和复发仍然是白血病治疗的巨大障碍和亟待解决的难题。
随着研究的深入,证实肿瘤干细胞是肿瘤复发的根源。“肿瘤干细胞”(tumor stem cell,TSC)的概念自提出经历了五十多年的漫长历程。随着实验动物学的发展,1994年,Lapidot等在肿瘤干细胞研究沉寂了近二十年之后,首次报道人急性髓细胞白血病(acute myeloid leukemia,AML)细胞中确实含有白血病干细胞(leukemia stem cell,LSC),认为AML中只有0. 1%~1%的细胞有生成白血病的能力。随后,Bonnet等首次在NOD/SCID小鼠体内证实,接种106个LSCs即可在动物体内形成人AML,这一结果具有里程碑意义。它不但在血液肿瘤而且在某些实体瘤也得到证实。这些肿瘤包括骨髓增生异常综合征(MDS)、乳腺癌、脑瘤、肺癌以及最近发现的黑色素瘤。
肿瘤化疗评价标准与生存期
血液肿瘤的治疗现行疗效标准的临床缓解并不能预测生存期的延长。例如,滤泡性淋巴瘤(follicular lymphoma)化疗后取得CR的患者生存期并不比不治疗只“观察和等待”(watch and wait)的患者更长;在多发性骨髓瘤(multiple myeloma,MM),肿瘤负荷和治疗反应速度都不对生存期有影响;同样,前列腺癌、胰腺癌、乳腺癌和肺癌患者,虽然取得了明显的临床效果但生存期并不明显延长,即使治疗反应与统计学上生存期改善是相关的,生存期增加也甚少,常为几周到几个月。伊马替尼(imatinib)作为肿瘤靶向药物的里程碑性药物,在治疗初治慢性髓性白血病中取得了明显效果,然而迄今未能证明伊马替尼能延长患者的生存期,而且现有数据提示伊马替尼不能根除CML,伊马替尼达到最佳疗效的患者停药后也会很快复发,继续用药疾病仍在进展,提示还有其他因素在起作用。
伊马替尼的作用靶点是BCR-ABL。BCR-ABL基因扩增和基因突变可使CML对伊马替尼产生耐药。此外,CML干细胞与正常造血干细胞(HSC)一样,大部分处于静止状态,同时高表达MDR1 (ABCB1)和BCRP(ABCG2),这两个因素限制了细胞对伊马替尼的吸收。更重要的是BCR-ABL对CML干细胞和分化的祖细胞(CML的大部分组成)的影响不尽相同。BCR-ABL为CML祖细胞生存所必需,而CML干细胞的BCR-ABL可能静默,这提示伊马替尼靶向的不是干细胞。
伊马替尼治疗的CML能获得迅速缓解,这可能与它对分化CML祖细胞组成的细胞群具有显著活性有关。但这种早期反应可能并不持久,这可以用CML干细胞对伊马替尼耐药来解释。相反,用干扰素(IFN)治疗的疗效却是慢而持久,这与其主要导向极为稀少的CML干细胞有关。因此,选择性攻击肿瘤干细胞将不会立即清除分化的肿瘤细胞。
多发性骨髓瘤细胞中也有极少数骨髓瘤干细胞,这些细胞具有自我更新、分化和维持疾病的能力。新的抗骨髓瘤药物硼替佐米(bortezomib,蛋白酶体抑制剂)和lenalidomide(第二代沙利度胺)体内对浆细胞具有良好活性,但体外试验对骨髓瘤干细胞却无明显作用。这就解释了为什么这些药物有明显疗效却不能治愈疾病。相反,美罗华(抗CD20单抗)体外对骨髓瘤干细胞有良好活性,但对不表达CD20的成熟浆细胞基本无效。或许更长疗程的美罗华治疗能显示出类似传统治疗的疗效,即通过抑制产生新的骨髓瘤细胞而使终极分化的骨髓瘤细胞自然凋亡而达到疗效。
传统反应标准测量实体瘤病灶大小或白血病细胞数不可能反映稀少的肿瘤干细胞群的变化。针对分化的肿瘤细胞的治疗可能产生疗效但不能治愈疾病,除非使维持疾病的肿瘤干细胞得到根除。传统的疗效标准不但可能过高估计药物对少量干细胞的作用,也可能过低估计了它的疗效,如IFN治疗CML和美罗华治疗骨髓瘤。
白血病干细胞靶向治疗
明确了LSC是肿瘤发生、疾病难治和复发的根源,人们认识到只有杀灭LSC才有可能根治白血病。随着人们对LSC生物特性研究的不断加深,以及对HSC和LSC差异的逐步了解,针对LSC的表面标记或细胞内信号分子进行生物治疗和小分子抑制剂的靶向性治疗也随之兴起。
迄今研究发现LSC的生物学特性有:大部分LSC与HSC一样处于G0期,对周期特异性抗白血病药物如Ara-C的敏感性低;高表达ABC转运蛋白MDR1和BCRP1导致药物外排;LSC表达CD34+ CD38-,与HSC不同,LSC还表达CD123,而且细胞内的死亡相关蛋白激酶(death-associated protein kinase,DAPK)、干扰素调节因子1(interferon regulatory factor 1,IRF1)和核转录因子NF-κB的表达也上调。这些特性使根除肿瘤干细胞成为可能。
靶向LSC核转录因子NF-кB
与HSC不同,LSC内的核转录因子NF-кB处于活化状态,是很好的靶标。蛋白酶体抑制剂MG-132(下图)首先在实验室被用于靶向LSC的治疗,它通过抑制核转录因子NF-кB的激活和活化p53调节基因,可选择性地杀灭LSC,而对HSC几乎没有影响。研究者同时发现,处于静止期的LSC中NF-кB仍然保持活化状态。因此,NF-кB可以作为杀灭LSC的靶。MG132联合表柔比星(epirubicin,ADM)处理细胞,可上调p53、BAX、GADD45及p21WAF/CIP基因的表达,并通过抑制NF-кB活性而下调抗凋亡蛋白bcl-XL的RNA水平,大大减少LSC诱发NOD/SCID小鼠肿瘤的发病率。
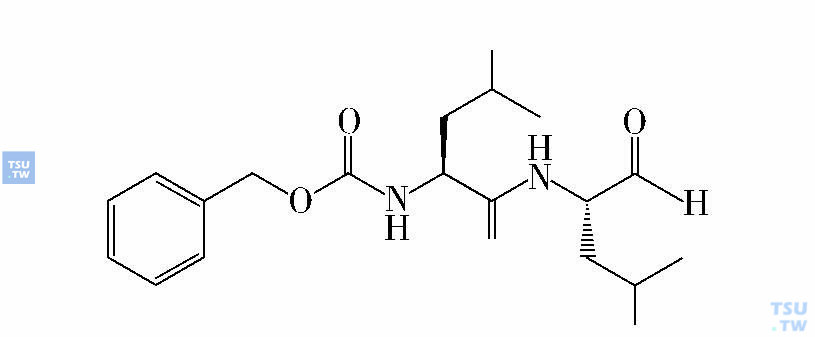
蛋白酶体抑制剂MG-132结构图
硼替佐米(bortezomib)是第一个FDA批准用于多发性骨髓瘤治疗的蛋白酶体抑制剂。它作用在蛋白酶体NF-кB信号途径的蛋白酶体上,而非作用在NF-кB,体外实验证明它不能特异针对骨髓瘤干细胞。
小白菊内酯(parthenolide,PLT)(下图)是来源于菊科植物的倍半萜烯内酯,一直用于治疗偏头痛和风湿性关节炎,近年来,PLT被证实为NF-кB的强抑制剂,通过与NF-кB抑制因子激酶(IкB kinase,IKK)的直接结合,抑制NF-кB p50和NF-кB p65两个主要亚基。50μM剂量下,PLT对HSC的抑制仅20%左右,而对CD34+/CD38-的AML细胞产生100%的抑制作用;经PLT处理的AML细胞接种到NOD/SCID小鼠后发病率显著降低。进一步研究开发PLT的水溶性衍生物DMAPT已进入Ⅰ期临床试验。
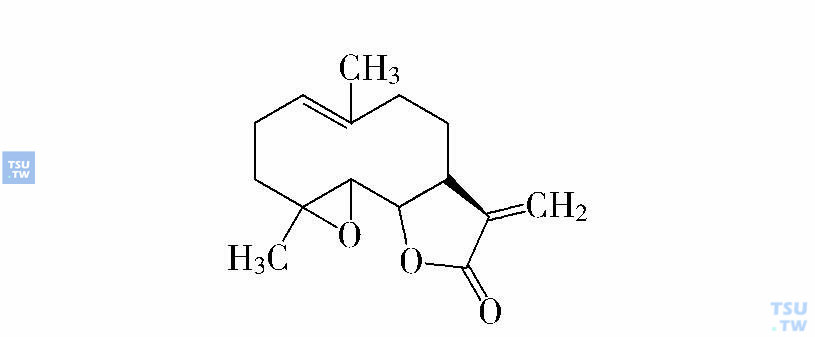
小白菊内酯结构图
另有研究表明,AML中flt3基因突变导致Flt3持续活化,后者通过激活Ras使NF-kB活化,提示应用Flt3抑制剂来靶向NF-kB是治疗AML的有效方法。可见,靶向NF-кB是一种有效的靶向LSC治疗方向。
靶向干细胞信号传递Hedgehog
Hedgehog分子(SHH、IHH和DHH)在胚胎干细胞发育和许多组织分化中是重要信号蛋白。Hedgehog(HH)结合于细胞表面受体Patched(PTCH)和通过Smoothened (SMO)和GLI蛋白的信号途径。这条途径在痣样基底细胞瘤综合征(nevoid basal-cell carcinoma syndrome)患者中发现PTCH突变因而在肿瘤形成中起明确作用。其他的HH成员也被发现是肿瘤的抑制基因或癌基因。最近,发现HH-PTCH途径的组分在大部分的肿瘤发生分裂或过度表达,这包括散发的成神经管细胞瘤(sporadic medulloblastoma)、乳腺癌、前列腺癌、胃癌、直肠癌和胰腺癌。
大部分散发性成神经管细胞瘤或者是种系PTCH突变或者是通过甲基化使PTCH沉默。采用SMO抑制剂环帕敏(cyclopamine)治疗成神经管细胞瘤能使增殖降低和分化相关基因表达改变。SHH高表达的小细胞肺癌细胞株,既可以用SHH抗体也可以用环帕敏抑制其生长。相似地,在食道癌、胃癌、前列腺癌和胆道癌,以及相应的肿瘤细胞株中,也发现HH的高表达和HH-PTCH途径的活化。环帕敏可抑制小鼠的胰腺癌和前列腺癌。
环帕敏是从百合科植物加州藜芦(veratrum californicum)提取的甾体生物碱(下图)。经证实环帕敏的致畸和抗癌活性是由于特异地抑制脊椎动物细胞对分泌的生长因子家族Hedgehog(HH)反应引起的。它通过直接结合到细胞内蛋白Smoothened (SMO)特异地抑制HH途径的活化。而正常的信号传递,蛋白HH结合于受体Patched(PTCH),因此减轻PTCH调节对G蛋白耦联受体远亲SMO的抑制。然后SMO的活化驱动一系列细胞内事件在胶质母细胞瘤(GLI)依赖转录活化达到高峰。
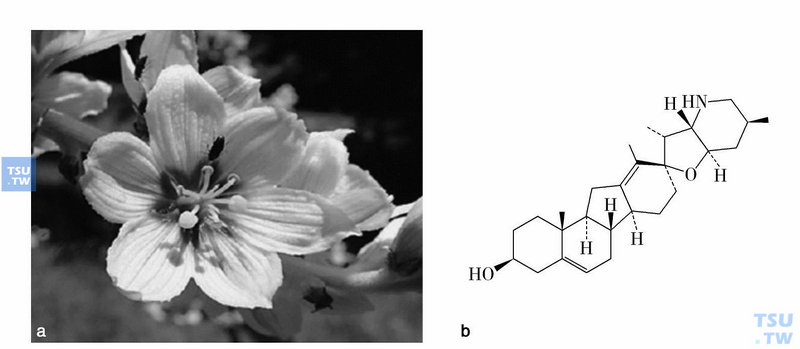
百合科植物加州藜芦(veratrum californicum)(a)和环帕敏(cyclopamine)(b)
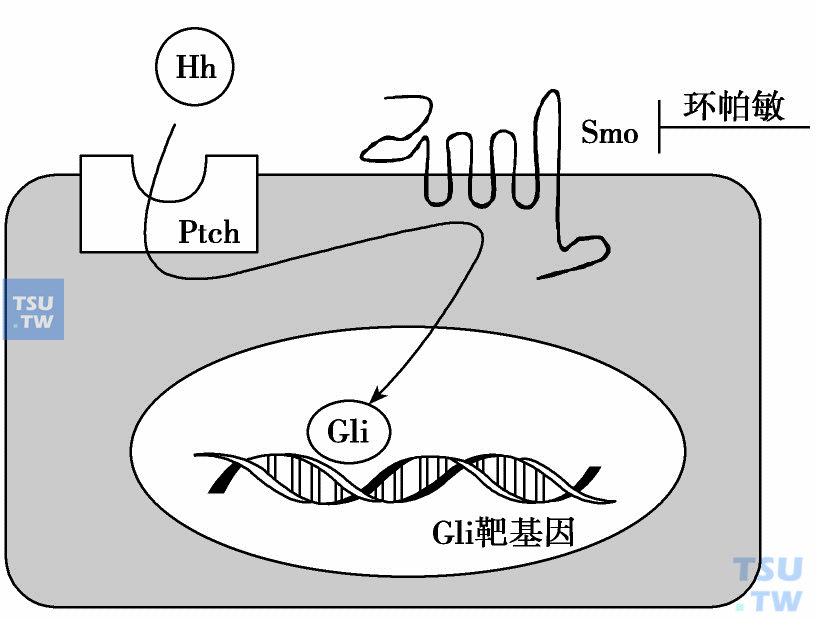
细胞内蛋白Smoothened(Smo)特异地抑制生长因子家族Hedgehog(Hh)途径的活化途径
HH过度表达可能导致组织干细胞不受调节的生长,结果异常的干细胞驱动过度增殖引起前期恶化的病灶。不受调节干细胞可能是驱动干细胞形成肿瘤干细胞遗传事件的靶标。肿瘤干细胞的继续演化可能引起转移或进一步耐药性肿瘤干细胞的出现。
靶向CD123的治疗
吉妥珠单抗(gemtuzumab),是抗CD33单抗和刺孢霉素(卡里奇霉素,calicheamycin)耦联物,FDA已批准用于急性白血病(AML)的治疗。CD33是AML分化抗原,但新近发现它在HSC和LSC都有表达。吉妥珠单抗应用后患者会出现持续性血细胞减少,可能与该药物抑制HSC有关。因此,靶向干细胞应有选择性。
CD123是人白细胞介素3(IL-3)的细胞表面受体,只表达于LSC表面,而HSC几乎不表达,因此,特异性地作用于CD123,就可以在杀灭LSC的同时保护HSC不受影响。DT388-IL3是一种由免疫毒素和CD123的配体IL-3构建的融合蛋白,研究表明,DT388-IL3对原始的AML和CML具有选择性杀灭作用,对HSC无影响,是开发LSC靶向性药物一条有希望的途径。
靶向ABC家族蛋白的治疗
ABCB1/Pgp和ABCG2/BCRP不仅对HSC和LSC的生存有保护作用,抵御血清饥饿和毒素等刺激对干细胞的伤害,而且是导致LSC耐药的主要因素之一,这些耐药相关蛋白在LSC中高表达,因此也是潜在的治疗靶分子,现有的靶向ABCG2等转运蛋白的MDR逆转剂就可能成为LSC的靶向抑制剂。值得关注的是,研究人员在进行结构分析后,找到了ABCG2在肿瘤细胞与正常细胞中的结构差异,肿瘤细胞中仅仅ABCG2蛋白的482位氨基酸残基发生点突变(R482G或R482T),就导致肿瘤细胞对米托蒽醌和阿霉素等化疗药物的外排增加。因此,有理由相信制备针对突变ABCG2的抗体进行免疫治疗和特异性靶向杀灭LSC是一条值得探索的途径。
MDR的逆转剂虽然已发展到第三代,进入到临床试验有7~8个,但目前已进入Ⅲ期临床试验的只有Zosuquidar,它与柔红霉素和Ara-C联合作为AML的一线治疗,最后结果尚待发表。
基于ABC系统外排泵靶标的靶向干细胞的设计应当考虑特异性,Matsui等设计抗Pgp和抗CD3双功能抗体,在体外和动物体内对耐药肿瘤细胞有特异的靶向抑制作用,提示对LSC潜在的靶向治疗作用。
治疗耐药肿瘤的微型双功能抗体(diabody)
近年来,研究较多的是抗T细胞受体及抗肿瘤细胞膜抗原的双功能抗体,这种双抗可以诱导T细胞(主要是CTL)对肿瘤靶细胞的溶解或杀灭作用。
特异性双抗能识别并连接肿瘤靶细胞和CTL,并能通过特异性触发CTL细胞表面的分子结构使CTL活化,活化的CTL释放细胞溶解颗粒,对肿瘤靶细胞产生溶解作用。这种特异性双抗能抑制T细胞的自然属性,将CTL转变为对靶细胞具有特异性杀伤作用的效应细胞。但是效应细胞必须与靶细胞通过双抗的桥接作用相连接后,才能引起靶细胞的溶解。目前资料表明,CTL介导的靶细胞溶解是通过活化的CTL的排粒作用才得以实现。效应细胞在效应细胞-靶细胞界面,T细胞受体复合物(TCR)密集区域释放细胞毒性物质,对靶细胞产生杀伤作用。
实验研究发现,着靶后的CTL能抑制裸鼠皮下肿瘤的生长。某些人T细胞亚片段不能介导效应细胞(CTL)对靶细胞的溶解,但能抑制裸鼠体内肿瘤的生长,而且通过51Cr释放试验未发现周围肿瘤细胞被溶解,说明肿瘤生长的抑制与肿瘤细胞溶解没有直接关系。
由双抗连接效应细胞表面TCR分子结构后,可以诱导T细胞分泌一种物质进入细胞介质,从而抑制肿瘤细胞的生长。进一步研究证明,这种物质是干扰素-γ(IFN-γ)及肿瘤坏死因子-α(TNF-α),它们均具有抑制细胞生长的能力。
在体内,着靶后的T细胞分泌的淋巴因子,能吸引并活化一系列其他种类的杀伤细胞,如NK细胞、巨噬细胞及中性粒细胞,它们均可作用于瘤细胞。而且,淋巴因子可以促进肿瘤细胞表面抗原决定簇的表达,例如MHC分子的表达,因此提高肿瘤细胞被自然发生的CTL所辨认,有利于对肿瘤细胞的杀伤。
双抗作为肿瘤靶向治疗有如下优越性:
- 在较低浓度下能有效地促进瘤细胞的溶解或杀伤;
- 能对抗竞争性人免疫性球蛋白IgG的抑制;
- 相对低水平的肿瘤相关抗原(TAA)表达足以诱发双抗对肿瘤细胞的溶解或杀伤;失去TAA表达的瘤细胞或不表达TAA的瘤细胞亦可为双抗所抑制或杀伤;
- 双抗所诱导释放的IFN-γ可以相互诱生并活化其他抗肿瘤的效应细胞,如CTL、NK细胞和巨噬细胞等,并可产生一系列继发作用;
- 抗T细胞受体双抗可作为丝裂原,诱导静止状态的T细胞增殖;双抗与CTL结合后可增强IL-2诱导的T细胞增殖、淋巴因子释放及T细胞毒性;
- 可用于耐药性肿瘤的治疗。
目前已应用于临床试验治疗的恶性肿瘤有乳腺癌、卵巢癌、小细胞肺癌、胰岛细胞癌和白血病等,可使患者病情减轻,生命延长。Kontermann RE构建了抗补体C1q和抗溶菌酶的diabody。体外试验证明,可富集C1q,导致溶菌酶包被的绵羊红细胞溶解。Holliger P等用抗免疫球蛋白的diabody聚集血浆中的免疫球蛋白,产生全抗体的效应因子功能,弥补了重组抗体缺乏恒定区的不足。这种diabody体外可聚集补体,引起单核吞噬细胞的呼吸暴发和溶解,并与CD8+的T淋巴细胞产生协同作用,导致大肠肉瘤细胞的裂解。Genetech公司研制的抗P185HER2/抗CD3的双功能抗体最近被美国FDA批准进入临床试验用于乳腺癌的治疗。总之,初步的研究证明,利用双功能抗体再导向效应细胞治疗肿瘤是目前很有前景的一种免疫疗法。
抗Pgp和抗CD3微型双功能抗体:白血病复发是白血病难于根治的主要原因,也是目前治疗的难题之一,而很大部分复发白血病都有Pgp高表达,除一些实体瘤的原发灶就有Pgp高表达外(内在性耐药),其他一些肿瘤(如乳腺癌、卵巢癌、淋巴瘤和头颈肿瘤等)转移灶常有Pgp高表达。因此,早期检测和消除有Pgp表达的微小残留白血病耐药细胞,以及原发灶和转移灶有Pgp高表达的肿瘤细胞,将有助于根治白血病和转移实体瘤。消除肿瘤残留和微小转移的新策略之一就是应用抗Pgp/CD3微型双功能抗体。采用抗Pgp/CD3微型双功能抗体的优点是:①特异交叉连接Pgp表达的耐药肿瘤细胞和CD3表达的T淋巴细胞,并同时激活T淋巴细胞而杀伤肿瘤细胞;②它是利用机体自身免疫机制抑制肿瘤,从而避免了使用外源非特异细胞毒物质;③国外临床试验已经证明双功能抗体之安全性,并观察到初步疗效。我们现已克隆到相应的抗Pgp单链抗体ScFv的基因和抗CD3的ScFv基因,并测序和计算机模拟三维构象,已成功构建抗Pgp/抗CD3微型双功能抗体,并在体外和体内试验证明其有效性的基础上,进一步与人的4-1BBL的胞外区结构域联合给药可治愈裸鼠耐药移植瘤K562/A02,显示抗Pgp/抗CD3微型双功能抗体的潜力,有望在将来的临床试验发挥它的潜力。
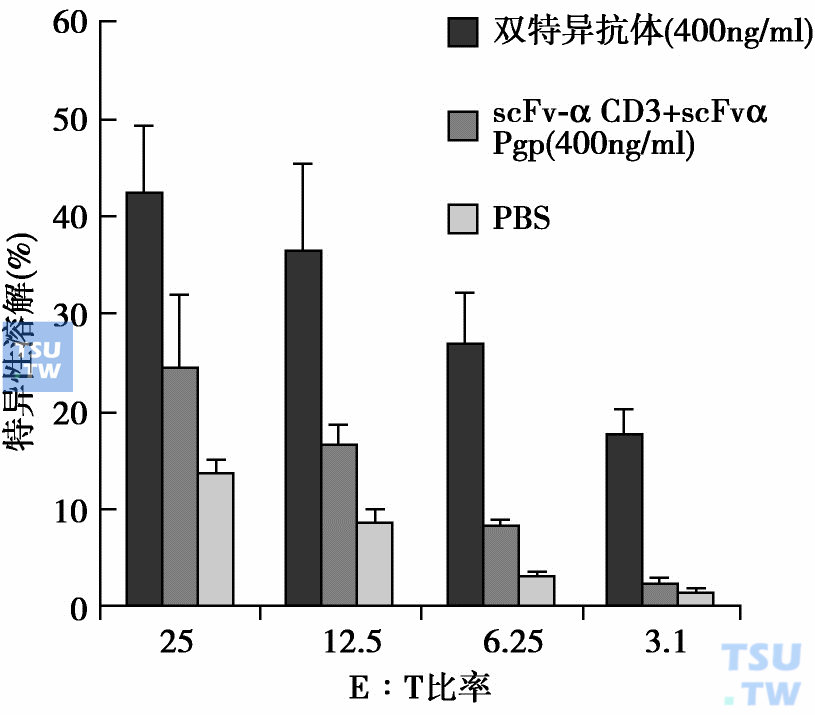
抗PGP/抗CD3双特异抗体体外介导细胞毒性T细胞对靶细胞(K562/A02)的特异性杀伤作用
小结:耐药特性和G0期蓄积导致了LSC逃避化疗药物的治疗,成为白血病难治和微小残留病灶复发的根源,针对NF-кB和CD123等特异分子的靶向LSC的治疗为我们开拓了白血病治疗的新思路,随着LSC特性及特异分子的阐明,将会为靶向LSC的治疗提供特异的靶点,最终有助于白血病的彻底治愈。
对裸鼠耐药移植瘤和敏感移植瘤进行治疗时,各治疗组的平均生存时间
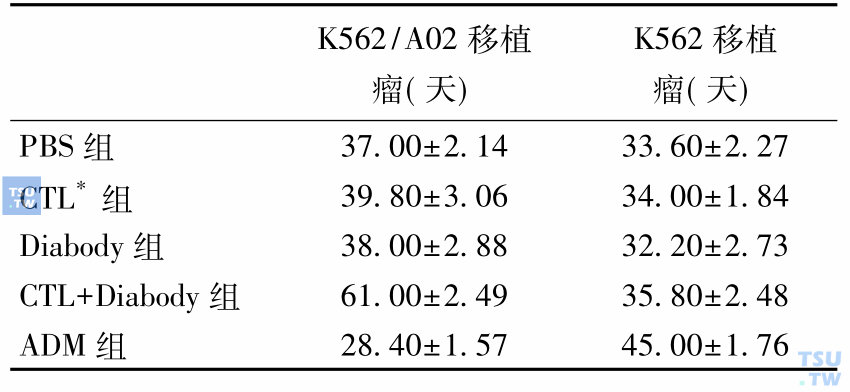
虽然LSC研究取得明显的进展,但仍然有不少问题有待解答:
什么是LSC的真正(生物学的)的标记?
什么基因/信号途径使LSC具有自我更新的能力?HSC和LSC自我更新机制之间的差别?
是什么使LSC对传统化疗产生耐药以及如何特异性逆转耐药?
微环境对LSC的影响?
这些都是未来有待解决的重要问题。
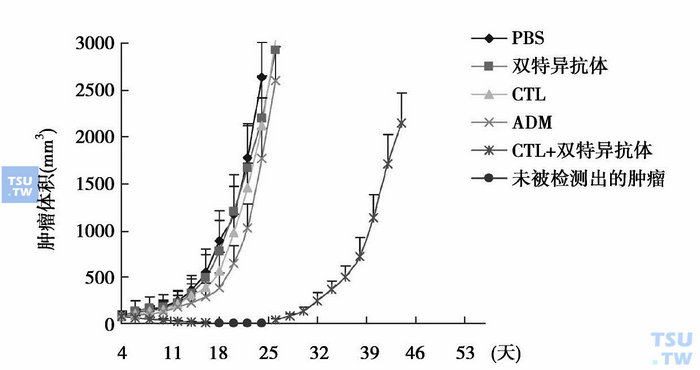
对裸鼠敏感移植瘤的治疗
(杨纯正)
