淋巴结
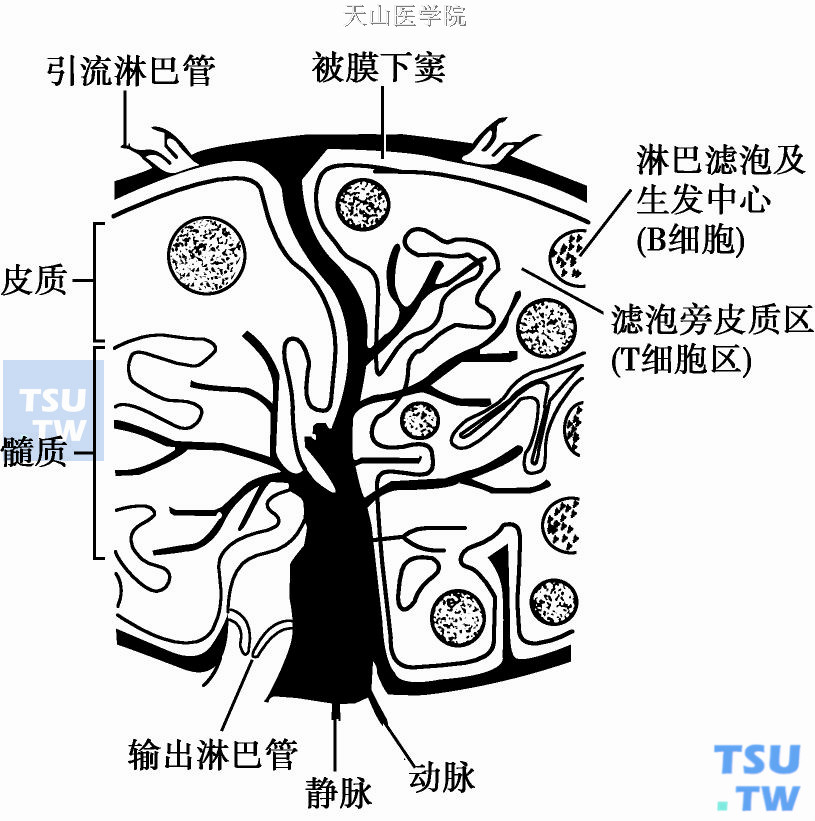
淋巴结(lymph nodes,LN)为卵圆形,大小数毫米或超过1cm不等。在腹膜后腔,纵隔以及沿血管广泛分布。淋巴结被纤维样被膜所包绕,被膜伸出小梁穿过实质形成一个纤维状支撑网。血管通过淋巴结的脐部进出淋巴结。从组织学上可以将淋巴结分为2个区域:外周皮质区和中央髓质区。皮质区又可分为表皮皮质区,位于被膜下,深层皮质区或称为副皮质区,位于接近淋巴结中心的区域。淋巴结的组成成分为网状组织和细胞成)。
淋巴结网状组织
淋巴结网状组织组成了淋巴结的基本结构,组织中一束束胶原纤维和弹性纤维组成小梁。银染时为嗜银性,紧密编织在一起呈海绵样网状结构。纤维有较多分支,相互吻合。纤维伸入到致密的淋巴组织内,并围绕在淋巴窦周围。纤维样网状组织和致密淋巴组织覆盖一种细长型的纤维母细胞。这种细胞的细胞核和内质网较大。胞质的突起与邻近细胞的胞质突起相连,形成细胞鞘(细胞网状组织),细胞鞘将纤维样网状组织与致密淋巴组织分开。在淋巴窦边缘的一侧,纤维覆盖着含有很多空泡的脂肪细胞。在淋巴窦内膜排列着内皮细胞。内皮细胞无基底膜。有时纤维穿插入淋巴窦后被内皮细胞覆盖,形成小梁。内皮细胞将窦腔分为相互连接的小室。小梁不仅为淋巴窦提供机械性支撑,而且减慢了淋巴液的流动,为黏附在淋巴窦壁上的巨噬细胞增加了吞噬的机会。淋巴窦起源于被膜下窦内壁,被膜下窦是淋巴液的输入终点。被膜下窦外壁由淋巴结的被膜组成。淋巴窦沿着纤维小梁穿过淋巴结实质。总之,网状组织将淋巴结分为两个不同空间。一个是由通常的血管通路即淋巴窦组成,细胞成分很少而且流动很快,是淋巴细胞的通路。另外一个血管间隙,内面衬有紧密排列的细胞,液体流动较慢。细胞在这里相互接触发生免疫反应。这两个空间通过被膜下窦的内壁上的小孔而相互交流。
淋巴结的组织结构
细胞成分
淋巴结内最多的细胞成分是淋巴细胞。淋巴细胞在被膜下的皮质区内成簇排列,形成滤泡。原始滤泡由大小均匀的小淋巴细胞组成;继发性滤泡含有染色较明亮的原始细胞样细胞,细胞核常染色质多。继发性滤泡的中心区域为生发中心(germinal center,GC),GC是受过抗原刺激的标志。继发性滤泡中的淋巴细胞围绕GC构成壳膜,或称新月体。在滤泡之间的区域,淋巴细胞呈弥散性分布(弥散皮质)。连接皮质区与髓质区之间的部位是深层皮质或称副皮质,此处的淋巴细胞紧密排列。
淋巴结内淋巴细胞的组织学分布与细胞的功能有关。B细胞占据滤泡,为体液(抗体)免疫过程提供强烈反应的场所。GC中有两种淋巴细胞:一种是中心母细胞(非卵裂细胞)较大,是激活的B淋巴细胞;另一种是中心细胞(卵裂细胞),个较小,由中心母细胞分化而来。中心母细胞位于GC的暗区(dark zone),而中心细胞位于根尖区(apical zone)。中心母细胞中有一个亚群,表型特征与伯基特细胞类似。生发中心还含有一小群2型T辅助细胞Th2(表型是CD4+、CD45RO+、CD57+)。这些T细胞在启动T、B细胞相互作用而生成抗体的过程中是非常重要的。未被选择为抗体生成细胞或记忆细胞的会大量发生凋亡,最终死亡,被巨噬细胞样的吞噬性细胞处理掉。
滤泡的壳膜由小淋巴细胞组成,在形态上是一致的,但功能和表型分属不同的细胞群。其中一小部分细胞来自骨髓的小淋巴细胞,尚未受到过抗原刺激,但是有免疫活性,表达IgM和IgD;绝大多数细胞是可以经历再循环的、不同于前者的细胞群,可与T细胞非依赖性抗原发生反应。第3种细胞群是记忆B细胞,它们为长寿命的再循环细胞,表达IgM 或IgD。有些淋巴细胞还表达CD5+。
副皮质层和弥散皮质构成了T细胞区,在细胞免疫中会发生组织学改变。免疫反应后会在副皮质层内形成由树突细胞和T细胞交织一起的小结。髓质中细胞排列成索状,含有淋巴细胞、巨噬细胞和浆细胞。
淋巴细胞可以与其他细胞相互作用,其中巨噬细胞最重要。在淋巴窦壁和致密淋巴区域有大量巨噬细胞。它们吞噬外源物质,并且快速离开。注射外源物质后数分钟内,髓质吞噬细胞即出现吞噬溶酶体。淋巴结吞噬细胞吞噬外源物质后,提呈抗原给T淋巴细胞。抗原提呈者主要是树突状细胞,其他非吞噬细胞也可以提呈抗原。淋巴滤泡中有滤泡树突细胞(follicular dentritic cells,FDC),细胞核不规则,胞质有颗粒状物质,胞质突起较长(树突)。它们不是吞噬细胞,可以较长时间保留抗原。FDC在抗原提呈中可能主要负责滤泡中B细胞的分化,也与记忆细胞的增殖和持续产生抗体有关。FDC有两种形式,分别具有丝状和珠状树突。FDC通过一些黏附分子如ICAM- 1(CD54)和VCAM- 1 (CD106)分别与B淋巴细胞表面的配体LFA- 1(CD11a/CD18或α1β2整合蛋白)和VLA4相互作用,与B淋巴细胞发生反应。血管性免疫母细胞淋巴结病、获得性免疫缺陷综合征和霍奇金淋巴瘤等能够破坏FDC的工作系统。
另外一种基质细胞称为并指状树突细胞(interdigitating dendritic cell,IDC)。它位于副皮质区,并指状树突细胞能伸出巨大的胞质突起环绕T细胞。IDC不是吞噬细胞,提供淋巴结内副皮质层中T细胞的选择性位置。应用电子显微镜可以观察到并指状树突细胞与T细胞之间紧密连结,经过强烈抗原刺激激发细胞免疫后更明显。它们的胞质发亮,会有溶酶体样颗粒和小管状结构伸向细胞的周边。IDC为S- 100+和CD1a+。副皮质T细胞小结内的T细胞(主要是CD4+的T细胞)与大量的IDC细胞和内皮样微静脉组合在一起,以丛的形式存在,与体外由T细胞和抗原提呈细胞所组成的结构类似。因此它们对抗原特异性T淋巴细胞的增殖是非常重要的。在B细胞滤泡形成“复合小结”的旁边可以检测到T细胞小结。在皮病性淋巴结炎可看到典型的T细胞小结,其中充满从感染皮肤处迁移而来的大量朗格汉斯细胞。同样的改变也可见于皮肤浸润的T细胞淋巴瘤的局部淋巴结引流区。
微管结构
1)淋巴管:淋巴液通过引流淋巴管进入皮质下淋巴窦。皮质淋巴窦起源于被膜下窦,沿小梁走向穿过皮质到髓质而形成髓窦。最终淋巴窦形成输出淋巴管,在淋巴结脐部离开淋巴结。
2)血管:动脉在淋巴结脐部进入淋巴结,形成微动脉沿小梁到皮质,最终分支形成丰富的毛细血管网。毛细血管从皮质延伸进入髓索而成为微静脉,然后静脉从脐部伸出。多数与毛细血管相连接的微静脉有独特的高而类似长方形的内皮样细胞,与衬在其他所有微静脉的低而扁平的内皮细胞正好相反。高内皮细胞微静脉(high endothelial venules,HEV)是淋巴细胞从血循环迁移至淋巴循环的起点。高内皮细胞胞质丰富,网眼状表面覆盖一层由丝状物和颗粒组成的外壳,可能起着从淋巴细胞到HEV壁传导信号的作用。在电子显微镜下,基于多聚核糖体含量的多少,可以分为两种细胞类型:一种亮细胞和一种暗细胞,暗细胞嗜派洛宁性较强。
胞质含有大量微管,微管从中心体发出,呈放射状。胞质致密小体多,可能与溶酶体有关。高内皮细胞的形态学特征是有含无数大囊泡的高尔基体,通常认为这一特点属于激活的分泌细胞而不是内皮细胞。高内皮细胞大,细胞核含有发育良好的网状核仁。这些细胞有高度代谢活性,可以检测到酸水解酶活性和不出现在其他内皮细胞的非特异性脂酶,同时具有厌氧代谢的特殊能力。循环T细胞的数量可以影响高内皮细胞的代谢活性。胸腺切除及慢性胸导管引流的新生小鼠及大鼠可以导致内皮腔萎缩,高内皮细胞嗜派洛宁性的丢失,淋巴细胞通过HEV壁迁移减少。给这些动物输注淋巴细胞可以重新组成正常形态的HEV。先天性无胸腺(裸)小鼠和大鼠中的HEV的内皮腔是萎缩的。
免疫反应时的形态学变化
抗原通过淋巴管进入淋巴结,到达被膜下窦,然后穿过淋巴结实质,在窦内过滤,最终抗原出现在髓质区巨噬细胞的溶酶体中,皮质区的抗原出现在FDC膜上。在体液免疫过程中,免疫后的1~2天,在滤泡的中心可以观察到较高的增殖活性。在72小时,引流区淋巴结的生发中心内可见大量的嗜派洛宁细胞。这些细胞有不同的名称,如Dameshek最早描述这种细胞时称其为免疫母细胞。它们还被叫做胚细胞(germinoblast),血液学者和病理学者为了与生殖巢的细胞区别,称其为中心母细胞(centroblast)。这种未成熟细胞的体积较大(大于10μm),具有一个松散染色质的细胞核和一个巨大的网状核仁,核仁甚至可以占据细胞核的一半。高尔基体中度发育,含有较多游离的多聚核糖体,但是胞质内质网很少。这些细胞进一步发育,当胞质内质网越来越丰富时,就成了原始浆细胞。此时细胞核出现较多的异染色质,核仁中等大小。游离多聚核糖体还存在,但胞质内质网不再充填整个胞质。
免疫后第5天时,巨噬细胞的数量明显增加,使生发中心出现点缀的巨噬细胞,称为星空状。巨噬细胞内有一些可染色的小体,是已经吞噬的淋巴细胞和浆细胞的碎片。由于免疫母细胞或中心母细胞胞质具有较强的嗜碱性,淋巴结生发中心区域可出现一个暗区(也称为基底或底部区)。这些细胞成熟时(成为免疫细胞,中心细胞),会迁移到亮区(也称为上部区域)。中心细胞起源于中心母细胞,激活后细胞的分布不再限于生发中心。生发中心的原始细胞起源于B淋巴细胞已经基本没有疑问,但是它们缺乏细胞膜表面的IgD。T细胞也与生发中心的形成有关。生发中心有少量的浆细胞。生发中心是浆细胞的起源地,出现在免疫后第3或4天的髓索中。另外,它还会形成记忆细胞。在副皮质区可观察到刺激细胞免疫的抗原增殖活性增加,嗜派洛宁细胞增加等,它们均是T细胞依赖性的。
功能
淋巴结是一个动力机构,细胞在其中持续地运动。淋巴结的功能可以分为两大部分。作为一个有效的机械性过滤器,淋巴结含有精确排列的吞噬细胞、网状结构和淋巴窦。如果滤过功能不能阻止感染源,淋巴结将会成为疾病播散的新地点。
免疫功能依赖于淋巴细胞与其他细胞的相互作用。淋巴结提供了适合的微环境,包括淋巴细胞在其中迁移和再循环的HEV;引导淋巴细胞到不同区域的基质细胞。副皮质区的IDC可吸引T淋巴细胞和滤泡中的FDC,都可与细胞相互作用,还可以捕获抗原,提呈给淋巴细胞发生免疫反应。因此,淋巴结是产生抗体和T细胞介导的免疫反应的重要场所,抗体产生细胞和激活的T细胞均从淋巴结输出,游离到远端控制感染和其他外源物侵入。
脾脏
尽管脾脏是外周淋巴器官,它还是有一些与免疫系统无关的功能。脾脏对血细胞的整个生命周期均有影响。它为网织细胞、血小板和单核细胞提供了终末分化的微环境;它可去除衰老和畸形的红细胞;它还可储存红系和粒系的细胞。
结构
脾脏外覆盖着几毫米厚的被膜组织。被膜的内面是广泛分布成网状的小梁结构的起点,小梁将脾脏划分为相连的直径约为几毫米的小室。脾脏的形状似勺形,实质结构称髓质组织。人类脾脏仅含有少数肌细胞,因此不具有收缩功能。
被膜在脾脏的中部集中成一束,内含有血管、淋巴管和进出脾脏的神经。在苏木素和伊红染色的脾脏组织切片上,可以看见两种脾脏组织:一种为黑色或紫色以小淋巴细胞为主的白髓,另一种为红色以血液填充的窦状结构为主的红髓。
一、白髓
白髓是脾脏的主要组织。脾脏动脉分支后进入小梁动脉并且沿小梁走向,分出各级分支,离开小梁。因为它们位于白髓的中心,称为中心动脉。中心动脉通过收缩和舒张来改变血流,属于平滑肌动脉。白髓内含有支撑作用的网状组织、游离细胞和血管。中心动脉分出次级分支,通过白髓呈放射状向不同方向分布,有些血管终止于白髓边缘,有些继续向前行,终止于边缘区域,有些甚至进一步延伸到红髓。人类脾脏中有些分支从红髓弯曲回来围绕白髓边缘的淋巴滤泡,形成紧密分布的网状血管。
白髓主要的细胞是淋巴细胞,它们位于网状组织的间隙,形成两个组织学不同的分布。紧紧围绕中心动脉的淋巴细胞沿中心动脉分布,呈圆筒状,当动脉分支为小动脉后,圆筒逐渐变薄。这种弥散聚集的淋巴细胞称为动脉周围淋巴壳(periarteriolar lymphatic sheath,PALS)。PALS分为中心区域和边缘区域。中心区域紧紧围绕动脉,由紧密排列的T细胞组成。此区域相当于淋巴结的T细胞依赖区(副皮质区),常见并指状树突细胞。T淋巴细胞与并指状树突细胞紧密连接。PALS的边缘区并指状树突细胞较少,但含有B和T两种淋巴细胞。此区域可见淋巴细胞以滤泡形式聚集,其中有些中心部位含有形成生发中心(继发滤泡)的原始细胞。围绕生发中心的小淋巴细胞形成套膜分隔生发中心和边缘区域。与淋巴结内的生发中心一样,这些生发中心从组织学上也可分为暗(dark)区,含有大量的具有有丝分裂活性的嗜派洛宁性的原始细胞,以及含有更多成熟细胞的亮(light)区。边缘区域的亮区有丰富的FDC。细胞体积大,含有不寻常形状的细胞核,缺乏异染色质,胞质伸展形成薄被单状而非树突状。FDC不是巨噬细胞,但可将外源物质长时间保留在膜上。动物免疫后,FDC数量增加。PALS的中心部位无FDC。它们出现在面向边缘区域结节的套膜中,位于可以捕获进入脾脏的外源物质的位置。抗原首先滞留于边缘区域,然后穿过边缘窦,寄宿在结节的套膜,形成新月形帽状结构。PALS边缘区域的结节构成脾脏的B细胞依赖区。外周淋巴器官内T、B两个最大的淋巴细胞群分离定居,似乎是由于它们具有不同功能的天性所决定的。
二、边缘区
边缘区是白髓和红髓间的副皮质的一部分。脾脏的这一部分非常重要,因为有大量的循环血液。许多动脉血管在此终止,其中一部分漏斗形状的血管口将血流引向边缘区。边缘窦相当于毛细血管后静脉,淋巴细胞在此处进入脾脏的副皮质。进入边缘窦的淋巴细胞有许多微绒毛,使淋巴细胞可以与网状细胞接触,以便移动到适合它们的微环境处。这些淋巴细胞一旦到达目的地,微绒毛就消失。然而脾边缘窦没有类似淋巴结内指示方向的高内皮细胞。有些人认为这种功能是通过位于脾边缘窦内的巨噬细胞完成。脾脏这些巨噬细胞具有发现淋巴细胞的能力,有独特的吞噬细胞特性和形态学特征。由于边缘区最先接触动脉循环中的血流,因此很容易理解为什么抗原滞留于此处。血细胞在脾脏内的行程也是开始于边缘区。
三、红髓
红髓由红色的窦腔和髓索组成。在组织切片上,髓索的成分是网状纤维和细胞组成网眼状结构。网状细胞较大,膜突起伸出一直到达间隙,与相邻细胞连接形成海绵状结构。大的网状细胞具有微丝,使细胞有收缩和伸展的功能,从而占据一定的空间并且可以调节血流。这些索样结构直接从动脉吸收血液。中心动脉分出许多分支,纤细垂直地插入红髓髓索中。其中一些动脉分支为动脉毛细血管,被吞噬细胞鞘包裹。这些鞘膜曾被称为椭圆体,目前称为周边动脉巨噬细胞鞘。是吞噬细胞的最大的来源地。周边动脉巨噬细胞鞘还可调节血流。髓索中可以形成血细胞,驱除衰老和破损红细胞。红髓窦腔的直径约为35~40μm,是一种弯曲的血管腔,内衬着内皮细胞,形状为长锥形。内皮细胞有吞噬性囊泡,松散分布的胞质微丝及紧密排列的丝状体,这三个形态学特点使细胞具有一定的硬度和收缩性。血细胞从内皮细胞裂隙侵入内腔。这些裂隙的宽度小于0. 2~0. 5μm。内皮细胞内的丝状体沿裂隙平行走向,从而限制其打开的程度。正常的白细胞变形后可以通过这些裂隙,但是如果某些细胞内有坚硬的包涵物,如海因茨小体(Heinz body)、异染粒等,则在通过时会受到阻碍。基底膜往往不连续,由网状纤维构成网眼状结构。盘绕的纤维(环状纤维)较粗,与纵向的较细的纤维连接。通过这个网状结构的膜孔,血细胞可从髓索穿过到窦腔。外膜网状细胞从髓索一侧部分覆盖着髓窦。它们通过遮盖或打开内皮细胞间隙而调节血流。
脾脏循环途径一直是争论的主题。一些研究者认为循环是闭合的,从动脉流到窦腔和静脉。另外有人认为循环是开放的,即动脉引流血液到边缘区和红髓髓索,血液通过髓索的腔隙渗滤,最后穿过窦壁到内皮间隙。根据这种观点,循环途径在解剖学上是开放的,但功能上是闭合的。虽然这些问题尚未解决,但是,似乎两种形式均存在。支持这一观点的是发现大量的血液通过脾脏的速度与通过其他器官的速度一样快,而小量的血液保持相当慢的速度。
免疫反应中的形态学改变
抗原刺激后的24小时,红髓开始有多形核白细胞的聚集。3~4天后在PALS可见大的嗜派洛宁原始淋巴细胞,当它们成熟为浆细胞之后,迁移到周边区,最终到达红髓,在窦腔内也有发现。在第1周末生发中心就充分发育了。电子显微镜下,不成熟淋巴细胞有较大的细胞核,明显的核仁,核糖体明显增加,但是无胞质内质网。这些原始细胞即为免疫母细胞。当它们发育后,出现大量的胞质内质网,即为浆母细胞。成熟的下一个阶段是幼稚浆细胞,此时有丰富的胞质内质网和一些残留的游离核糖体,最后分化为成熟浆细胞。
脾脏的免疫学意义
脾脏有两个重要免疫功能,吞噬功能和产生体液及细胞免疫反应。脾脏的迷路结构有益于迁居到网状组织间隙的吞噬细胞有效地清除入侵的微生物,而抗原抗体复合物、抗体或二者对细菌的包裹可促进吞噬作用。虽然对脾脏的吞噬功能已有充分的认识,但它在人类的体液及细胞免疫中的作用还存在相当的争议。早期有报道,先天性溶血性贫血切除脾脏的儿童发生强烈的致命性感染的机会增加。然而此后不是所有的研究均与之相同。血液病切除脾脏者比外伤后脾脏切除的后果更严重。于实验动物中知道脾脏对体液免疫反应很重要。人类失去脾脏会损害到免疫系统和形成抗体的能力。在脾脏切除后的患者,甚至会损害末梢血淋巴细胞的抗体合成功能。
