人体血液接触足量的组织因子,引起凝血系的激活,是DIC最常见的促发途径,循环中形成纤维蛋白,凝血和纤溶异常是DIC最基本的病理改变。
DIC的发病机制
凝血作用可有两种启动机制:由于血管系统内皮细胞层破裂,血液与内皮下组织及胶原接触,产生相互作用,激活内源凝血系。或者由于储存在多数细胞内的组织因子,在细胞破裂时被释放,进入血流,并激活外源性(组织因子途径)凝血系。外源性TF驱动系统是止血的主要驱动力。若驱动力是持久的或足够地延长,从而使促凝力量得以继续,则凝血的阶梯反应将最终生成凝血酶。但是,在这凝血的阶梯活化中的每一步,都必须克服多种生理性障碍(抑制物)。这些阶梯式凝血反应很可能被潜在地灭活。例如,激活的丝氨酸蛋白酶(FⅪa、Ⅹa、Ⅸa、Ⅶa和Ⅱa)可以被抗凝血酶Ⅲ(antithrombinⅢ,ATⅢ)灭活,活化的辅因子(FⅤa和FⅧa)被蛋白C系统降解,最终生成的凝血酶必须继续逃脱内皮结合的凝血酶调节蛋白(thrombomodulin,TM)。凝血酶最终才能使纤维蛋白原转化成纤维蛋白。DIC的驱动系统常是一种联合的、非生理的、以及持续的过度启动以致过度生成的凝血酶掩没生理性抑制物,引起循环中游离的、无对手的凝血酶和纤溶酶。
发病机制分三类:
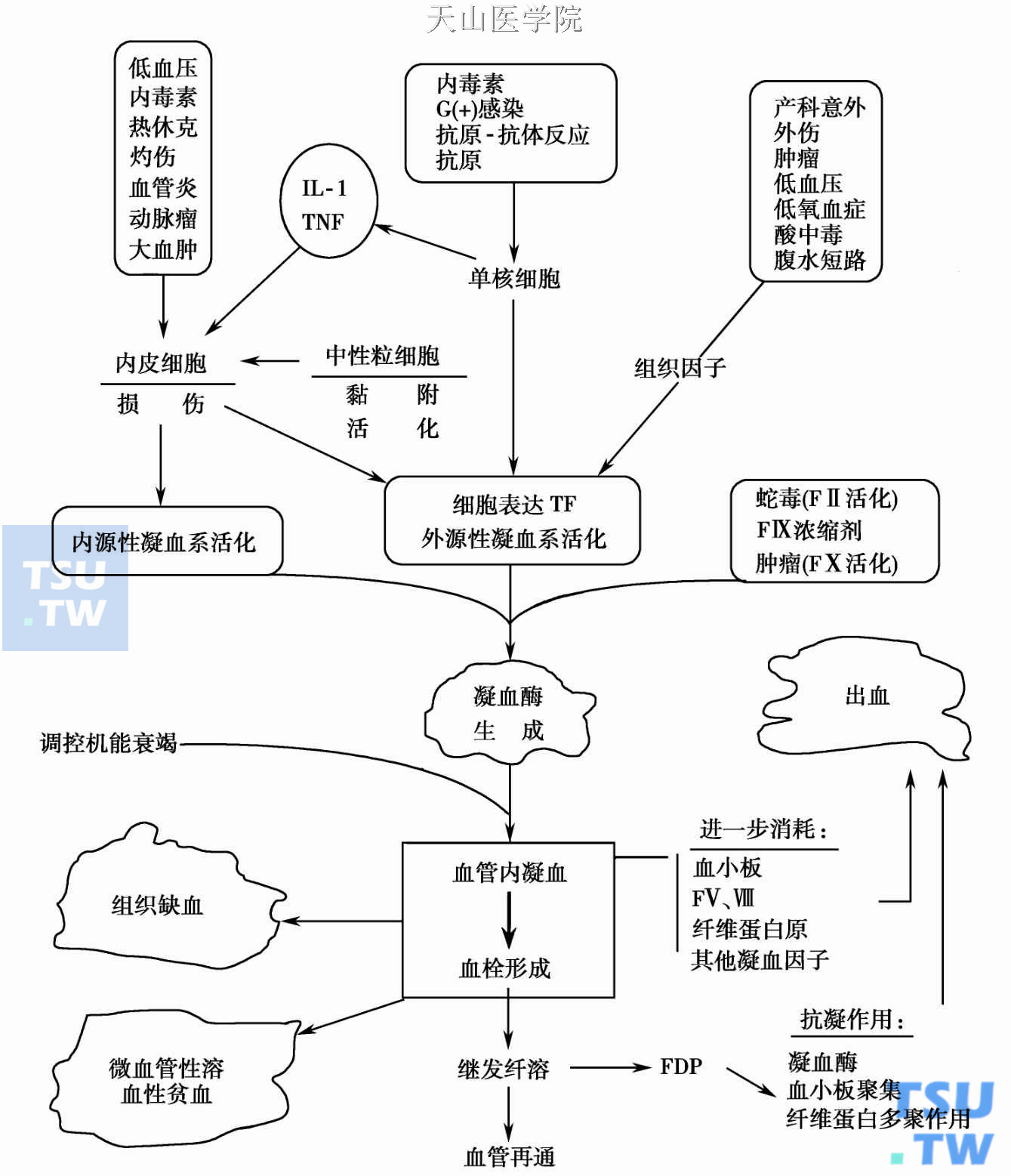
DIC的病因及诱发机制
促凝物质进入血液
大量外源或病理性促凝物进入血流激活凝血系统,如蛇毒、多发创伤、颅脑损伤后的脑组织、产科并发症时的子宫内容物、前列腺手术后的前列腺组织、急性早幼粒白血病的早幼粒细胞颗粒、急性血管内溶血、某些分泌黏蛋白的腺瘤,都具TF活性。肿瘤尚可衍生FⅩ活化物而直接激活FⅩ,促发凝血过程。
白细胞的活化
内毒素攻击的兔白细胞表达TF,经采集后注入正常兔腹腔,则受体动物肺及肾脏都有血管内凝血及纤维蛋白沉着,由此可见,白细胞(主要是单核细胞)生成并释放的TF在内毒素诱发的血管内凝血中起着主要作用。此外,受内毒素攻击的单核细胞、内皮细胞释放的一种多肽,名为肿瘤坏死因子(tumor necrosis factor,TNF)参与DIC时的血块形成机制。体外培养的内皮细胞在内毒素、白细胞介素-1(Interleukin- 1,IL- 1)及TNF作用下,能很快增加组织因子的活性,并降低TM的表达,从而促进血管内凝血。内毒素可损伤血小板、促进血小板第三因子(PF3)作用于凝血,这也是内毒素诱发DIC的基本(但并非主要)原理之一。实验性血小板减少并不能防止血中出现可溶性纤维蛋白。
血管内皮抗凝功能受损及表达TF
内毒素攻击的内皮细胞除可合成与表达TF外,还可减少组织型纤溶酶原激活物(tissue plasminogen activator,tPA)生成,增加纤溶酶原激活剂抑制物(plasminogen activator inhibitor)PAI- 1释放,从而消灭或削弱受损内皮本身的促纤溶功能,并通过下调TM,使内皮抑制血液凝固的作用也减弱。同时,TNF会同由单核/巨噬细胞分泌的IL- L、IL-6,白细胞生成的白三烯(leukotriene B4,LB4)、血小板活化因子(platelet activating factor,PAF)以及由补体活化生成的C5a等促使内皮表达黏附分子受体(CD11/CD18),从而促使多核白细胞(polymorphonuclear leukocyte,PMNs)、巨噬细胞和内皮细胞相互黏附,内皮进一步受损并活化。此外,粒细胞活化后生成氧化介质(H2O2,HOCL)能削除α1抗胰蛋白酶活性,为PMNs分泌的弹性蛋白酶攻击内皮细胞间质开辟渠道。FⅫ受内毒素直接攻击或被受损血管所活化。FⅫa使前激肽释放酶转化成激肽释放酶,后者将增强PMNs的有害的作用。从高分子激肽原(high- molecular- weight kininogen,HK)释出的激肽可引起血管扩张和低血压。T细胞则能增强单核细胞表达TF。上述一系列细胞间及细胞基质间的相互作用,使内毒素攻击下的机体诱生凝血酶,并促进继发纤溶过程。
DIC的病理生理过程
血管内凝血
血管内皮损伤、组织损伤、肿瘤坏死、外来化学物质进入血流,致凝血因子活化等都可诱发广泛、散在的微血管内凝血。由于纤维蛋白被网状内皮细胞吞噬或局部纤溶,仅在少数情况下尸解时可发现血栓。休克时血流缓慢、低氧血症和酸中毒更易引起血栓,使DIC与多器官功能衰竭互为因果。但休克和低氧血症可能只引起某些器官功能衰竭而缺乏DIC临床和实验室改变,故DIC前状态的早期诊断及治疗是目前研究的热点之一。
血管内继发纤溶
1)tPA-抑制复合物水平增加:血管内皮或单核细胞受血栓刺激释放tPA,后者使纤溶酶原转化为纤溶酶。DIC时血浆tPA抗原量增加,但功能测定并不能显示tPA活性增加。这是因为血浆中tPA可被特异抑制物(主要为PAI- 1)所中和。血浆中能测到tPA-抑制复合物,如tPA- PAI- 1、tPA-α2巨球蛋白,tPA- C1抑制复合物水平增加,同时血浆纤溶酶原水平因消耗而明显下降。
2)FDPs、D-二聚体实验阳性:正如本文所述,血浆内纤维蛋白单体可以与FDPs(包括来自纤维蛋白原的FDP和来自纤维蛋白的fdp)结合而形成可溶性复合物。在该复合物中可溶性纤维蛋白单体,不能被FXⅢa多聚,因此纤维蛋白形成是不完全的。然而,在发生感染时,白细胞或其他细胞被内毒素或炎症细胞因子所激活,释放出蛋白酶,从而水解纤维蛋白。这些蛋白酶不仅能水解小血管内血栓,也能水解纤维蛋白单体复合物。处于游离状态的可溶性纤维蛋白单体,不论在蛋白酶水解作用之前或之后,都能与被凝血酶活化的纤维蛋白稳定因子即FXⅢa共价交联而形成稳定的纤维蛋白。
在FXⅢa作用下,fdp之间交叉联结的一种特殊片段即D-二聚体(D- Dimer)。应用免疫学方法测定血浆内D-二聚体片段,能够反映纤维蛋白的交联及纤溶酶作用下的溶解,但不能鉴别这种特殊片段究竟源于血管内抑或血管外。事实上只有血管内发生纤维蛋白沉着和溶解才能证实DIC的存在。换言之,D-二聚体实验阳性不足以诊断DIC。此外,应用纤维蛋白(原)相关抗原FRA(fibrinogen- fibrin related antigens)测定法(又名FDPs测定法)可测出血清内FDP/fdp及其与纤维蛋白单体结成的可溶性复合物。不言而喻,这一测定法具有同样的局限性,现举肺炎为例,以资说明:肺实质内可以发生纤维蛋白沉着及溶解,溶解后的小片段如FDP/fdp,D-二聚体等可以由肺实质透入血管内致使检测呈阳性结果。实际上,血管内并没有发生纤维蛋白沉着或溶解,DIC应予排除。
DIC患者血浆之所以能抑制纤维蛋白的生成,很可能是因为纤维蛋白及纤维蛋白原的降解产物阻遏凝血酶的作用,尤其是阻断纤维蛋白的聚合过程。
3)血小板PAI- 1减少致纤溶酶活化加速:DIC时血小板减少,使血小板释放的PAI- 1减少,故纤溶酶原活化加速。此外,凝血活化过程中生成的FⅩa、FⅫa等碎片也可以激活纤溶酶原,生成的纤溶酶是一种强力的丝氨酸蛋白酶原,可消化纤维蛋白原及纤维蛋白形成相应降解产物FDPs(包括FDP/fdp)。FDPs具抗凝性及抗血小板聚集功能,将加重出血倾向。
4)内毒素能直接使FⅫ活化,使局部释出激肽释放酶,继之增加纤溶酶活性并自高分子激肽原(HK)释出缓激肽(bradykinin,BK)能增加血管通透性并舒张血管,产生低血压。
凝血因子消耗
在发生DIC情况下,与纤维蛋白原消耗的同时,许多凝血因子活性水平(基于凝血测定法)可以下降。这些凝血因子包括Ⅱ、Ⅶ、Ⅹ、Ⅴ、Ⅷ、Ⅻ、前激肽释放酶(prekallikarein,PK)、HK及蛋白C(PC)、蛋白S(PS)等,其中某些凝血因子可能在凝血酶生成与活化过程中被消耗。在DIC患者血浆中可测到从凝血酶原分子或者从PC分裂出来的片段(前者名F1+2肽,后者名蛋白C活化肽PCP),便是直接的佐证,此外,由于FⅫ介导前激肽释放酶(PK)转化成激肽释放酶,血浆激肽释放酶可以向局部组织释放,因而加强纤维蛋白溶解。HK可释放出BK致血管通透性增加,血管扩张,导致低血压发生,纤溶酶或活化蛋白C(activated protein C,APC)等又可使FⅧa及Ⅴa灭活,使FⅧa、Ⅴa水平下降,并且FⅧ:C水平明显低于vWF:Ag,反映FⅧc消耗。至于PS可以与C4b结合蛋白相结合;而纤维连接蛋白(fibronectin,FN)可以与纤维蛋白原及纤维蛋白相结合,结果使血浆FN水平下降。血浆中尚可测到各种凝血抑制物如APC、组织因子途径抑制物(tissue factor pathway inhibitor,TFPI)和α2抗纤溶酶,在DIC中与各自底物相结合。
DIC时血小板减少症较为常见。血小板减少的原因:①形成血栓过程中被消耗;②血小板被凝血酶聚集继而从血流中被清除;③在内皮损伤部位,血小板黏附并聚集。上述情况使血小板受损伤并释放出磷脂(phospholipids,PF3)及β-血小板球蛋白(βthromboglobulin,β- TG)因而促进凝血过程。另一方面,使血小板减少释出PAI- 1而增强纤溶,加重出血倾向。由此可见促凝血活性与促纤溶活性并存,使急性DIC的临床表现具有明显的特征,即在血栓性血管阻塞的同时患者可以出血。单纯血小板减少症不足以诊断DIC。然而,DIC时各种凝血因子的消耗并不相等。DIC的后果常取决于DIC的程度、诱发速率、凝血酶与纤溶活性等因素之间的平衡和相互影响。急性DIC,如子宫破裂,短期内大量TF进入血流,以致防护功能无充足时间产生反应,纤维蛋白原、凝血酶、FⅤ、Ⅷ、XⅢ严重消耗,其中FⅤ、Ⅷ作为辅助因子几乎完全被耗竭。凝血酶原在转化成凝血酶后,被ATⅢ中和及清除,故消耗也增多,使凝血酶原时间(PT)延长。DIC早期PT、APTT缩短,某些作者认为是与凝血抑制物减少有关。如果蛇咬伤而引起DIC,则蛇毒液直接使纤维蛋白原转化为纤维蛋白,故一般不发生其他凝血因子的改变,血小板数可不下降,某些情况下可只发生原发性纤溶。
红细胞形态学改变
半数DIC患者红细胞形态学发生明显的改变,呈碎片状。红细胞自血块或网状病灶过滤,被纤维蛋白劈开、膜被撕裂而发生溶血,故称之为微血管型溶血性贫血。反之,没有红细胞形态学改变,决不能除外DIC。
内皮素或其他介质水平
DIC时血浆内皮素- 1(endothelin- 1)水平可以升高。内皮素- 1是强烈的血管收缩剂,由受损的内皮细胞释放,可以参与诱发多器官功能衰竭。其他生物活性肽如TNFα、IL-1β等在某些DIC患者中可见血浆水平升高。根据新的概念,DIC被视为多器官功能障碍综合征的一个组成部分。
