抗凝血酶Ⅲ(ATⅢ)是维持机体止血平衡的天然抗凝物,能中和被激活的凝血因子如凝血酶、FⅨa、Ⅹa、Ⅺa、Ⅻa,并形成稳定的复合物,从而抑制凝血酶活性的70%。
ATⅢ是一种由肝脏合成的单链糖蛋白,分子量为58 200,电泳中位于α2-球蛋白,由432个氨基酸组成。基于结构及蛋白酶抑制机制方面的相似性,ATⅢ属丝氨酸蛋白酶抑制物(serpins)家族。ATⅢ分子中6个半胱氨酸间形成3个二硫键,并含4个糖基化位点与其糖类侧链相连。ATⅢ活化中心位于羧基端的精氨酸(Arg393),肽键的CONH与凝血酶等丝氨酸酶活化中心的羟基以共价键1:1形成复合物,反应键作为酶的底物被裂解,使ATⅢ构型改变,酶进一步陷入而失活。无肝素存在时,ATⅢ抑制凝血酶或FⅩa的过程很慢,半衰期0. 5~1. 5分钟。
肝素链的戊糖序列中几个硫酸基团与ATⅢ赖氨酸区结合成复合物。构型改变的ATⅢ精氨酸更易与丝氨酸蛋白酶活化中心结合,使中和速率增加1000倍以上,血浆凝血酶半衰期缩短至10ms。故肝素及血管内膜表面的内源性类肝素物质,通过增强ATⅢ活性而起抗凝作用。肝素加速ATⅢ灭活凝血酶、Ⅸa、Ⅺa过程需要ATⅢ和酶同时结合到肝素链,形成三元复合物。在灭活FⅩa、Ⅻa时,肝素分子只需和ATⅢ形成抑制复合物即可。
ATⅢ血浆半衰期为72小时。正常血浆水平可因测定方法不同、测定选择的正常人群不同而有差异。若采用商品标液品制备标准曲线(1U/ml等于100%),则ATⅢ抗原的正常血浆水平均为180~300mg/L(约4μmol/L);若以正常混合血浆制备标准曲线测活性,则ATⅢ:C为70%~130%(0. 7~1. 3U/ml)。新生儿、妊娠期的血浆ATⅢ活性较正常为低(54%±17%),服雌激素避孕药时ATⅢ水平亦下降。为何在正常情况下出现低于正常值现象,其临床意义尚不明了。为此,对ATⅢ缺乏者的研究必须包括家系分析、临床表现和实验室结果等内容。
遗传性抗凝血酶Ⅲ缺乏症
发病率及遗传学
1965年Egeberg等首先报道本病。估计发病率为1/2000或1/5000。本病在欧美的发病率接近于血友病。近年来采用较敏感的肝素辅因子试验对4000名苏格兰献血者的调查,发病率为1/350,其中大多无临床症状,上述结果提示正常人群中包括部分ATⅢ生化异常者,并不一定有血栓危险性,因为在静脉血栓患者中仅4%为ATⅢ缺乏症患者。
ATⅢ基因位于1号染色体长臂(1q23~25)。在单倍体染色体基因组中为单拷贝,含7个外显子,DNA全长14kb。采用人肝RNA启动子延伸分析法已获ATⅢmRNA起始位图谱。ATⅢ转录起始于5'端距ATG启动编码子72bp处。3'端距终末编码子49bp处,含AATAAA序列。该序列下游224bp处为酶解或多聚腺苷酸作用位点。基因表达有组织特异性,但对其调控机制为顺式调控序列或逆式调控因子,尚不了解。已发现两个调控元件,但在5'区中不能发现常见的TATA、CCAAT或GC等调控元件。
遗传性ATⅢ缺乏症是常染色体显性遗传性疾病。男女患病机会相等,以杂合子多见;杂合子ATⅢ水平40%~70%。父母患本病则子女发病可能性约59%。诊断需基于对患者全病史及家系的了解。阴性家族史者不能除外自发变异的先天性缺乏症。当蛋白试验结果不能肯定时,以单倍体分析法测定其等位基因的变异将有助于遗传病诊断。同时作家系调查,以便对来自同一祖先的变异抑或基因突变提供鉴定依据。由于遗传性ATⅢ缺乏症为单基因疾病,采用基因多态性作单倍体分析图,已鉴定出50余种多态性变异。可是有许多家系的ATⅢ分子缺陷尚不明确。
临床表现
本病主要表现是静脉血栓(60%),某些患者可伴有肺栓塞(40%)。50%以上的患者有一次以上的血栓病临床表现。虽然各年龄都可发生,但67%患者初次发病年龄为10~35岁(中位数20岁),其中约1/3血栓发生无诱因。常见诱因为妊娠、分娩、长期卧床、口服含雌激素避孕药、手术、创伤、感染等。血栓常见部位是下肢深静脉、髂静脉、股静脉和浅静脉,其次是盆腔静脉、上腔静脉、肠系膜静脉、肝静脉和门静脉(后二者可产生Budd-Chiari综合征)。少数报道为肾、腋、肱、脑和视网膜静脉血栓。动脉血栓的报道亦属少数。血浆ATⅢ水平缺乏者伴高血栓发生率。ATⅢ结合肝素部位发生变异的纯合子可呈现动脉血栓的高发生率,反之其杂合子若表现为与肝素的亲和力减低则致栓危险性较低。遗传性ATⅢ缺乏症患者家族之间及家族成员之间的血栓好发倾向差异性很大,且与血浆水平并不平行。因此,对携带者不能采用均一的治疗方案。
实验室检查及分型
对年轻血栓患者、复发性血栓或家族好发倾向者,是否值得进行实验室筛选,尚无统一意见。这是因为具有此三项临床特征的静脉血栓患者中仅30%可查出属ATⅢ或蛋白C或蛋白S缺乏。反之,ATⅢ或蛋白C或蛋白S缺乏者中仅13%呈现上述三项临床特征。英国血液学会建议对年龄40~45岁静脉血栓、复发性静脉血栓或血栓性静脉炎、不寻常部位的血栓、明显血栓家族史者或反复习惯性流产者进行病因调查。低ATⅢ活性水平有诊断价值。单纯免疫学试验是不够的。依靠三类试验可将ATⅢ缺乏症分型:①免疫学试验测血浆ATⅢ抗原;②交叉免疫电泳试验测定异常分子。在存在肝素下出现慢峰则提示ATⅢ-肝素结合部位变异;③功能试验,包括ATⅢ肝素辅因子活性试验和渐进性ATⅢ抑制试验。辅因子活性试验是本病的最佳筛选试验,所有缺乏症均表现出异常。试验基于血浆加肝素后的FⅩa或凝血酶的灭活状况(肝素辅因子活性),培养时间缩短至低于30秒能提高检测灵敏度。渐进性ATⅢ抑制试验是基于缺乏肝素加速条件下ATⅢ的蛋白酶抑制活性与靶物蛋白酶之间的互相反应。该试验能筛选出ATⅢ肝素亲和力受损的患者,表现为ATⅢ渐进性抑制活性正常,但肝素辅因子活性低下。
ATⅢ缺乏症分型:ATⅢ缺乏症变异型已知50余种,分类方法尚未完善,可分为两型。
抗凝血酶Ⅲ(ATⅢ)缺乏症分型
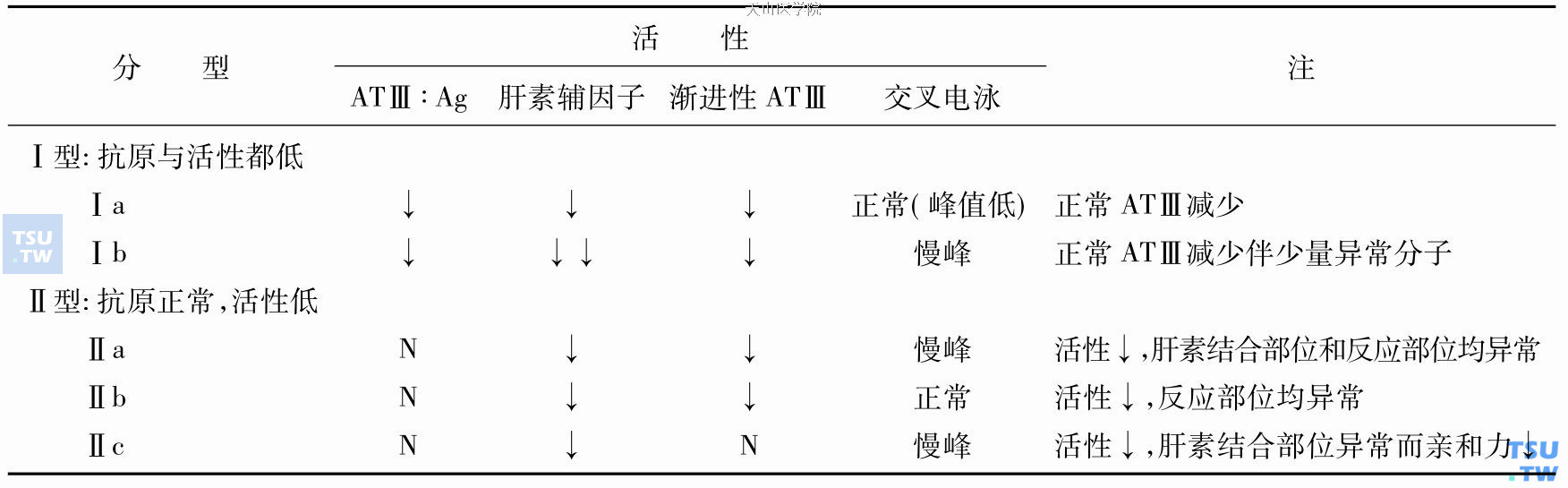
1、Ⅰ型ATⅢ缺乏症
属经典型缺乏症。患者不能合成ATⅢ,故血浆ATⅢ抗原和活性都降低。Ⅰa型测不到变异蛋白,交叉免疫电泳泳动及峰形正常,但峰值减低。Ⅰb型伴少量变异蛋白,故抗原性与活性的减少不成比例,抗原水平高于活性水平。交叉免疫电泳出现慢峰。这些变异蛋白与肝素的亲和力减低和凝血酶无反应。分子病基础Ⅰa型少数为大基因缺失或重排导致无功能等位基因。多数Ⅰ型患者为外显子区的点状改变,如单个碱基替代、插入或缺失,而造成:①翻译框架迁移;②过早生成终止编码子;③产生不稳定蛋白;④影响RNA加工过程等机制参与分子病形成过程。
2、Ⅱ型ATⅢ缺乏症
本型血浆中半数ATⅢ为变异蛋白,故抗原量正常但活性减弱。交叉免疫电泳中见慢峰(分子量增高),与肝素形成的复合物无活性。某些功能缺陷者的分子结构缺陷性质尚未明确。
Ⅱa型:能试验显示ATⅢ肝素结合部位及ATⅢ反应部位均有异常。
Ⅱb型:仅反应部位异常。
Ⅱc型:仅肝素结合部位异常。
Ⅱa及Ⅱb型变异体都产生无功能蛋白,主要是由于单个碱基替代,使反应部位功能异常。例如ATⅢNorth Wick Park Arg393→Cys。
Ⅱc的单个碱基替代使ATⅢ肝素结合部位功能异常,如ATⅢToyama,精47→半胱氨酸而无肝素加速ATⅢ活性。ATⅢRouen- 1精47→组及ATⅢRouen- 2精47→丝使肝素亲和力减低。Ⅱc型仅肝素结合部位(辅因子)活性减低者的血栓发生倾向低。
治疗及预防
ATⅢ缺乏症并发血栓,可采用的药物是肝素、口服抗凝、ATⅢ替代治疗及雄激素制剂。
1、治疗
1)肝素:是并发静脉血栓急性期的主要治疗手段,某些大面积血栓栓塞急性期病例需考虑溶栓治疗。普通肝素的有效抗凝需维持APTT时间1. 5~2倍延长。无血栓并发症的ATⅢ缺乏妇女,妊娠早期或分娩期普通肝素抗凝剂量使APTT延长10秒。常采用肝素皮下注射6250U,2/d,分娩日停肝素,在产后48~72小时恢复使用肝素,之后改为口服抗凝并维持口服抗凝3个月。低分子肝素可按照体重每日1次皮下注射给药,不用监测或采用血浆抗Ⅹa活性作监测。肝素治疗本身可使血浆ATⅢ水平轻度下降,但不致因此引起血栓。ATⅢ水平减低对肝素治疗有抵抗者(血栓见延伸)或无反应者,有指征合并应用ATⅢ浓缩剂1000~5000U/周,肝素长期使用,尤其妊娠妇女有并发骨质疏松的报道。
2)口服抗凝:华法林口服抗凝,常在肝素治疗同时或后期给药,以抵消华法林治疗初1周内诱发的短暂高凝期。华法林治疗诱发短暂高凝的原因为,依赖维生素K的抗凝蛋白——蛋白C,因其半衰期最短而最先被华法林抑制,之后才发生其他促凝蛋白活性被抑制。华法林通过胎盘,故妊娠早期(6周内)及分娩期妇女禁用,以避免致畸或产妇分娩期出血。此时应该用肝素抗凝。可在妊娠第三期采用华法林直到妊娠36周或分娩前1周再转为肝素治疗。分娩后经肝素过渡到改为口服抗凝治疗。这种设计的治疗方案可以避免肝素使用期过长致骨质疏松并发症。华法林抗凝强度采用凝血酶原时间的国际标准比值(INR)作监测。首次发作或妊娠后的血栓,维持INR值2. 0~3. 0(即1~2倍延长),复发性血栓病则维持INR值3. 0~4. 0(2~3倍延长),治疗至少3~6个月。
3)ATⅢ替代治疗:冷冻血浆替代,因输注容量极大而使用受限。ATⅢ浓缩剂国外已有商品,虽经高温灭活HIV及肝炎病毒,但与一般生物制剂应用原则相似,给药前需权衡利弊。各种商品ATⅢ制品都含某些无功能分子,需以功能试验监测疗效,使血浆ATⅢ水平维持80%~120%。输注ATⅢ0. 75~0. 8U/kg体重可升高血浆水平1%。ATⅢ生物半衰期t1/2为61~92小时,故ATⅢ缺乏妇女的一般输注量1000~1500U,1/周,同时合并肝素12 500~15 000U可增强抗栓疗效,但肝素可使ATⅢ半衰期缩短。妇女分娩期可增至ATⅢ1000U,每天或隔天输注。
4)雄激素:遗传性ATⅢ缺乏者使用丹那唑(danazol)、司坦唑醇(stanozolol)、羟甲烯龙(oxymetholone)等雄激素制剂可升高血浆ATⅢ水平,也有作者报道同时升高依赖维生素K的促凝因子的血浆水平而无应用前景。故作为常规推广应用尚需对照试验来证实其安全性。
2、预防
遗传性ATⅢ缺乏症无症状者无需预防性抗凝治疗,因回顾性分析资料均表明本病血栓并发率及死亡率均不高,但是因各家系的血栓发生率有所不同,目前对15~40岁ATⅢ缺乏者,处血栓高危期,如妊娠、手术,则主张给予抗凝预防血栓并发症。手术期应用ATⅢ浓缩剂或低剂量肝素皮下给药,都有不少成功的报道。
获得性抗凝血酶Ⅲ缺乏症
获得性血浆ATⅢ水平减低见于:
(1)生理性减少:早产及新生儿、老年。
(2)消耗性减少:ATⅢ在止血中消耗,或因周转加速而血浆水平下降。例如见于弥散性血管内凝血、严重全身感染、感染性休克、妊娠及产后期、妊娠急性脂肪肝、HELLP综合征、先兆子痫(严重型常与血浆ATⅢ水平呈正比)、手术和术后(常在术后第三天出现,并与组织损伤呈正比)、急性粒细胞白血病治疗前(与止血机制活化及肝损害有关,但急性早幼粒白血病者ATⅢ水平正常,而α2-抗纤溶酶水平下降)、大范围静脉血栓等。
(3)肾脏疾病:肾病综合征患者经尿丢失ATⅢ,并与其低蛋白血症或疾病活动度呈正比,并伴有其他凝血异常。患者常引起静脉或动脉血栓。但IgA肾炎患者血浆ATⅢ水平增加。溶血性尿毒症患者血浆ATⅢ水平低下。
(4)肝脏疾病:急性肝功能衰竭、慢性肝病、肝硬化(尤见于酒精性肝硬化)、原发或继发性肝癌(早期血浆ATⅢ水平增高,晚期下降)。
(5)胃肠道疾病:炎症肠病活动期或蛋白丢失性肠病,因抗凝蛋白的丢失可诱发血栓病。炎症肠病常伴发其他止血异常,如血小板增多及功能异常、纤溶亢进等。
(6)药物影响:肝素抗凝治疗可加速TAT复合物自肝脏清除;L-门冬酰胺酶治疗急性淋巴细胞白血病,可抑制肝脏合成蛋白使ATⅢ、PC、PS、纤溶酶原、纤维蛋白原和其他凝血因子减少,并引起静脉血栓;雌激素治疗绝经后综合征并不影响血浆ATⅢ水平,但口服避孕药可通过多个因素致血栓倾向;他莫昔芬(tamoxifen)雌激素受体抑制剂治疗绝经期妇女的乳腺癌常可致血浆ATⅢ水平降低。
(7)血浆稀释:血液透析、血浆置换、体外循环术常致血浆ATⅢ水平下降。
(8)其他:ATⅢ水平下降亦见于糖尿病(与蛋白糖基化异常有关),白塞综合征、营养不良等。
获得性ATⅢ水平减低与临床血栓好发倾向间的联系尚难以定论。因为基础疾病常伴其他止血机制的改变,使之复杂化。故对获得性血浆ATⅢ水平缺乏症是否需要替代性治疗尚有争议。
某些生理情况下ATⅢ低水平不一定导致血栓症。例如,妊娠20周的早产儿ATⅢ水平约为25%,新生儿的ATⅢ水平约为50%,出生6个月后才达到成人水平。故新生儿的α2巨球蛋白在抑制凝血酶上起相对重要作用,使健康新生儿血栓症不常见。新生儿伴发其他病理生理改变时致血栓调节功能减低,例如新生儿患呼吸窘迫综合征、坏死性小肠结肠炎、严重全身性感染或DIC时,血浆ATⅢ水平进一步减少。但是,随机试验资料显示,早产儿出生时给予浓缩ATⅢ制剂对急性呼吸窘迫综合征的发生和严重程度均未见预防作用。
ATⅢ浓缩剂在获得性ATⅢ缺乏症中的应用尚无足够经验。基础疾病的治疗应列为第一线治疗,ATⅢ缺乏常是止血机制紊乱中的一个部分。据文献报道感染、外伤、肝功能衰竭所促发的消耗性凝血病(DIC)时,给予ATⅢ浓缩剂或肝素可使DIC指标恢复,但未能延长生存期。至于产科DIC,因血小板重度减少而加重肝素治疗以至引起出血倾向者,输注ATⅢ浓缩剂能促使多发动脉栓子消散,取得合并肝素或输注新鲜冷冻血浆所不能达到的效果。L-门冬酰胺酶治疗急性白血病合并ATⅢ浓缩剂可减少该化疗药的致血栓危险、抑制TAT复合物和D-二聚体生成。脑膜炎菌血症及暴发性紫癜者应用ATⅢ浓缩剂亦有成功的报道。
