病例与思考
患者,男性,66岁,因呼吸困难1周、痰中带血入院。该患者2年前确诊右肺肺癌(鳞型,cT3N2M0,ⅢB期),4疗程化疗后,胸部病灶放疗后,病情进展后又行4疗程化疗。末次治疗时间为2013年10月10日,本次入院评价疗效为疾病进展。此次入院查体:一般状态欠佳,意识清楚,面部皮肤晦暗,颞部、眼眶周围凹陷,肩部轮廓明显,肋间隙清晰可见。腹部微膨隆、双下肢凹陷性水肿。近1周卧床,进食差,无食欲。患者1个月前体重为60kg,近1个月体重减轻4kg。
- 根据 2011年恶液质专家共识,该患者是否可诊断为恶液质?
- 该患者目前的最佳治疗是什么?
- 不考虑基础疾病因素,因恶液质导致的不良临床结局有哪些?
很多恶性肿瘤患者在发病或疾病进展过程中合并恶液质,根据肿瘤的类型和分期不同,恶液质的发生率也有所不同,分别为9%~85%不等。恶液质是肿瘤相关性营养不良的特殊形式,是由于蛋白质及能量长期摄入不足所引起的营养缺乏症状,主要表现为进行性消瘦、体重减轻、低蛋白血症或水肿等各项人体测量指标均低于正常,骨骼肌与内脏蛋白质绝对含量下降,内源性脂肪与蛋白质储备空虚,严重者影响心脏、肝脏、肾脏等重要脏器的功能。恶液质是多重因素共同作用的结果,包括肿瘤对全身和局部的影响、机体对肿瘤的应答以及机体对治疗的反应等,其是肿瘤患者死亡的主要原因之一。终末期恶性肿瘤患者经常并发恶液质,临床研究表明,50%的肿瘤患者在诊治过程中体重下降超过10%,在所有实体瘤中,胰腺癌、胃癌发生肿瘤相关性恶液质的比例最高,其次依次为头颈部肿瘤、食管癌、肺癌、结直肠癌、泌尿生殖系统肿瘤及妇科肿瘤。恶液质的发生严重影响肿瘤患者的生存质量和抗肿瘤治疗的效果,进而影响肿瘤患者的预后和总体生存期。
恶液质不良临床结局
恶液质是营养不良的一种特殊形式,慢性消耗性疾病,如肿瘤、获得性免疫缺乏综合征、慢性阻塞性肺病、终末期肾病等均是并发恶液质的独立危险因素。大约有38%的肿瘤患者会伴发营养不良,在营养不良的肿瘤患者中大约有45%~60%的患者最终进展到恶液质状态,特别是老年患者,营养不良及恶液质的发生率更高。恶液质的发生不仅同肿瘤患者较差的生活质量相关,也与治疗过程中出现的副作用相关,特别是化疗、放疗的毒副作用。在肿瘤患者中,恶液质的发生会影响抗肿瘤治疗的效果,加重化疗、放疗的毒副作用,增加并发症发生的几率,进而缩短患者的生存期。恶液质不良临床结局如表6-10-1所示:
表6-10-1 恶液质的不良临床结局

影响生活质量
以恶性肿瘤为代表的消耗性疾病引发的恶液质,患者因出现难以逆转的糖、蛋白质、脂肪三大类物质能量代谢障碍,继而出现厌食、恶心、呕吐、疲乏、消瘦等不良临床表现,最终导致患者肌肉消耗、体力状态降低、社会活动减少,因此严重影响患者的生活质量。Ravasco等研究发现:营养状态的好坏直接影响患者的生活质量,其影响程度可达20%~30%。Nourissat等总结了907例肿瘤患者的体重情况与生活质量的关系,发现体重情况与生活质量的以下几个主要方面显著相关:食欲缺乏、乏力、便秘、腹泻、器官功能、体力状态、认知及社交能力等。营养物质摄入减少导致的体重降低是影响患者生活质量的独立决定因素。Head BA等meta分析的结果提示:头颈部肿瘤患者的体重降低与生活质量下降显著相关。
治疗效果差,毒副作用多
恶液质可降低机体免疫功能、增加感染风险、增多术后并发症、延迟创口愈合等,并降低治疗效果,增加化疗、放疗的相关毒性。与营养状态良好的肿瘤患者相比,营养不良(如体质指数低、低蛋白血症、肌肉减少症等)的肿瘤患者接受化疗后,剂量相关性毒副作用发生的风险高,特别是出现恶液质的肿瘤患者,化疗完成率和有效反应率显著降低,接受初始化疗的剂量更小,且剂量相关性毒副作用发生更加频繁。Prado CM等研究发现:接受卡培他滨治疗的转移性乳腺癌患者,肌肉减少症的存在与否是预测化疗药物毒性的重要指标。在一项结肠癌患者接受5-Fu和亚叶酸钙治疗的前瞻性研究中,骨骼肌含量与体表面积比值低提示化疗药物剂量限制性毒性的发生率高。Antoun S等亦发现:在转移性肾细胞癌患者中,若体质指数(body mass index,BMI)<25kg/m2,同时合并肌肉减少症,应用索拉菲尼治疗的剂量限制性毒副作用明显增加。同样,恶液质肿瘤患者对放疗的耐受性下降、敏感性降低、毒副作用增加,而接受放疗会进一步加重患者的营养不良状态。接受头颈部或腹部区域放疗的患者中,90%的患者会出现体重降低。Langius JA等发现:伴有营养不良状态的头颈部肿瘤患者接受放疗,放疗的毒副作用会进一步加剧营养不良,若放疗前或放疗期间体重降低>10%,患者5年特异性疾病生存率减低。Donaldson SS发现:腹腔或盆腔接受50Gy常规分割的照射剂量,患者体重平均减轻3.4kg,59%的患者体重降低达到10%。手术的并发症和死亡率亦升高。Lieffers JR等研究发现:与术前评估营养状态正常的直结肠癌患者相比,肌肉减少症患者行结直肠癌切除术后,并发感染的风险增加、康复时间延长,特别是在≥65岁的人群中体现的更加明显。van Vledder MG等发现:直结肠癌肝转移患者接受肝转移灶切除手术,与不存在肌肉减少症的患者相比,肌肉减少症患者5年无病生存率和整体生存率均显著降低,肌肉减少症是术后复发率高、生存率低的独立预测因素。Bagan P等亦发现:存在营养不良的肺癌患者行肺切除术后,其感染并发症增加、死亡率增高。
增加医疗费用
发生恶液质的肿瘤患者在治疗原发病的过程中,因化放疗引起的毒副作用会导致住院治疗时间延长,住院频次增加,占用医疗资源增加,必须营养支持治疗的费用增加,从而导致医疗费用明显增加。新加坡学者Lim SL等开展的前瞻性病例对照研究发现:在全部818例住院患者中,29%的患者存在营养不良,肿瘤科患者营养不良的发生率最高(占71%),其次分别为内分泌科患者(占48%)及呼吸科患者(占47%)(图6-10-1);营养不良患者住院时间延长,且出院15天内再次入院概率增高;营养不良患者平均住院费用远超于营养良好的患者。Benkovi V等研究表明:在营养不良患者的全部医疗费用构成中,住院费占33.73%(图6-10-2);与非营养不良患者相比,住院费至少增加20%。住院时间延长必然导致住院费增加、占用的医疗资源增多,使患者个人、家庭乃至国家的经济负担急剧加重。
缩短生存期
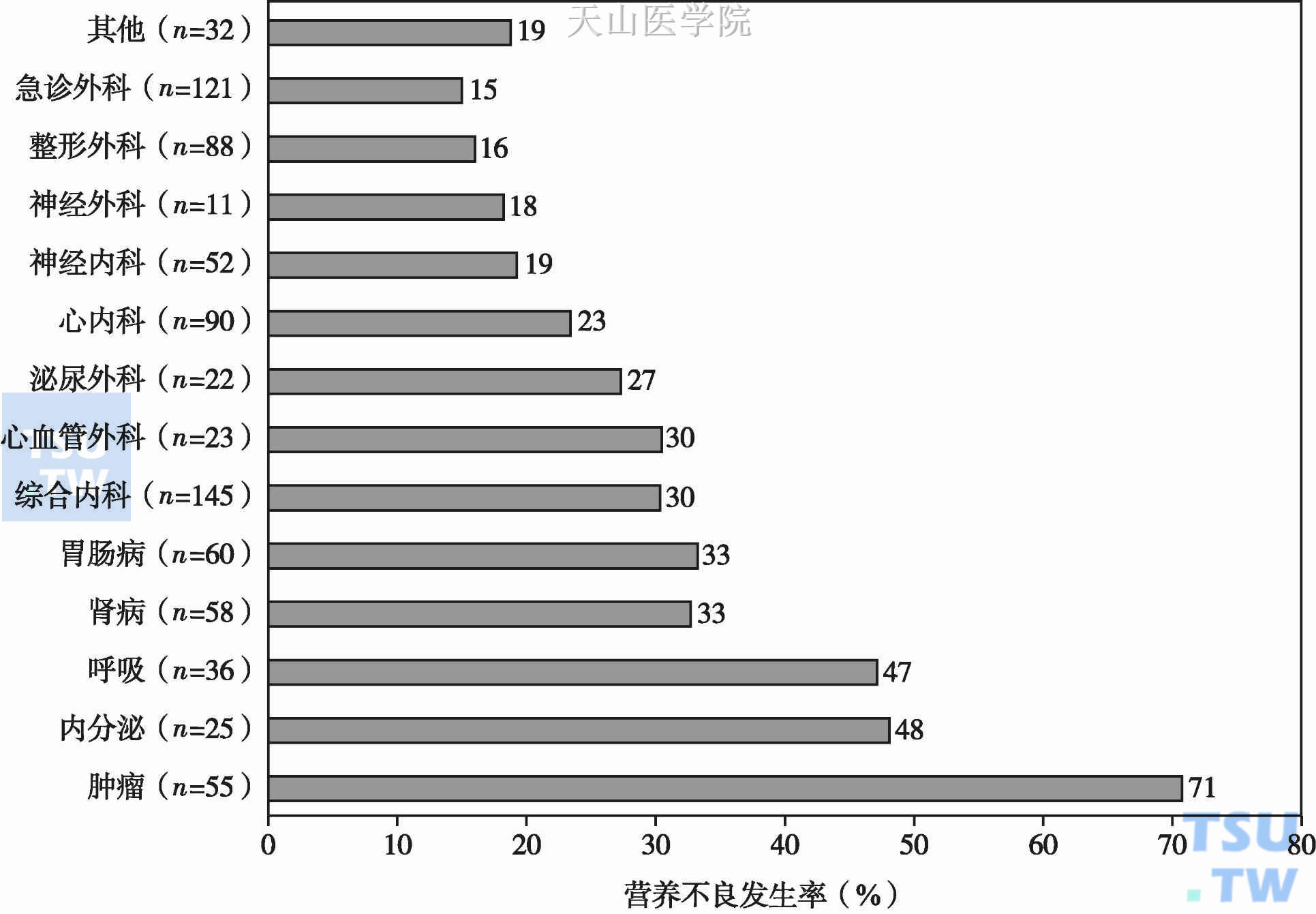
图6-10-1 818例住院患者营养不良的发生率
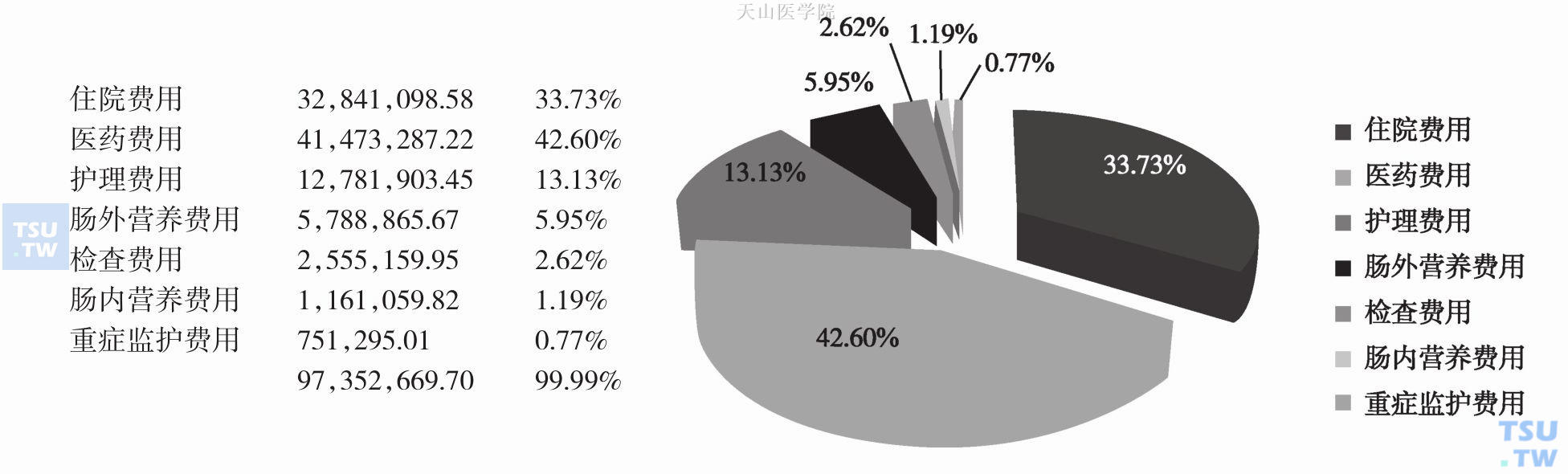
图6-10-2 营养不良患者全部医疗费用构成
恶液质可影响机体各系统功能,如循环系统:可导致心肌萎缩、收缩功能降低、心排血量下降、心律失常、心衰、周围循环衰竭等;呼吸系统:可导致呼吸肌结构受损、收缩力量下降、呼吸衰竭、合并肺部感染增多等;消化系统:可导致肠黏膜屏障功能受损、吸收不良、腹泻、食欲减退等;免疫系统:可使细胞及体液免疫缺陷、胸腺萎缩,抗感染能力下降等。以上各系统功能受损与肿瘤患者的生存期缩短密切相关。有4%~23%的终末期肿瘤患者死于恶液质而非疾病本身。Pausch T等研究表明:随着BMI值的降低,死亡率明显增加(图6-10-3),随着腹壁脂肪厚度的降低,生存期显著缩短(图6-10-4)。Gupta D的Meta分析结果表明:肿瘤患者的血清白蛋白水平与生存期在统计学上呈负相关。van Vledder MG等研究发现:在转移性结直肠癌患者中,肌肉减少症是复发率高、生存率低的独立预测因素。Lecleire S等研究发现:对于不能手术或者术后复发食管癌患者行姑息性支架植入术,若BMI<18且WHO体力状态评分>2分,则预示着具有较短的生存期。Lim SL等开展的前瞻性病例对照研究发现:营养不良患者1年死亡率、2年死亡率及3年死亡率均明显高于营养良好的患者。
不同抗肿瘤治疗方法对恶液质的影响
抗肿瘤治疗不可避免地会对机体营养状态产生影响,不论是外科手术引起的机械性和生理性改变,还是化疗或放疗产生的细胞水平的改变,治疗的不良反应可能加重患者的恶液质状态,使患者发生更严重的营养缺乏。
手术
患者在术后一段时间内通常进食减少,特别是当手术涉及口咽与食管,可导致咽下困难,这种影响是持久的,更易发生营养物质摄入下降。Harris AM等研究表明:接受胃肠手术的患者中,大约有42%~50%的患者因味觉和嗅觉功能的短暂缺失而影响食欲,导致食物摄入减少、体重降低;此外,手术本身营养需求增加,手术诱发的应激反应可引起机体代谢亢进、组织分解增加和蛋白丢失增多,进而导致体重降低、乏力及脏器功能恶化。La Torre M等研究发现:大多数胰腺癌患者术前已存在营养不良,胰腺切除术本身可导致术后的代谢异常,进而加重营养不良,促进恶液质的发生。在口腔、唾液腺或嗅觉神经的外科治疗也可降低味觉灵敏度进而减少食物摄入,导致营养状态下降,增加恶液质的发生概率。D'Journo XB等回顾性研究发现:90%的食管癌患者在行食管癌根治术后发生营养不良,55%的这部分营养不良患者在术后1年左右发生恶液质。
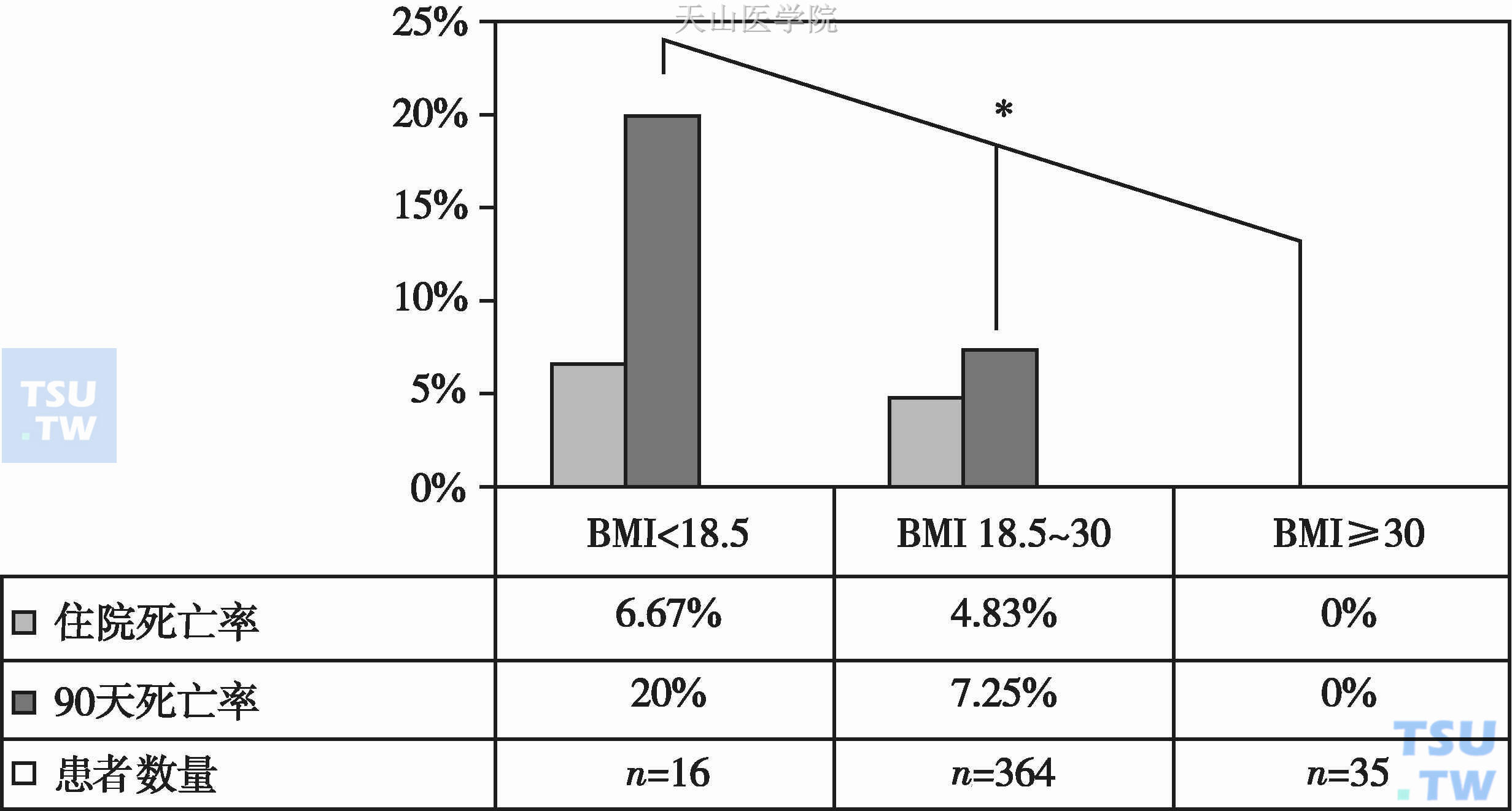
图6-10-3 体重指数对死亡率的影响
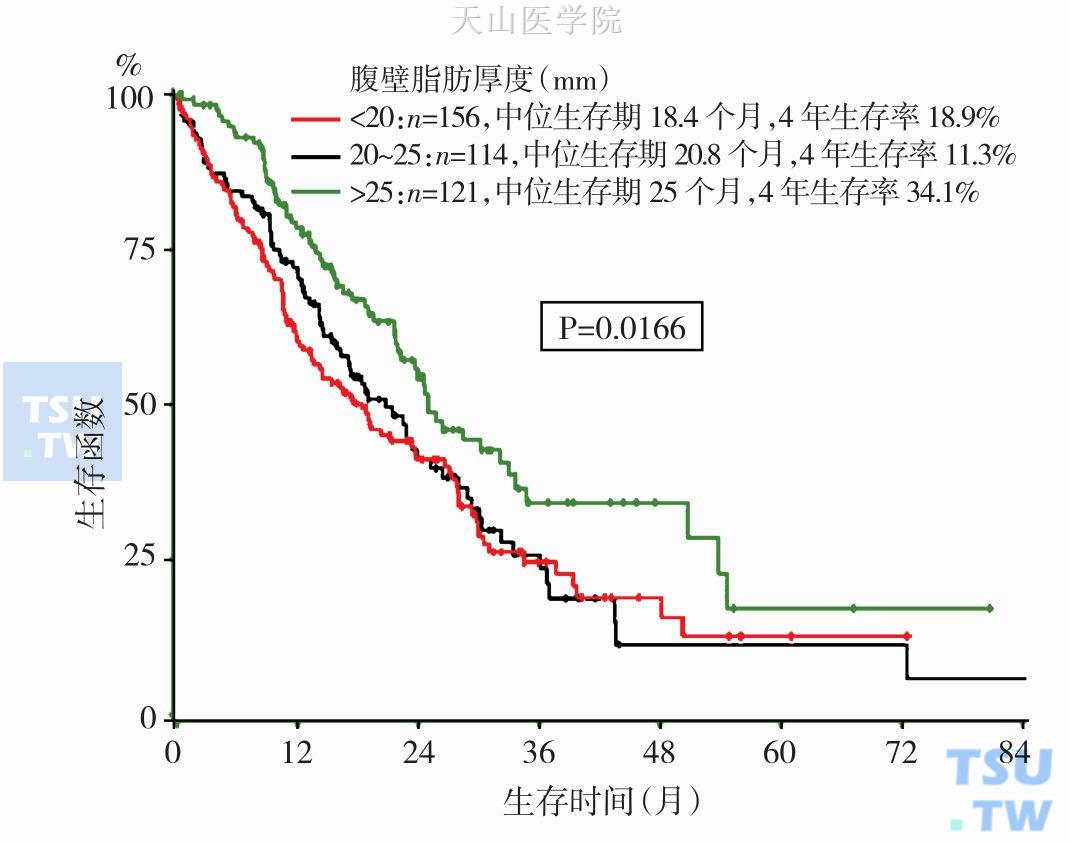
图6-10-4 腹壁脂肪厚度对整体生存期的影响
化疗
化疗对营养状态最普遍的影响是食欲减退、味觉嗅觉改变、畏食、恶心、呕吐、黏膜炎、便秘、腹泻和早期饱胀感。化疗可以导致胃肠痉挛、胀气、麻痹性肠梗阻和吸收不良。化疗还可损害小肠黏膜,导致吸收不良和腹泻。一些抗肿瘤药物,如氟尿嘧啶、多柔比星、甲氨蝶呤和顺铂可引起严重的胃肠道并发症。化疗后,患者常因食欲减退,进食量减少而发生低血糖症、低钙血症和微量元素缺乏等代谢异常,进而促进恶液质的发生。Antoun S等研究发现:若治疗前存在营养不良,如BMI<25或骨骼肌指数低于均值,接受化疗后严重毒性事件发生率明显增高,更加促进恶液质的发生。Cousin S等的最新前瞻性研究结果亦证实以上观点。
放疗
放疗对营养状态的影响主要同放射区域、放射类型、放射的剂量及持续时间、个体差异性有关。头颈部的放疗可引起畏食、食管炎、口腔干燥、恶心、呕吐、吞咽困难、咽喉炎、味觉改变和牙关紧闭症。胃肠道黏膜对放疗高度敏感,腹部和盆腔的放疗可导致急性腹泻、食欲减退、恶心、呕吐、腹痛、肠炎,还可引起慢性放射性肠病、胃肠道狭窄、肠瘘而导致严重的营养不良。放、化疗同步治疗可引起黏膜萎缩、黏膜溃疡和黏膜坏死,导致更为严重的放射性肠病,严重影响肿瘤患者的营养状态。近年来,我国学者发现:鼻咽癌患者接受调强放疗,与放疗开始时相比较,相关的营养学指标如BMI、白蛋白、血红蛋白、总淋巴细胞计数等在放疗结束后均显著下降。放疗前存在营养不良的患者接受放疗后会促进恶液质的发生。Cacicedo J等开展的前瞻性研究得出结论:患者的营养状态、ECOG评分、肿瘤的部位(特别是头颈部肿瘤)及是否进行过化疗等因素与放疗期间及放疗后1个月患者的体重降低情况有关。鉴于此,对接受放疗的患者进行治疗前营养评估是十分必要的,对放疗前或放疗过程中出现营养不良的患者及时给予营养支持,能够阻止或延缓恶液质的发生。
小结
恶液质是肿瘤相关性营养不良的一种特殊形式,很多恶性肿瘤患者在发病或疾病进展过程中合并恶液质。恶液质的发生不仅同肿瘤患者较差的生活质量相关,也与治疗过程中出现的副作用相关,特别是化疗、放疗的毒副作用;而不同的抗肿瘤治疗方法在一定程度上都会诱发或促进恶液质的发生及进展。在肿瘤患者中,恶液质的发生会影响抗肿瘤治疗的效果,加重化疗、放疗的毒副作用,增加肿瘤患者的并发症,降低生活质量,进而缩短患者的生存期。恶液质一旦发生,必然导致住院时间延长、治疗费用增加,造成社会医疗资源的巨大浪费。
思考题答案
1. 根据最新的恶液质治疗指南,恶液质诊断主要以体重减轻或肌肉减少为主要参考指标。病例中记录患者近1个月体重减轻4kg,查体可见明显肌肉减少表现(颞部、眼眶周围凹陷,肩部轮廓明显,肋间隙清晰可见),综合查体、检验及病史,患者符合恶液质的诊断。
2. 该患者近1周卧床,PS评分3分,根据NCCN指南,PS>2分的患者不适合化疗;根据该患者目前状态,应该给予最佳的支持对症治疗:①该患者食欲差、进食少,应给予甲地孕酮或甲羟孕酮口服、增强食欲,给予多潘立酮或伊托必利口服增加胃肠动力,并嘱患者少食多餐,进食产气少、易消化食物;若无明显改善,则需静脉补充营养液,维持机体基础能量代谢;②患者腹部微膨隆、双下肢凹陷性水肿,检查血白蛋白,若降低明显,给予补充白蛋白,联合利尿治疗,有利于减轻腹腔积液及双下肢水肿,利尿过程中监测离子,及时纠正低钾血症;③精神心理安慰,解除患者焦虑、紧张、抑郁等情绪,保持良好心情;④中医抗肿瘤治疗。
3. 该患者因恶液质导致不良临床结局主要有生活质量降低、住院时间延长、医药及住院费用增加、生存时间缩短。
(赵宇光 李薇)
