免疫放射分析(IRMA)属非竞争性抗原抗体免疫反应分析法,它有别于RIA的基本点是用过量的标记抗体与样品中待测成分(抗原或半抗原)充分结合,而RIA是利用过量的抗原(标记抗原和待测抗原)同时竞争性结合限量的抗体。因此,在IRMA反应体系中,标记抗体与待测抗原的结合很少受抗体亲和常数的影响,反应在较短时间(2~3小时)内就可达到化学平衡状态,即使单克隆抗体的亲和力较低,也能满足试验要求。同时,一个抗原分子也可以结合多个标记的抗体分子,使IRMA的分析灵敏度比RIA高10~100倍。
免疫放射分析是待测样品加入过量标记抗体与待测抗原的结合反应
免疫放射分析的反应式如下:
![]()
待反应达到平衡后再加入固相抗原免疫吸附剂与反应体系中过剩的标记抗体结合,或加入另一个未标记单克隆抗体与 Ab*·Ag复合物结合,离心分离测定上清液或沉淀中的Ab*·Ag复合物的放射性强度,其放射性强度与待测抗原含量有关。若以抗原抗体复合物的结合率(B%)为纵坐标、以标准抗原的浓度或浓度的对数为横坐标作图,则呈现随抗原浓度增加而上升的校正曲线(下图),从该曲线可求得待测抗原的含量。由于该方法为非竞争反应体系,因而在待测物浓度较低时,也不会出现或者形成标记复合物或非标记复合物。所以一个可靠的IRMA系统,其检测灵敏度明显高于RIA。
但IRMA的不足之处是要分离游离抗体和复合物,两者都是大分子,一般分离方法难以奏效,目前主要靠用单克隆抗体作分离剂。建立一个IRMA系统至少要用两个抗体,一个起测定作用,另一个起分离作用。因此,待测抗原的每个分子至少要含有两个抗原决定簇。这样,IRMA又不适用于测定某些分子量较小的半抗原。
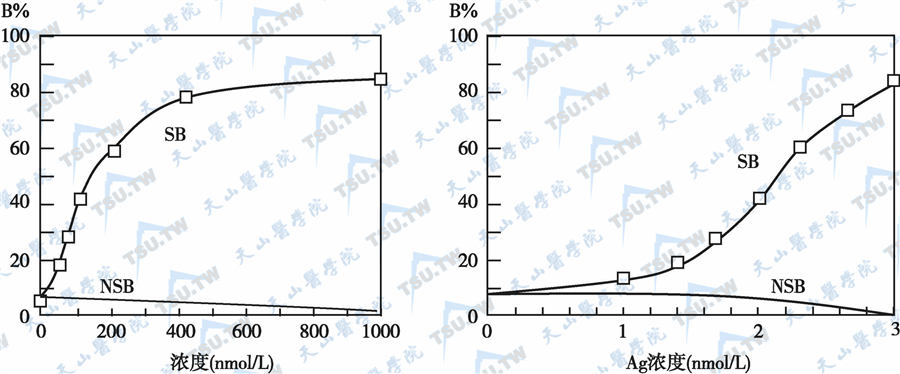
免疫放射分析法的校正曲线
注:B%:抗原抗体结合率;SB:抗原抗体特异性结合曲线;NSB:非特异性结合曲线
免疫放射分析有多种技术方法
1968年,Miles等首次建立了单位点结合的胰岛素IRMA法,将待测抗原与过量标记抗体结合形成复合物,游离过剩的标记抗体,用固相抗原吸附剂吸附并离心除去之,测定上清液的放射性强度,这种直接IRMA法的应用范围受到限制。此后,Hales等又建立了双抗体夹心IRMA法,该法采用固相抗体作分离剂,待测抗原的分子必须含有多个抗原决定簇,其中一个结合固相抗体而另一个结合标记抗体,非结合标记抗体可离心弃去,测定固相复合物的放射性。随着单克隆抗体制备技术和生物素-亲和素放大系统的应用以及固相分离技术的进步,不但IRMA法的检测灵敏度和精密度不断提高,而且方法的种类逐渐增多。按实验所用抗体、固相材料及分离剂等的不同,可将IRMA法分为以下几种类型。
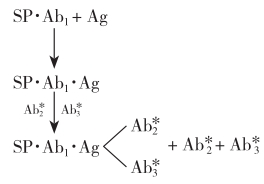
双抗体夹心法
可用下列反应式表示:
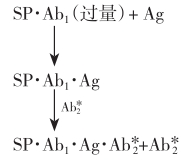
反应体系中的过量固相抗体(SP·Ab1)先与待测抗原(Ag)结合形成复合物(SP·Ab·1Ag),再加入过量的标记第二抗体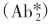 ,与SP·Ab1·Ag形成
,与SP·Ab1·Ag形成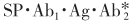 复合物,离心弃去上清液(游离的
复合物,离心弃去上清液(游离的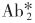 ),测定固相复合物的放射性。
),测定固相复合物的放射性。
标记第三抗体法
其反应表达式为:
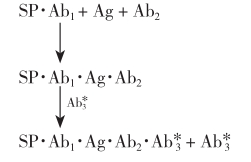
反应体系中各种抗体分子都是过量的。该法类似于双抗体夹心法,但标记的第三抗体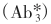 为抗Ab2的抗体。这一设计可省去标记其他抗体的步骤,此标记抗体可作为通用示踪剂。例如用125I标记兔抗鼠或羊抗鼠的抗体
为抗Ab2的抗体。这一设计可省去标记其他抗体的步骤,此标记抗体可作为通用示踪剂。例如用125I标记兔抗鼠或羊抗鼠的抗体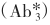 ,则所有应用非固相鼠抗体作为Ab2的方法,均可用
,则所有应用非固相鼠抗体作为Ab2的方法,均可用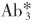 作为示踪剂。
作为示踪剂。
双标记抗体法
利用待测抗原分子有多个(3个以上)决定簇的条件,在抗体制备时选择3个以上单克隆抗体(McAb),其中一个结合在固相上,另两个分别标记同一种放射性核素。反应体系中待测抗原分子的一个决定簇与固相抗体相连,另两个各结合一个标记单克隆抗体。这样,复合物的比放射活性成倍增加,有利于提高检测灵敏度和精密度。可用下列反应式表示:
配体抗体桥式法
将一个与待测抗原无关的特异性配体(L)包被于试管作为固相(SP·L),加入待测抗原(Ag)及其标记抗体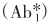 和连接配体的第二抗体(Ab2·L),待形成
和连接配体的第二抗体(Ab2·L),待形成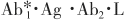 复合物后,再加入抗L的第三抗体(Ab3),Ab3在反应体系中起连接桥的作用,使之形成更大分子的复合物,便于分离。反应式如下:
复合物后,再加入抗L的第三抗体(Ab3),Ab3在反应体系中起连接桥的作用,使之形成更大分子的复合物,便于分离。反应式如下:

生物素-亲和素法
此法的最大优点是BAS具有很强的亲和力及最终扩大结合标记亲和素的能力,其亲和常数(KA)值达1015L/mol,是抗原抗体反应的10万~100万倍,使其稳定性和方法的检测灵敏度与精密度大大提高。它的基本原理是先将固相抗体(SP·Ab1)与待测抗原(Ag)和生物素化抗体(B·Ab2·B)连接成中间复合物,再加入标记亲和素(A*)与生物素相连接并形成最终复合物。一个生物素化的抗体分子连接了十几个生物素分子,而标记亲和素又有4个相同亚基都可与生物素分子结合。因此,其终产物是结合相对牢固和放射性强度倍增的大分子复合物。其反应式如下:
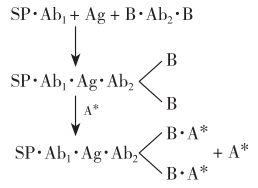
生物素-亲和素分离剂法
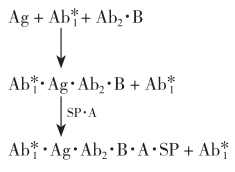
反应体系中的待测抗原分子具有多个决定簇,一些决定簇与生物素化的单克隆抗体(B·Ab2)结合,另一些与标记核素的单克隆抗体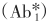 结合,再加入涂布有亲和素的聚苯乙烯珠(SP·A)与生物素连接成固相终产物。该法的优点是克服了其他IRMA法需多次离心洗涤的麻烦,待测复合物与固相结合更牢固,方法更稳定,操作更简便。其反应式如下:
结合,再加入涂布有亲和素的聚苯乙烯珠(SP·A)与生物素连接成固相终产物。该法的优点是克服了其他IRMA法需多次离心洗涤的麻烦,待测复合物与固相结合更牢固,方法更稳定,操作更简便。其反应式如下:
标记抗体的放射性核素类同于放射免疫分析
抗体
IRMA法所用抗体通常由人工制备获得。抗体主要有多克隆抗体(PcAb)、单克隆抗体(McAb)和基因工程抗体三种类型。其中基因工程抗体多用做药物载体。获得PcAb的传统方法是将纯化抗原免疫动物(如家兔、羊、马或豚鼠等),由动物体内β细胞产生抗体。因使用的抗原分子具有多种抗原决定簇,且每一种决定簇可激活具有相应抗原受体的β细胞,产生针对相应抗原决定簇的抗体,所以获得的抗体是针对多种抗原决定簇的混合抗体,故称为PcAb。McAb通常由杂交瘤技术获得,该技术又称抗体的细胞工程技术,随着细胞工程技术的进步,已在小鼠-小鼠杂交瘤的基础上发展了大鼠-大鼠、小鼠-人及人-人杂交瘤技术等。
制备McAb的基本原理是利用致敏的B淋巴细胞能分泌特异性抗体和骨髓瘤细胞能在体外大量繁殖的特点,而将两者融合成既能分泌特异性抗体又能在体外大量繁殖的杂交瘤细胞,杂交瘤细胞经大量克隆化培养产生的针对单一抗原决定簇的抗体称为McAb。纯化抗体的方法较多,一般常采用综合技术,如纯化IgG类抗体,多使用盐析与离子交换法;纯化IgM类抗体则应用凝胶过滤与制备电泳法,或应用离子交换与凝胶过滤法等。
放射性核素
用于IRMA法标记抗体的放射性核素类同于RIA法标记抗原,详见本节RIA法。以125I标记物为例,IRMA法与RIA法基本相同。IRMA法标记抗体与RIA法标记抗原比较,其优点是克服了RIA法中存在的某些抗原不易标记,或在标记过程中容易发生化学或放射性损伤的缺点。而且抗体(IgM)分子中含有多个酪氨酸残基,经标记过程中的碘化反应后不影响其免疫活性,能结合较多的放射性碘原子,标记物的比放射活性较高。
同时,抗体的来源较抗原丰富和纯品易得,标记方法容易掌握。如果将抗体分子经胃蛋白酶消化,再用2-巯基乙醇裂解成单价抗体(Fab),然后用125I标记应用于IRMA法,则可显著提高敏感性。
