小剂量DXM抑制试验初筛CS
标准小剂量DXM抑制试验
标准小剂量DXM抑制试验(standard LDDST)时,用DXM 2mg/d(成人0.5mg,每6小时1次;体重不足40kg的儿童根据体重和年龄减量)的小剂量抑制试验(持续48小时)确诊CS。DXM抑制下丘脑-垂体-肾上腺轴,故血、尿皮质醇下降,而CS由于长期高皮质醇抑制下丘脑-垂体功能,故小剂量DXM不出现反馈抑制效应。不论肌酐排泄率高低(如低体重患者),正常人在应用DXM的第2天,尿17-OHCS降至6.9μmol/24h(2.5mg/24h)以下,UFC降至27nmol/24h(10μg/24h)以下。分析结果时,重点看午夜的血清皮质醇水平,如果降至50nmol/L以下,可认为能被抑制(抑制试验阴性)。尽管确诊CS并不需要,但可将下述指标作为全面资料收集:血皮质醇低于140nmol/L (5μg/dl),ACTH降至2.2pmol/L(10pg/ml)以下,血DXM浓度5~17nmol/L(2.0~6.5ng/ml)。血皮质醇用于验证17-OHCS结果;血ACTH测定帮助明确CS的病因,通常在异源性CRH/ ACTH分泌综合征患者中升高,Cushing病正常,肾上腺肿瘤患者下降或检测不到。测定DXM是为了证实患者确实服药,且可了解DXM代谢速率是否处于正常范围。DXM在很多RIA中检测不出;在体内通过代谢以17-OHCS的形式于尿中排泄,但其浓度仅占总17-OHCS的1/3以下,对结果判定影响不大。原发性色素结节性肾上腺病(PPNAD)在进行小剂量和大剂量DST时,常出现服药第2日UFC增加50%以上的反常性升高现象。
午夜小剂量DXM抑制试验
操作简单,广泛用于门诊CS患者的筛查。方法:1mg DXM午夜0:00顿服,服药前一日的早晨(8:00前)抽血测皮质醇。如血皮质醇能被抑制到基础值的50%或140nmol/L(5μg/dl)以下,可排除CS。当结果介于140~275nmol/L(5~10μg/dl)而不能确诊时,应进一步作标准LDDST。肝脏酶系诱导剂如苯妥英钠(phenytoin)、苯巴比妥(phenobarbitone)、卡马西平(carbamazepine)诱导肝脏酶活性,加快DXM清除,可降低DXM的血药浓度而导致假阳性结果。雌激素可增加循环皮质醇结合蛋白浓度,可出现假阳性。建议在条件允许时,尤其是病情较轻者,停服含雌激素的药物6周,待血皮质醇结合蛋白降至基础水平后,再行LDDST。经皮给药(如皮埋剂、皮贴剂)时可不必停药等待。
1mg的DXM午夜小剂量DXM抑制试验(午夜口服DXM 1mg,次晨时测血皮质醇)主要用于CS初筛。一般认为,大多数轻度CS和周期性CS患者呈阳性反应。但是,这些患者高皮质醇血症的确定和鉴别困难,故1mgDXM抑制试验的意义是有限的,容易出现假阳性(如肥胖、应激、酒精中毒、精神疾病、妊娠、甲亢、糖皮质激素抵抗、试验误差、DXM吸收不全或代谢增强等)或假阴性(慢性肾病、低代谢状态等)结果。
DXM-CRH联合试验
先作DXM抑制试验,然后用CRH兴奋ACTH的分泌。据报道,本试验可完全鉴别CRH/ACTH依赖性CS和假性Cushing状态(pseudo-Cushings states,PCS)。如静注CRH后15分钟,血ACTH>38nmol/L可排除所有类型的CS。本试验特别适宜于尿皮质醇排出量增多不明显的轻型CS患者的病因鉴别。
大剂量DXM抑制试验诊断CRH/ACTH依赖性CS
如果小剂量法结果阴性(17-OHCS无明显下降),提示存在CS,应进一步鉴别其病因为增生或肿瘤。试验方法同前,仅将每日DXM剂量加至8mg/24h(每6小时服2mg),如为0.75mg片剂,可依3片、3片、3片、2片的方式分次服用。如为肾上腺皮质增生,17-OHCS应下降到对照值的50%以下,如大剂量仍不能抑制,提示肾上腺有自主分泌的皮质腺瘤。另外,异位CRH/ACTH分泌综合征所致的CS亦不被抑制。
Cushing病呈阳性反应
大剂量DXM抑制试验(HDDST)作为鉴别CRH/ACTH依赖性CS病因的重要试验。该试验的理论基础是CS患者对CRH/ACTH的负反馈调定点明显提高,故用LDDST不能抑制而用HDDST可抑制高皮质醇分泌状态。标准HDDST是每6小时口服DXM 2mg,共2天。正常人的尿17-OHCS排出量应下降50%。现改用血和尿游离皮质醇作为指标,抑制值仍为50%。结果主要受皮质醇基础分泌率的影响,基础皮质醇越高,抑制率也越高。如用药后相同时间点的血皮质醇抑制程度达到或超过基础值的50%可诊断Cushing病。本试验的特异性100%,敏感性92%。根据NIH的资料,将UFC作为观察指标,其特异性和敏感性均较17-OHCS高。当UFC抑制达90%,诊断Cushing病的特异性可达100%,敏感性达83%。有时,也行午夜大剂量DXM抑制试验,即于晚上11点口服DXM 8mg,并于当日晨8点和次晨8点采血测皮质醇和ACTH。
Cushing病呈阴性反应
部分Cushing病不能被DXM抑制的可能原因为:①DXM吸收不全;②DXM清除加速;③依从性差(患者未服药)。为了避免这些问题,静脉滴注DXM 1mg/h,持续5小时后皮质醇下降达到或超过基础值的50%,可诊断为Cushing病。有时,还可在此基础上作进一步改进,静脉滴注DXM 1mg/h,持续7小时后测定皮质醇较基础值降低190nmol/L(6.8μg/dl)或更多,可诊断Cushing病,其敏感性、特异性均较前提高。由于肿瘤异源分泌CRH,患者也偶尔呈阳性反应。
Hasinski等总结了午夜HDDST与LDDST和标准HDDST的诊断效率及实用价值,提出在LDDST基础上再行午夜HDDST较标准HDDST简便,具有更大的可行性。根据CRH/ACTH的依赖性并不能有效鉴别CS的病因,约90%的Cushing病和10%的异位CRH/ACTH分泌综合征呈HDDST阳性反应。例如,有50%的CRH/ACTH分泌性类癌表现为HDDST阳性,而垂体ACTH大腺瘤却不能被HDDST抑制。
其他动态试验鉴别CS病因
在特殊情况下,临床上需要应用其他动态试验协助CS的病因诊断,这些试验主要包括米非司酮(mifepristone,RU486)试验、CRH兴奋试验和ACTH兴奋试验、去氨加压素(desmopressin,DDAVP)试验、血管活性肠肽(VIP)和组氨酸-蛋氨酸肽(peptide histidine methionine)试验、GH释放肽(海沙瑞林)试验等。
米非司酮试验
米非司酮500mg,每6小时 1次,共4次,测24小时尿17-OHCS排泄量或者血11-去氧皮质醇的变化。在原发性肾上腺病变(如腺瘤或皮质癌)患者中,美替拉酮一般不引起尿17-OHCS排泄增加,并可能下降,这是因为:①慢性高皮质醇血症抑制下丘脑CRH和垂体ACTH合成与分泌,当美替拉酮诱发低皮质醇血症时,仅释放极少量ACTH;②即使大剂量ACTH刺激,肾上腺癌和约50%的肾上腺腺瘤也无反应;③长期ACTH缺乏,正常肾上腺组织处于萎缩状态,对刺激不能作出急性反应;④美替拉酮还抑制皮质醇合成的早期步骤。上述各种原因共同引起尿17-OHCS排泄减少。在Cushing病患者中,由于血皮质醇下降,对下丘脑、垂体的负反馈抑制作用减弱,导致血ACTH代偿性升高而使增生的肾上腺皮质合成更多的皮质醇,抵消早期美替拉酮对皮质醇合成的抑制作用而引起尿17-OHCS升高(2~4倍),血11-去氧皮质醇增加更明显。
尿17-OHCS升高超过基础值70%或血11-去氧皮质醇较基础值升高超过400倍,可作为诊断Cushing病的标准。Cushing病患者有约70%出现阳性反应,而异源性CRH/ ACTH患者无阳性反应。HDDST结合美替拉酮试验比结合CRH兴奋试验烦琐,且结果不如后者可靠。但美替拉酮和DXM价格便宜,临床应用广泛。尽管不作为首选方法,但当无CRH时,仍有相当价值。
CRH兴奋试验和ACTH兴奋试验
应用CRH后,血皮质醇较基础值升高达到或超过20%或ACTH较基础值升高达到或超过35%作为阳性。据报道,诊断意义最大的是CRH兴奋后15分钟的ACTH值,如≥27pg/ml(5.9pmol/ L)或皮质醇≥2.5μg/dl(70nmol/L)强烈提示CS。绝大部分Cushing病患者在注射CRH后10~15分钟呈阳性;7%~14%的患者对CRH刺激无外周血皮质醇或ACTH升高反应,而岩下窦所采血标本中,ACTH与外周血ACTH比例可升高3倍以上。绝大多数Cushing病对CRH无反应者可被HDDST抑制,但少数异源性CRH/ACTH分泌综合征(如支气管类癌)可被HDDST抑制且对CRH有反应,分析结果时应加以注意。结合HDDST和CRH兴奋试验一般能鉴别CRH/ACTH依赖性CS的病因。CRH的常见不良反应有短暂轻微的兴奋状态,面部轻微充血、潮红及口腔金属味,一般均能耐受。
用替可克肽(cosyntropin,人工合成的ACTH1~24肽)静脉注射或缓慢滴注后,Cushing病患者出现与正常相似的血皮质醇升高和UFC、17-OHCS排泄增多,或较正常升高更明显,提示肾上腺既不处于过度刺激状态,也无自主分泌功能。
去氨加压素试验
加压素的长效作用类似物——DDAVP与肾脏抗利尿激素受体(V2R)作用有相对特异性,只有轻微的V1R缩血管活性,因此建议将其作为CRH/ACTH依赖性CS病因鉴别的辅助方法。一般将血ACTH升高达到或超过35%作为阳性。给男性注射DDAVP后,在体内无促进ACTH释放活性。目前尚不能确定其是否具特异性V1b受体活性。静脉注射5~10μg去氨加压素使绝大部分Cushing病患者的血皮质醇较基值增加4倍以上(无反应者为分泌ACTH的嗜铬细胞瘤)。静脉注射10μg去氨加压素后,血皮质醇升高达到或超过20%,其敏感性及特异性不如CRH试验,但由于有些Cushing病患者仅对其中某个肽类激素起反应,故在特定情况下,去氨加压素试验或许有助于CRH/ ACTH依赖性CS的鉴别。另有报道,DDAVP试验鉴别单纯性肥胖、隐性异源性CRH/ACTH分泌综合征、肾上腺性CS 和Cushing病时,仅Cushing病患者呈阳性反应。由于部分Cushing病患者对CRH无反应,故应结合其他肽类激素试验,并对结果进行综合分析来作出判断。Dickstein等将静脉注射10U的AVP和静脉注射1μg/kg的绵羊CRH(ovine CRH,oCRH)联合应用,采血测血皮质醇和ACTH,仍以血皮质醇升高达到或超过20%,血ACTH升高达到或超过35%作为阳性判断指标。41例中有40例的皮质醇升高达到阳性标准,全部41例ACTH升高都为阳性,敏感性和特异性比单用CRH时高。因此,建议在标准CRH试验基础上再应用改良CRH试验,但AVP有缩血管和升高血压等不良反应,有血管病变者需谨慎使用。
Newell-Price等将组织学确诊的17例Cushing病和5例异源性CRH/ACTH分泌综合征患者进行去氨加压素联合CRH试验。静脉注射10μg去氨加压素和100μg CRH,观察用药后血皮质醇的变化。发现所有Cushing病患者血皮质醇升高均达到或超过39%,而异源性CRH/ACTH分泌综合征患者升高均低于29%,其诊断敏感性和特异性达100%,而且该试验无明显不良反应,但对鉴别异源性CRH/ACTH分泌综合征和Cushing病的准确性有待进一步证实。
血管活性肠肽和组氨酸-蛋氨酸肽试验
在正常人中可诱导ACTH或皮质醇释放反应。对CRH刺激有反应的Cushing病患者对血管活性肠肽和组氨酸-蛋氨酸肽(peptide histidine methionine)也有升高反应,而CRH刺激无反应的Cushing病患者无兴奋作用。
GH释放肽试验
海沙瑞林(hexarelin)为GH释放肽(growth hormone-releasing peptides,GHRPs)家族中的合成肽,可用于Cushing病的诊断,其促ACTH和皮质醇释放作用较CRH作用大。但在1例异源性CRH/ACTH分泌综合征患者也观察到皮质醇明显升高,程度甚至超过Cushing病患者,可能是肿瘤异源性表达生长激素相关肽(GH-related peptide,GHRP)受体所致。
双侧岩下窦采样诊断疑难Cushing病
从大规模实验和荟萃分析得出,上述试验方法均无法做到100%确定升高的ACTH是来源于垂体还是肿瘤异源性分泌,有时必须进行进一步的特殊辅助检查和有创检查。
原理和适应证
正常情况下,垂体静脉回流至海绵窦然后再到岩下窦,而正常岩下窦仅接受垂体静脉血液回流。因此,Cushing病患者中枢血ACTH浓度明显高于外周血浓度,而异源性CRH/ACTH分泌综合征患者无此变化。双侧岩下窦采样诊断疑难Cushing病的另一个目的是对垂体ACTH瘤进行精确定位,为选择手术方式提供依据。但由于ACTH呈脉冲式分泌,在基础状态下测定这种差别可能并不明显,必须结合CRH试验,比较注射前后中枢与外周血ACTH浓度差别,则诊断Cushing病的准确性明显提高。一般情况下,垂体血液引流呈对称性,因此左右两侧ACTH浓度差还可提示肿瘤位于垂体哪一侧。
方法
双侧岩下窦采样(bilateral inferior petrosal venous sinus sampling,BIPSS)时,双侧股静脉插管至岩下窦(经X线造影确定),另外再置一外周静脉插管,3个部位同时采血标本。在注射CRH前采血2~3次,测定ACTH作为基础值。然后静脉注射oCRH 1μg/kg体重或100μg,注药后2分钟、5分钟、10分钟、15分钟同时采双侧岩下窦血标本及外周血测ACTH(峰值一般在注射后3~5分钟出现)。注射oCRH后,BIPSS/外周血ACTH比值≥3,提示Cushing病。如先用美替拉酮处理再行CRH刺激能更进一步增加Cushing病患者的中枢/外周血的ACTH浓度差。
结果分析
观察发现,BIPSS联合CRH兴奋试验是鉴别CRH/ACTH依赖性CS的金标准。近年来又报道,在BIPSS同时做去氨加压素(desmopressin)试验可明显提高CRH/ACTH依赖性CS的鉴别效率,即增大中枢ACTH/周围ACTH的浓度梯度(由≥2.0增至3.0)和健侧ACTH/患侧ACTH的浓度梯度(≥1.4者由80%增至98%),异位CRH/ ACTH分泌综合征者无浓度梯度,而Cushing病的浓度梯度可达到诊断标准。
当岩下窦发育不良呈丛状时,BIPSS可能与外周血无明显差别而出现假阴性结果。由于CT、MRI对Cushing病肿瘤定位敏感性较低,有时呈假阴性,经对比发现,IPSS术前定位与最终病理证实的诊断符合率超过CT和MRI的定位符合率。BIPSS结合CRH、DDAVP试验是鉴别CRH/ACTH依赖性CS的有效方法,能提高诊断准确性。IPSS及外周血比较ACTH的浓度差,对判断中枢ACTH来源很有意义。在出现oCRH无反应的IPSS阴性结果时,仍不能完全排除Cushing病;仅双侧岩窦内ACTH浓度差不足以确定肿瘤位于垂体哪一侧。值得注意的是,IPSS测定ACTH并不能鉴别轻度CS、周期性CS、假CS和正常人。药物治疗可影响IPSS的正确定位,因此BIPSS仅适于有明显临床生化异常且未经药物治疗的CRH/ACTH依赖性CS患者。BIPSS的并发症主要有蛛网膜下静脉出血、下肢远端深静脉血栓栓塞、感染、脑干梗死、脑桥出血、垂体损伤等。
海绵窦/胸腺静脉/肾上腺-卵巢静脉采样诊断Cushing病
用海绵窦直接采血(cavernous sinus sampling)取代BIPSS可增加诊断准确性,避免应用CRH。胸腺静脉采样(thymic veins sampling)的原理是因为胸腺增生是肾上腺切除后的常见并发症,且可自动恢复。对肾上腺切除后CS复发的病例,有时需与分泌CRH/ACTH的胸腺瘤鉴别。鉴别的最有效方法是胸腺静脉采样。肾上腺-卵巢静脉采样鉴别非典型的肾上腺皮质增生与PCOS选择性肾上腺和卵巢静脉采样对于明确隐性雄激素分泌过多(cryptic androgen excess)也有一定意义。
核素显像定位异位CRH/ACTH分泌瘤
由于很多神经内分泌肿瘤细胞表面都有生长抑素受体,故111In标记的奥曲肽核素显像可用于受体阳性的异源分泌CRH/ACTH肿瘤的定位。有人报道,在451例类癌患者中有86%检测到异源分泌CRH/ACTH的肿瘤。
CT/MRI确定病变性质及部位
CT和MRI等影像检查发现垂体肿瘤和体积增大有助于CRH/ACTH依赖性CS,特别是垂体ACTH分泌瘤的诊断。但是要注意两点,一是当病程较长时,异位CRH分泌综合征亦可有垂体肿瘤和体积增大;二是垂体ACTH分泌瘤可在双侧肾上腺增生的基础上发生结节,有时甚至出现瘤样结节。此时应注意与肾上腺肿瘤鉴别,其中血ACTH水平是鉴别的最关键指标。
垂体
在CRH/ACTH依赖性CS患者中,垂体影像检查的目的在于确定垂体腺瘤的位置和大小。目前蝶鞍侧位X线摄片和正侧位体层摄片列为CS患者的常规检查。由于80%以上的垂体ACTH瘤均为微腺瘤,因此蝶鞍摄片很少发现垂体异常,只有大腺瘤时才有可能在X线片上发现蝶鞍体积增大、鞍底双边及鞍背直立等异常征象。CT扫描垂体瘤的发现率明显高于X线检查。可做蝶鞍部的CT冠状位扫描,以2mm的薄层切面加造影剂增强及矢状位重建等方法,使CT扫描的敏感性提高50%左右。CT成像常发现低密度灶,且不被增强。MRI在发现垂体ACTH微腺瘤时敏感性较CT稍高(50%~60%)。要注意鞍区局部薄层扫描以提高微腺瘤的发现率。在MRI上,此种微腺瘤表现为低强度信号,不能被钆(gadolinium,Gad)增强。约5%的垂体微腺瘤可以吸收钆,在MRI呈中等强度信号,故增强扫描前必须先扫描成像作为对比之用。
如果MRI能清晰发现肿瘤,则与术中发现定位符合率达75%~98%,与BIPSS定位法相似或略占优势。但MRI不可能在术前发现所有垂体微腺瘤并准确定位。选择性岩下窦采样测定ACTH有助于Cushing病及异位CRH/ACTH分泌综合征的鉴别。此外,近年来发展了术中超声定位和术中分段采血测ACTH浓度以提高定位的准确性。用18F标记的脱氧葡萄糖(18F-DG)可测量脑的葡萄糖代谢状况,Cushing病患者的脑葡萄糖代谢降低。由于可能出现假阳性结果,任何影像学检查结果都必须与生化功能检查同时进行,综合分析。
蝶鞍MRI的敏感性高达90%以上。MRI不能发现垂体ACTH瘤的原因是:①微腺瘤完全位于垂体组织内;②MRI视野强度(field strength)与显影时间;③技术条件(首选脉冲连续方式);④阅片经验。在对比增强T1-加权-自旋回波影像上,常无信号强度。此时,用T2加权可发现病灶。或使用动态MRI,但注入造影剂后的显影时间是提高阳性率的关键因素。
肾上腺
肾上腺影像学检查在诊断工作中占有重要地位,可选B超、CT、MRI及核素扫描检查。B超对肾上腺体积增大的CS有定位诊断价值。一般肾上腺腺瘤直径>1.5cm,而皮质癌体积更大,均在B超敏感检出范围内。此方法操作简便、价廉、无损伤,且在各级医院普及,但B超敏感性较低,未发现结节不能排除肾上腺病变。
1、单侧肾上腺病变
绝大部分肾上腺肿瘤可在薄层CT扫描或MRI中发现。由于CT或MRI较131I标记胆固醇扫描费时少,费用低,故一般先选CT。Fig等总结肾上腺CT扫描鉴别14例肾上腺癌和70例肾上腺腺瘤引起的CS患者,其正确率达100%。当CT不能清楚地鉴别肾上腺肿块时,可用T2加权相MRI将肾上腺癌与腺瘤区别开,但并不能鉴别无功能腺瘤(意外瘤)和高功能腺瘤。由于单侧分泌皮质醇的肾上腺肿瘤导致ACTH分泌抑制,使同侧和对侧肾上腺皮质萎缩。只要影像学显示有肾上腺皮质萎缩,就要考虑存在高功能腺瘤或非对称大结节性肾上腺增生的可能。在临床上,分析肾上腺病变的另一个要点是比较两侧肾上腺的体积差别,如果相差悬殊,即使未发现明确的病变,亦应高度考虑体积较大的一侧存在异常(增生或为腺瘤),这一方法似乎比寻找模棱两可的病变更可靠。
碘标记胆固醇肾上腺皮质核素扫描是通过向受检者静脉注入131I-6β-甲基降胆固醇(NP59)后,对肾上腺区域进行的扫描检查。131I标记胆固醇可浓集于肾上腺肿瘤区域。核素扫描呈现高密度区域,可用于判断肾上腺皮质腺瘤或腺癌的准确部位及功能状态。一侧肾上腺发现肿瘤,对侧肾上腺往往不显影;两侧均有核素密集,则提示肾上腺双侧增生性改变。有的腺癌可双侧均不显影,可能因为肿瘤破坏了患侧肾上腺,使其丧失聚集放射性胆固醇的功能,而对侧肾上腺仍呈萎缩状态,故可能漏诊肾上腺皮质癌。目前,核素扫描检查不如CT应用普遍。要注意下列病变在CT增强扫描、MRI影像特点并进行鉴别:急性肾上腺出血、肾上腺髓质瘤、肾上腺囊肿、肾上腺腺瘤、肾上腺癌、肾上腺结节性增生、肾上腺肉芽肿性增生。主要肾上腺皮质病变的鉴别要点见下表。
肾上腺皮质病变的鉴别:
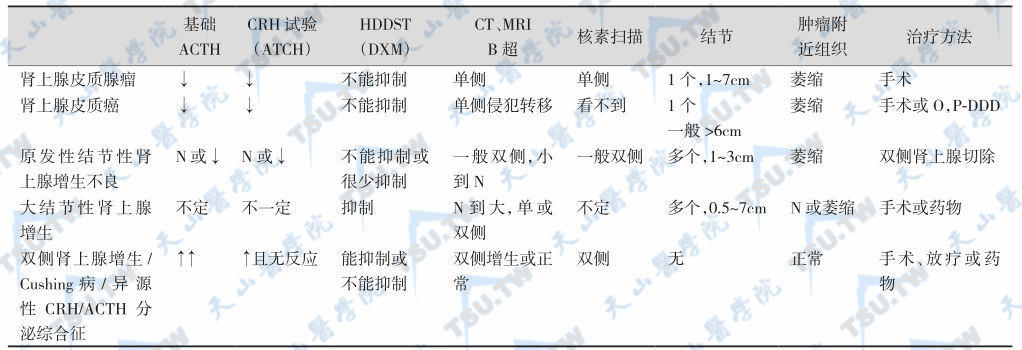
注:N:正常;↓:降低;↑:升高
2、双侧肾上腺病变
双侧肾上腺病变有多种可能:①继发性双侧肾上腺弥漫性增生(常见);②原发性双侧肾上腺腺瘤(结节)样增生(少见);③原发性双侧肾上腺转移癌(罕见);④原发性双侧肾上腺腺瘤(罕见)。CT、MRI等检查对仅表现为肾上腺腺瘤改变的双侧肾上腺病变的诊断有一定价值。少数情况下,非CRH/ACTH依赖性广泛大结节性肾上腺增生(重69~149g)可能在影像学上完全替代正常双侧肾上腺,而BIPSS缺乏中枢/外周血ACTH浓度显著差别,垂体MRI又未发现腺瘤时,此时则应考虑原发性双侧肾上腺增生。肾上腺大结节性增生偶有可能发生于Cushing病患者,要注意全面检查,综合分析,避免误诊和漏诊。此外,所有CRH/ACTH依赖性CS患者可表现为双侧或单侧肾上腺增生,伴或不伴结节。此时前面所述的仔细详尽的生化检查、功能评价就显得格外重要。
3、肾上腺意外瘤
可从以下3个方面来进行评价:①如临床上有部分症状和体征,应确立其与意外瘤的因果关系,分别排除皮质醇瘤、嗜铬细胞瘤和醛固酮瘤可能。②意外瘤的进一步评价分形态和功能两个方面;CT值(Hu)和增强显影对腺瘤的鉴别意义大于结节的大小。③临床上有高血压时,要根据具体情况,进行皮质醇瘤、嗜铬细胞瘤和醛固酮瘤必要检查;如仅有肥胖,要重点排除CS;如有低钾血症,应着重进行醛固酮瘤方面的检查。
其他器官
对疑有异源性CRH/ACTH分泌综合征的患者,应努力寻找原发肿瘤。异源性分泌CRH/ACTH肿瘤位于胸腔的比例较高,最常见的是小细胞肺癌和支气管类癌。如果常规行胸部正侧位X线片为阴性,应强调胸部薄层CT检查的重要性,高分辨CT在薄层扫描时一般能发现微小肿瘤。如果胸部检查仍为阴性,可依次作111In-奥曲肽显像、18F-PET、胃肠、腹腔、盆腔的影像检查。
