先天性肾上腺皮质增生症(congenital adrenal hyperplasia,CAH)是一组由编码皮质激素合成必需酶基因突变致肾上腺皮质类固醇激素合成障碍所引起的疾病,为常染色体隐性遗传。其主要病因为在皮质醇合成过程中,由于酶缺陷引起皮质醇合成不足,继发下丘脑CRH和垂体ACTH代偿性分泌增加,导致肾上腺皮质增生。肾上腺皮质合成3种激素所涉及的酶依次为20,22碳裂链酶、17α-羟化酶(CYP17)、3β-羟类固醇脱氢酶(3β-HSD)、21-羟化酶(CYP21)、11β-羟化酶(CYP11B),其中前3种与3种肾上腺皮质激素合成有关;后两种酶与皮质醇和醛固酮合成有关,醛固酮合成还需要18-羟化酶和18-氧化酶的参与。前述的酶缺陷(活性减低或缺如)均可导致CAH,但临床表现有所不同,总称为CAH。
临床上,以21-羟化酶缺陷症最常见,约占90%以上,CYP11缺陷症次之,占5%~8%;再其次是3β-HSD缺陷症,而CYP17缺陷症和类固醇激素急性调节蛋白(steroid acute regulatory protein,StAR)缺陷症非常罕见。
21-羟化酶缺陷症
肾上腺皮质激素的前体物质为胆固醇,从胆固醇到皮质醇的生物合成需要胆固醇20,22裂链酶、CYP21、CYP11B、3β-HSD和CYP17的参与。这些酶除了3β-HSD外,都属于细胞色素氧化酶P450(cytochrome P450,CYP)系。编码这些酶基因中的任何一个发生突变都可导致酶活性缺陷,临床上引起不同类型的CAH。不论是何种酶缺陷均可导致垂体ACTH代偿性分泌增加,使双侧肾上腺皮质增生。CYP17和3β-HSD缺陷可导致肾上腺皮质3种激素均缺乏,CYP21和CYP11B缺陷则只有皮质醇和醛固酮合成减少,而性激素合成增多,故可在临床上引起男性假性性早熟或女性男性化。CYP18和18-氧化酶缺陷症则只有醛固酮减少,皮质醇和性激素合成正常。
CYP21缺陷症是CAH的最常见类型,经典型(classical type)CYP21缺陷症的发病率约1.1/10万,相应的杂合子发生率为1.64%,基因频率为0.0082。非经典型(non-classical type)CYP21缺陷症的发病率远较经典型CYP21缺陷症高,如意大利人的发病率为33%,杂合子发生率为1.1%(1/9),基因频率为0.058;美国纽约居民的发病率为1‰,杂合子发生率为1.67%(1/6),基因频率为0.100。我国台湾省的CYP21缺陷症发病率为3.5/10万,杂合子发生率为1.2%,基因频率为0.100。CYP21缺陷症是由于CYP21基因突变致CYP21功能缺陷所致。
CYP21突变导致21-羟化酶活性降低
人类有两个CYP21基因,即活性CYP21B基因和无活性的CYP21假基因(CYP21A,CYP21P),CYP21A假基因(CYP pseudogene)是由于人类进化过程中CYP21A基因启动子、外显子Ⅰ、外显子Ⅲ、外显子Ⅴ、外显子Ⅵ至Ⅷ和内含子Ⅱ突变所致。CYP21B和CYP21A基因之间有高度同源性,呈串联排列于HLA Ⅲ型区域的C4A/C4B、XA/XB、YA/YB基因之间,定位于第6号染色体短臂。HLA-B、DR和CYP21基因位点之间紧密连锁,因此可用HLA分型对CYP21缺陷症患者进行基因分型。致病基因为CYP21,活性CYP21B基因和无活性的CYP21假基因均位于染色体6p21.3,HLA主要组织相容性复合物中,与补体C4A和C4B相邻。由于其基因结构和位置的特殊性,常因与CYP21P之间的发生的基因重组或转换,使CYP21基因比较容易发生突变,且突变大多来源于CYP21P。如果基因突变使21羟化酶的活性保留20%~50%,具有理糖和理盐活性的肾上腺皮质激素合成即可维持生理所需,不足以引起失盐表现,临床表现为非经典型21α羟化酶缺乏症。白种人中的非经典型突变位点有L281V、S453和P30L等。亚洲人则以P30L最常见。启动子区域突变对基因表达的调控产生影响,降低21-羟化酶活性。研究显示,约75%的患者为复合杂合突变(同时携带重型和轻型突变位点)。CYP21B基因突变分析可证实或预示CYP21B基因表达缺陷,为CYP21缺陷症患者提供了诊断和临床分型的依据。21-羟化酶缺陷症的CYP21A2新突变包括P.177T、PL167P、P.1230T、P.R233K、P.G291S、P.G282D、P.E320K、P.R341P、P.R354H、P.R369W、P.R408C、P.G424S和P.R426H。
在失盐型(salt-wasting,SW)患者有56%等位基因外显子Ⅲ5′端上游内含子Ⅱ第13个碱基有点突变(C→G)。单纯男性化型(simple virilizing)CYP21缺陷症患者最常见的等位基因突变(35%)为Ile172Asn置换。在症状较轻的非经典型CYP21缺陷症患者中以Val281Leu突变最常见(39%)。89%的CYP21缺陷症的基因型与临床表型相符,其余11%患者由于基因分型方法不标准或临床分型不确定致两者不符。尽管如此,CYP21B突变基因型分子谱与CYP21缺陷症临床表型谱仍高度吻合,因而基因分析对CYP21缺陷症患者基因型诊断和胎儿产前患病危险率估计和CAH类型鉴别均有重要意义。CYP21缺陷症基因突变与酶活性及临床表型之间的关系见下表。
21-羟化酶缺陷症基因突变与酶活性
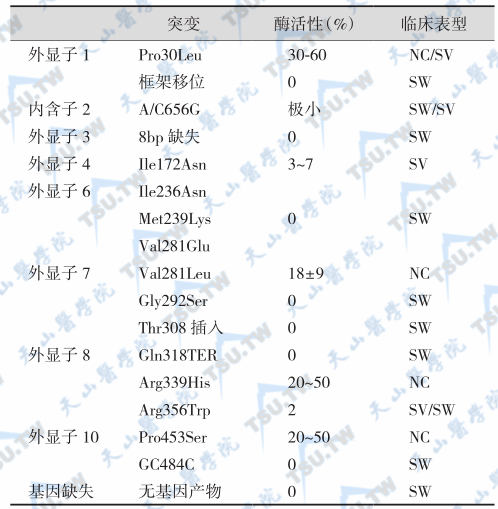
注:SW:失盐型;SV:单纯男性化型;NC:非经典型
21-羟化酶活性降低导致皮质醇减少。在CYP21缺陷症患者中,由于CYP21活性降低或丧失,孕酮和17-羟孕酮不能被转化为DOC和11-去氧皮质醇,皮质醇合成减少,其对下丘脑和腺垂体的反馈抑制作用减弱,ACTH分泌增加,刺激肾上腺皮质(主要为束状带)增生,产生过量的11-去氧皮质酮和11-去氧皮质醇,一部分则通过17-羟孕酮/17,20-裂链酶转而进入雄激素合成途径。若CYP21完全缺乏,则皮质醇分泌绝对不足;若缺陷不完全,则可通过ACTH分泌增加,代偿性使皮质醇的分泌达正常,但肾上腺增生,且在应激时出现缺乏症状。
经典失盐型以盐皮质醇缺乏/性发育障碍和雄激素增多为特征
根据临床表现严重程度可分为极度严重经典型、中度严重型及轻度型3种。极度严重经典型和中度严重型又合称为经典型,轻度型称非经典型,见下图。17-羟孕酮是诊断21-羟化酶缺陷症的最主要指标,一般建议用质谱法测定。在一般情况下,21-羟化酶缺陷症可用17-羟孕酮和雄烯二酮及皮质醇测定作出诊断。但17-羟化酶缺陷和11β-羟化酶缺陷患者的17-羟孕酮与雄烯二酮可正常或轻度升高,此时需要测定孕酮与去氧皮质酮才能做出诊断。
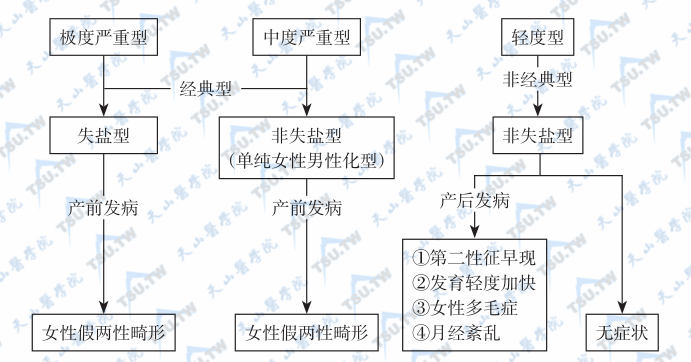
21-羟化酶缺陷症的临床分型
经典失盐型以盐皮质醇缺乏症(classic salt-wasting CAH)是由于21-羟化酶的活性完全缺乏,皮质醇和醛固酮缺乏以及胎儿早期雄激素分泌过多所致。胎儿期起病,出生后表现为皮质醇缺乏症群,女性新生儿的外生殖器男性化,并伴失盐症群(75%)。由于肾小管潴钠和排钾功能障碍,可出现低钠血症、高钾血症和代谢性酸中毒;某些患者因皮质醇缺乏可出现低血糖症,甚至肾上腺皮质功能减低危象。
新生儿肾上腺危象表现为拒食、昏睡、呕吐、腹泻、脱水、低血压和体重锐减等,其症状和体征在血钠>125mmol/L时可能不明显,若不积极治疗,大部分失盐型患者在1~4周龄时逐渐发展,直至死亡。而醛固酮缺乏可随年龄的增长而逐渐好转,肾脏保钠功能增强,血钠逐渐升高,但仍低于正常。未经治疗的失盐型CYP21缺陷症患者血清醛固酮低于正常(<50~250ng/dl),伴血浆PRA增高。血17-羟孕酮和雄烯二酮基础值或ACTH兴奋后增高。血和尿DHEA和DHEA硫酸盐(DHEAS)增高(经典型CYP21缺陷症除外),然而所有经典型CYP21缺陷症尿孕三醇和17-KS均明显增高。因为胎儿期期肾上腺髓质发育障碍,经典型CAH患者伴有髓质功能不全(adrenomedullary insufficiency)和髓质激素合成异常的表现,血和尿肾上腺素、甲氧肾上腺素(methoxy adrenaline,metanephrines)降低,抗应激能力下降。此外,患者的直立性低血压、低血糖症也可能与肾上腺髓质功能不全有关。新生儿患者由于肝脏发育不完全,孕三醇可正常,经典型CYP21缺陷症患者的血清睾酮增高。男性患者在婴儿期(出生~5.5个月)、青春期和成年期的血睾酮正常。此外,经典型CAH是代谢综合征的危险因素,高雄激素血症和糖皮质激素补充治疗过程中不可避免出现的高皮质醇血症,使患者的体重和体脂比例增加,并伴有胰岛素抵抗和血脂谱异常。
成年男性CAH患者特别容易发生睾丸的肾上腺残余组织肿瘤(testicular adrenal rest tumour,ART)和男性不育症。ART主要位于肾上腺附近或睾丸下降的胚胎途径中,如腹腔血管丛、阔韧带、精索、睾丸或卵巢(女性)及肾脏。未经治疗者,睾丸ART在高ACTH血症的刺激下,容易恶变。男性不育的主要原因有:①雄激素被过度芳香化,生成的过量雌激素抑制垂体LH分泌,临床表现为低促性腺激素性性腺功能减退症;②合并有胰岛素抵抗及代谢综合征;③睾丸体积缩小。值得注意的是,肾上腺肿瘤与CAH的关系密切,相互影响。因此,成年CAH患者特别容易发生肾上腺肿瘤,这种肿瘤的特点是经糖皮质激素补充治疗后可缩小。同样,患有肾上腺肿瘤者应注意排查CAH。
中度单纯性男性化型缺乏失盐和皮质醇不足表现
经典单纯雄性化CAH(classic simple virilising CAH)患者的21-羟化酶有1%~2%的生物活性。虽然存在生化和生理意义上的皮质醇缺乏,但临床上没有皮质醇缺乏的典型症状,而仅代之以女性雄性化;但如果在胎儿期起病,出生后可有轻度表现为皮质醇缺乏症群,女性新生儿外生殖器男性化明显。由于醛固酮的合成基本不受影响,加上肾脏的保钠功能良好,故无失盐表现,但可出现轻度血浆PRA增高。
外生殖器的分化过程对雄激素非常敏感,胚胎期生成的大量睾酮可使女性胎儿男性化,生殖结节和阴蒂肥大,严重时与正常男性的阴茎难以区分;阴唇阴囊皱襞可部分或完全融合。如男性化程度较轻,阴唇阴囊皱襞未融合,尿道和阴道分别开口;如有部分融合,则尿道口和阴道口前移,均开口于泌尿生殖窦中;如完全融合,则形成阴囊样结构,酷似男性尿道下裂,甚至尿道可以完全通过增大的阴蒂,开口在龟头样结构的顶部,与正常男性的阴茎结构极为相似。由于这些女性患者的外生殖器很难与男性隐睾区分,有时被错作男性抚养。尽管女性生殖器发育有不同程度的畸形,但性腺和内生殖器发育正常,无睾丸,故称为性发育障碍(disorders of sex development,DSD),即XX-DSD(女性假两性畸形)。予适当的糖皮质激素替代治疗和外生殖器修复术后可生育,
- 婴幼儿期:严重的女性男性化在出生后常被误认为是男婴。男性患儿在出生时外生殖器一般无异常,少数的阴茎稍大,内生殖器发育正常。男性患者和非失盐型患者的女性男性化不易引起注意,常因出现阴茎和阴蒂肥大、生长过快及性毛早现等男性假性性早熟(但睾丸很小)才被诊断。
- 儿童期:患儿在儿童期生长加速,肌肉较发达,骨骼成熟加速,骨龄超前,骨骺提前融合,但最终身高却不及正常成人。如未用糖皮质激素治疗,一般不出现正常青春期发育。女性患者月经稀发、不规则或闭经,多数患者不育,肌肉亦较发达,嗓音变粗,出现痤疮、喉结、多毛甚至胡须,阴毛和腋毛提早出现。男性患者通常存在小睾丸和生精障碍而致不育,少数患者的睾丸发育和生育能力正常。
- 青春期前及青春期:在青春期前及青春期,垂体促性腺激素对GnRH的反应可正常。据报道,经治疗的经典型女性患者60%有生育能力,失盐型女性患者一般生育力下降。此外,由于ACTH过度分泌,患者可有皮肤色素沉着。非经典型21-羟化酶缺陷症的生育能力轻度降低。
- 成年期:因为卵巢或睾丸的发育障碍,未经治疗的男性和女性均无生育功能。成年期女性的性腺从假性两性畸形和假性性早熟转向闭经、卵巢发育不全和男性化,但乳腺萎缩伴骨盆狭窄。成年期男性的性腺功能减退,由于高雄激素长期抑制LH和FSH的分泌,睾丸不能发育成熟,表现为阴茎正常或增大而睾丸细小,坚硬,前列腺发育不良。如果睾丸亦增大,应警惕睾丸肾上腺组织残余肿瘤(testicular adrenal rest tumor)或睾丸肿瘤可能,两者的鉴别是在使用糖皮质激素后,随着肾上腺的退缩,睾丸亦缩小能证明为残留肾上腺组织;否则为睾丸肿瘤。因为有肾上腺雄激素的作用,故男性第二性征存在,有时甚至表现有毛发增多,但患者的身材矮小,多伴有中心性肥胖、高血压、胰岛素抵抗甚至2型糖尿病等代谢综合征的表现,但血清尿酸和同型半胱氨酸不高。
如果能早期接受治疗,非经典型21-羟化酶缺陷症患者的生育能力可基本正常或轻度下降。但是严重失盐型患者即使早期治疗,其生育能力亦难以维持正常。
轻型仅表现性毛早现/痤疮多毛/生长加速/阴蒂肥大/月经紊乱
非经典型CAH(non-classic CAH)患者的21-羟化酶活性保存20%~50%,发病时间较晚(多见于年长儿童或青春期),因肾上腺过度增生代偿皮质醇不足,同时出现轻度的雄激素分泌过多。出生时,女性患者的外生殖器正常;在童年期或成年期因轻度雄激素过多症状和体征而被诊断。童年期可有性毛早现、痤疮、生长轻度加速和阴蒂轻度肥大;至青春期或成年期可有多毛症、囊性痤疮、月经紊乱和不育等(迟发型或非经典型),少数患者无雄激素过多症状(隐匿性非经典型)。男性患者可无症状或症状较轻,可出现青春发育提前、性毛早现、痤疮和生长轻度加速,但成年后身材较矮,伴生精障碍和生育能力下降。在青春期前,非经典型的症状轻微,少数患者可有出生后阴蒂轻度增大及儿童期生长加速。在应激状态下,也不出现肾上腺功能不全的表现。
性毛早现可作为重要的提示症状。青春期或成年女性的临床表现与其他原因引起的高雄激素血症如多囊卵巢综合征很相似,如多毛、痤疮、脂溢性皮炎、秃顶、多囊卵巢等。有的患者表现为月经紊乱或不育。与多囊卵巢综合征比较,两者在年龄、BMI、腰臀比、多毛评分及痤疮发生率等多项指标并无明显区别,但轻度CYP21缺陷症患者的症状随年龄增长而逐渐加重。部分患者无高雄激素血症表现,仅因家系调查或体检偶然发现(“隐匿型CYP21缺陷症”)。
部分患者(5%~20%)的性毛初现提前与迟发型先天性肾上腺皮质增生症(late-onset congenital adrenal hyperplasia,LOCAH)相关,在以后发生LO-CAH的患者中,基础血17-OHP、 δ4-雄烯二酮(androstenedione)和睾酮升高;如果17-OHP高于2ng/ml即应诊断为LO-CAH(敏感性100%,特异性99%),并行ACTH试验予以鉴别。此外,外周组织对胰岛素的敏感性下降而导致高胰岛素血症,其与慢性高雄激素血症相互加重,形成恶性循环。
轻度CYP21缺陷症女性患者若无多囊卵巢,糖皮质激素替代治疗可使Δ4-A和睾酮正常;若并发多囊卵巢,仅能部分抑制。婴儿期、青春期或成年期的轻度CYP21缺陷症患者血睾酮基础值和ACTH刺激后均正常。轻度CYP21缺陷症患者的17α-羟孕烯醇酮(Δ5-17P)、DHEA、DHEAS基础值、尿孕三醇和17-KS均正常。快速ACTH兴奋试验正常反应值见表3-15-21。女性轻度CYP21缺陷症或迟发型先天性肾上增生症与多囊卵巢综合征(PCOS)的临床表现可能混淆,但PCOS患者的月经初潮可正常,无假性性早熟表现,血浆ACTH和17-羟孕酮水平正常,且有卵巢多囊样改变。
从性发育障碍/失盐症群/低血压病例中筛查CYP21缺陷症
随着年龄增长,雄激素过多症状和体征逐渐明显而较易被诊断。血浆17-羟孕酮、DHEAS、雄烯二酮和孕酮增高。实验室检查17-羟孕酮基础值或ACTH兴奋后均增高;尿17-KS或17-羟孕酮的测定也有助于诊断。3β-HSD缺陷症一般可通过临床症状和血浆或尿Δ5/Δ4激素比值明显增高来诊断,ACTH兴奋试验对病情估计有一定意义。
对患病胎儿进行产前治疗阻止外生殖器男性化,避免产后手术治疗。产前诊断可在怀孕后立即或第1个三月期间进行。准确的CAH产前预测要求正确的基因分型(包括父母)和正确的临床表型估计。在第1个三月期,妊娠期9周或以后的绒毛膜活检采样(chorionic villus biopsy sampling,CVS)安全有效,但此时已经错过最佳治疗时机。第1个三月期诊断仅适用于在CVS执行前需进行CAH产前治疗的患者。第2个三月期诊断以怀孕第14周或以后行羊膜腔穿刺术较安全。CAH产前诊断方法可按美国儿科遗传学委员会的指南(2006年)进行,主要进行3种检测:①CVS或取胎儿细胞培养进行HLA分型;②胎儿细胞DNA提取后进行CYP21B基因分析;③羊水17-羟孕酮和雄烯二酮测定。同时进行OGTT的目的是监测怀孕母亲是否发生类固醇性糖尿病。CYP21缺陷症产前诊断和治疗流程见下图。CAH的新生儿筛选应在出生后2~4天进行。可取足跟血斑(滤纸过滤)测定17α-羟孕酮(17α-hydroxyprogesterone,17-OHP),但早产儿的血17-OHP可升高,应注意鉴别。
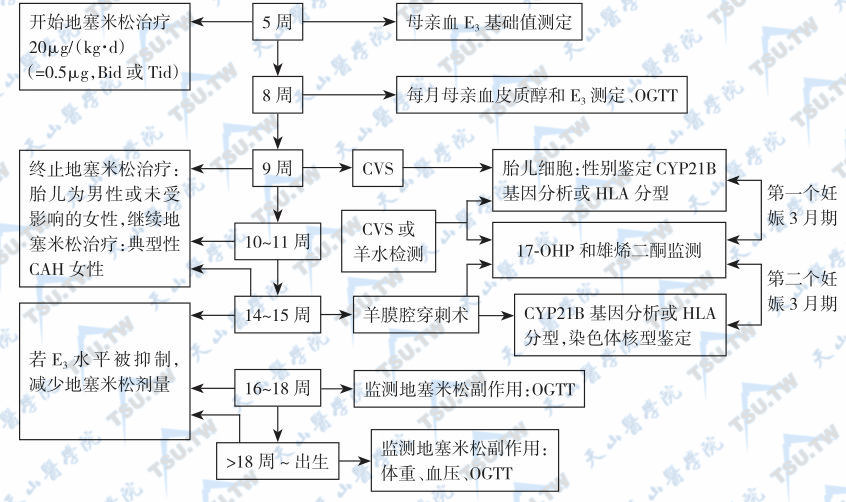
21-羟化酶缺陷症的产前诊断和治疗方案
注:E3:雌三醇;CVS:绒毛膜活检;OGTT:口服葡萄糖耐量试验;CAH:先天性肾上腺皮质增生症
CYP21基因位点和HLA-B、DR位点连锁,可通过HLA分型来预测胎儿CYP21缺陷症。若胎儿两个等位基因上HLA-B和DR抗原单体型与CYP21缺陷症符合,可预测该胎儿为CAH,若胎儿1个等位基因上HLA-B和DR抗原与CAH符合,可预测胎儿是CAH携带者;若胎儿HLA-B和DR单体型与CAH不符,可预测胎儿正常。胎儿细胞HLA分型连锁分析对CYP21缺陷症胎儿基因分型可靠,与CYP21B基因分析相比,HLA分型检测简单而便宜,其缺点是:①不能认识致病的分子病因;②胎儿细胞培养困难;③若父母间HLA抗原为纯合子,则不能预测CAH基因分型;④胎儿HLA-B和DR位点间的重组将导致HLA分析困难。
羊水17-羟孕酮和雄烯二酮预测失盐型CYP21缺陷症
若为非失盐型或临床表型不明确,应同时作激素测定、HLA分型和CYP21B基因分析才能确定其分型。CAH新生儿筛查主要用于典型CYP21D缺陷症,可防止发生肾上腺皮质功能减退危象、女性新生儿男性化及过量肾上腺雄激素后果。由于CYP21缺乏患儿血液中17-羟孕酮增加,因此血17-羟孕酮测定可检出CAH(70%),对另外的30%病例也有一定的诊断意义,可避免失盐型CYP21D缺陷症发生肾上腺危象和严重的女性男性化。筛查方法有RIA及ELISA法,RIA只需<20μl血液,其标本可于出生后第3~5天从足跟穿刺而得,并可同时筛查苯丙酮尿症和先天性甲减。上午8时的唾液17-羟孕酮也可筛查出典型CYP21D缺陷症,但标本收集较困难。
正常新生儿脐血17-羟孕酮为60.4pg/3mm斑(28~112pg),毛细血管血标本17-羟孕酮为0~9.4pg/3mm斑。出生后,17-羟孕酮血浓度迅速下降,至24小时平均降至30ng/dl,故出生后24小时内采血会导致假阴性结果,而早产儿、低体重儿和有围生期并发症者的17-羟孕酮测定假阳性较高,可能是由于肝功能不成熟,17-羟孕酮代谢清除率低所致。新生儿血清17-羟孕酮增高的诊治方案见下图。变性HPLC (DHPLC)是筛选CYP21A2基因突变的可靠方法。
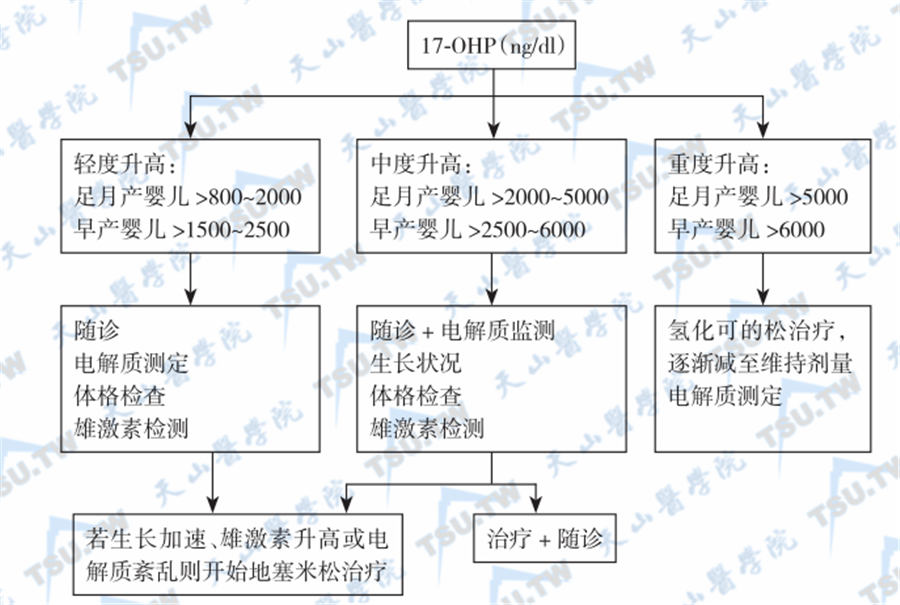
新生儿血清17-羟孕酮水平增高的诊治方案
根据临床表现和辅助检查鉴别CAH及其亚型
1、确定双侧肾上腺增生的病因
引起双侧肾上腺肿大的疾病有:①CAH;②非CRH/ACTH依赖性大结节增生所致的Cushing综合征;③X-性连锁先天性肾上腺发育不良(AHC),多数无双侧肾上腺肿大,少数因ACTH刺激而使双侧肾上腺增生;④双侧多发性肿瘤(以转移癌可能性大,原发性肾上腺双侧多发性肿瘤罕见);⑤特殊感染(如结核或AIDS)。先天性肾上腺皮质增生的原因是ACTH过度分泌,所以如果血清ACTH正常或降低即可排除之。
2、鉴别CAH类型
因为临床上以CYP21缺陷症最常见(90%以上),如果患者的双侧肾上腺增生且有高血压,而血清17-OHP明显升高,那么即可基本上确定为CYP21缺陷症。如果非经典型CYP21的缺陷症皮质醇和ACTH正常,就不会出现显著肾上腺皮质增生和高DHEA/DHEAS分泌现象;因此,肾上腺雄激素大量分泌提示CYP21缺陷症且存在皮质醇的代偿不全,患者至少在急性应激时出现相对性皮质醇不足表现。
3、确定CYP21缺陷症亚型
根据各类型CAH的临床表现和实验室检查(下表)可鉴别CYP21缺陷症的3种亚型。17-羟孕酮是诊断21-羟化酶缺陷症的最主要指标,一般建议用质谱法测定。在一般情况下,21-羟化酶缺陷症可用17-羟孕酮和雄烯二酮及皮质醇测定作出诊断(下图)。但17-羟化酶缺陷症和11β-羟化酶缺陷症患者的17-羟孕酮与雄烯二酮可正常或轻度升高,此时需要测定孕酮与去氧皮质酮才能做出诊断。
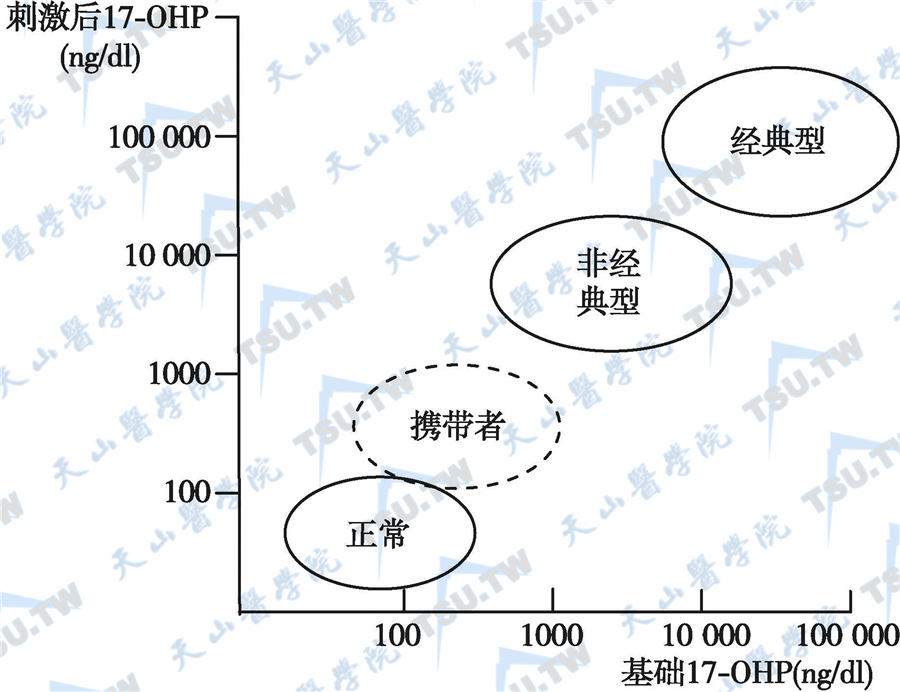
合成促皮质素静注前和60分钟后的血清17-OHP变化
注:17-OHP是诊断21-羟化酶缺陷症的理想指标,静脉注射cosyntropin 0.25mg前与60分钟后,仅21-羟化酶基因突变携带者与正常人有重叠
鉴别各种酶缺乏所致的先天性肾上腺皮质增生症需要做ACTH兴奋试验。一般要求测定17-OHP、皮质醇、去氧皮质酮、11-去氧皮质醇、17-羟孕烯醇酮、脱氢异雄酮和雄烯二酮。婴幼儿采血困难时,可只测定静注替可克肽后60分钟的17-OHP、皮质醇和雄烯二酮。
CAH各类型的临床表现鉴别:

CAH各类型实验室鉴别:
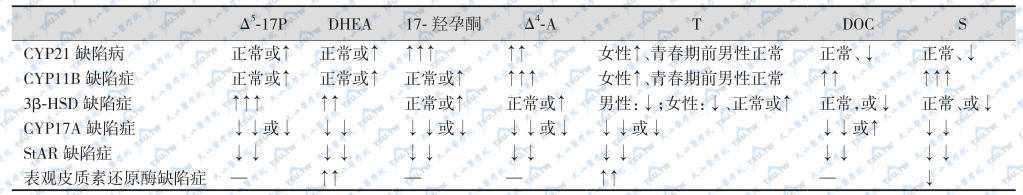
注:DOC:11-去氧皮质酮;Δ5-17P:17α-羟孕烯醇酮;17-OHP:17-羟孕酮;Δ4-A:雄烯二酮;T:睾酮;S:11-去氧皮质醇;DHEA:去氢异雄酮;↑:升高;↑↑:明显升高;↑↑↑:显著升高;↓:下降;↓↓:明显下降
GC替代/补充治疗与抑制性GC补充治疗的区别:

APS:autoimmune polyendocrinopathy syndrome,自身免疫性多内分泌腺病综合征;AHC:X-性连锁先天性肾上腺发育不良症;TART:testicular adrenal rest tumor,睾丸肾上腺组织残余肿瘤;CAH:congenital adrenal hyperplasia,先天性肾上腺皮质增生症。GC:glucocorticoids,糖皮质激素;MC:mineralocorticoids,盐皮质激素;17-OHP:17-hydroxyprogesterone,17-羟孕酮;PRA:plasma rennin activity,血浆肾素活性;DOC:deoxycorticoids,去氧皮质酮;11-DC:11-deoxycortisol,11-去氧皮质醇;CS:Cusing syndrome,Cusing综合征:OP:osteoporosis,骨质疏松症;MS:metabolic syndrome,代谢综合征。
高分辨B超/CT/MRI/131I-胆固醇扫描鉴别病变性质
B超对肾上腺肿瘤有定位诊断价值,但一般不能检测到双侧肾上腺增生,因此未发现结节不能排除肾上腺病变。若发现双侧肾上腺回声增强、增宽,应进一步行CT、MRI检查。CAH患者的CT和MRI表现为双侧肾上腺影普遍增大,边缘略呈结节状,但仍保持其大体形态,结构正常。绝大部分肾上腺肿瘤可在薄层CT扫描或MRI中发现,且分泌皮质醇的单侧肾上腺肿瘤可导致ACTH分泌受抑制,使同侧和对侧肾上腺萎缩。由于CT或MRI较131I-胆固醇扫描费时少,费用低,故一般作为首选,但对无功能性腺瘤(意外瘤)和有功能腺瘤无鉴别意义。131I-胆固醇肾上腺皮质扫描示肾上腺皮质细胞摄取胆固醇增加,双侧肾上腺皮质增生,131I-胆固醇浓集于双侧肾上腺皮质区,呈双侧性对称性增强。如131I-胆固醇浓集于一侧肾上腺皮质区则提示为功能性肾上腺皮质肿瘤;如CT或MRI确定一侧肾上腺有肿瘤,而不摄取131I-胆固醇则多为无功能性肿瘤或转移癌。
根据临床表现和DXM抑制试验鉴别性发育障碍病因
CAH是女性性发育障碍(假两性畸形)的最常见病因,其他较少见病因为肾上腺肿瘤或母亲于妊娠早期使用雄激素。CAH和肾上腺肿瘤均有尿17-KS增高,但明显升高则提示肾上腺肿瘤,且后者行DXM抑制试验示血浆17-羟孕酮或17-KS不被抑制,而CAH可被抑制。如患者母亲有应用人工合成的19-睾酮类孕激素(炔诺酮、异炔诺酮)史,孕12周前用药可出现阴唇阴囊褶融合,用药较久时可致女婴阴蒂增大。但患者出生后血17-羟孕酮和17-KS可逐渐转为正常。
女性患者
应与多囊卵巢综合征、CS、卵巢肿瘤、高泌乳素血症、特发性多毛症鉴别。混合性性腺发育不良的染色体核型为45,XO/46,XY嵌合体,性染色质阳性,外生殖器模棱两可,子宫、输卵管和阴道的发育程度不等,女性为条索状卵巢和发育不良的睾丸。Klinefelter综合征患者到青春期开始乳腺发育;睾丸小,缺乏精子;血促性腺激素增高;染色体核型多为47,XXY或嵌合型。可导致多毛的其他情况主要有多囊卵巢综合征(PCOS)、Cushing综合征、卵巢或肾上腺肿瘤、高泌乳素血症、特发性多毛症和肾上腺肿瘤等。PCOS的发病年龄高峰在20~40岁。一般月经初潮正常,起病后闭经、月经失调、不孕或肥胖,常伴多毛(69%)。与成年型轻型CAH的鉴别一般不难。CS一般都有明显的CS症状,血皮质醇增高。高泌乳素血症伴血DHEAS增多,有泌乳及闭经,偶有多毛,乳腺可挤出乳汁,血PRL增高,血LH/FSH正常或升高,溴隐亭治疗效果良好。卵巢肿瘤因雄激素分泌过多而致多毛,产生雄激素的卵巢肿瘤有卵巢男胚瘤(arrhenoblastoma,androblastoma,Sertoli-Leydig cell tumor)、门细胞瘤(hilus cell tumor,Leydig cell tumor)和卵巢残余肾上腺组织肿瘤(adrenal rest tumor)。临床表现为月经量少、无排卵,继而闭经,乳腺及外生殖器萎缩等雌激素缺乏症状。阴蒂肥大,声音低,痤疮,肌肉发达及异性性早熟等雄激素过多症。血睾酮增高,盆腔镜、B超及CT可查出肿瘤。特发性多毛症的病因不明,伴肥胖和月经紊乱,不伴有其他男性化表现,肾上腺和卵巢没有特异性病变;血雄激素及其代谢产物正常或稍升高,睾酮/E2比值升高;肾上腺雄激素分泌亢进,对ACTH刺激反应高于正常,可被小剂量DXM抑制;血17-羟孕酮、皮质醇、睾酮和DHT均增高。
男性患者
主要应与X-性连锁先天性肾上腺发育不良(AHC)鉴别。非CAH所致男性性发育障碍(假两性畸形)主要见于雄激素抵抗综合征、5α-还原酶缺陷症、混合性性腺发育不良、Klinefelter综合征和母亲于妊娠期使用雌激素等。男性5α-还原酶缺陷症有会阴阴囊型尿道下裂和盲端阴道或男性假两性畸形,青春期后出现男性化而无乳腺发育,血睾酮/DHT比值升高即可确诊。
AHC属于肾上腺发育不良症范畴,发育不良和Addison病可以引起肾上腺皮质增生/功能不全。血清17-OHP是鉴别AHC与CYP21的缺陷症的关键指标,AHC患者不升高,而CYP21的缺陷症显著升高。典型AHC的特点是:①糖皮质激素缺乏(Addison病);②盐皮质激素缺乏;③皮肤色素沉着;④低血钠/高血钾/低皮质醇/低醛固酮血症;⑤血浆PRA及ACTH升高。
非典型AHC的特点是:①主要见于男孩;②发育障碍和肌营养不良;③慢性Addison病可伴有肾上腺皮质增生;④男性假性性早熟;⑤偶尔伴有IMAGe或垂体瘤;⑥青春期发育和性腺发育正常。
根据发病年龄/性别/病情确定治疗方案和方法
CAH的治疗方案取决于患者的年龄、性别与病情,补充糖皮质激素属于激素抑制性替代治疗(hormone suppressive replacement therapy)的治疗目的与一般肾上腺皮质功能减退症(Addison病)不完全相同(参见此表)。经典型和非经典型CAH均需补充糖皮质激素,而经典型CAH还需要补充盐皮质激素。
糖皮质激素替代治疗
在21-羟化酶缺陷症、11β-羟化酶缺陷症和3β-HSD缺陷症,糖皮质激素抑制ACTH的过量分泌而减少雄激素的产生,患者过快的生长速度和超前的骨龄可逐渐回复正常。在11β-羟化酶缺陷症和17α-羟化酶缺陷症,糖皮质激素可抑制ACTH的过量分泌而使DOC的分泌正常,缓解高血压。
(1)制剂选择:
糖皮质激素补充治疗的实施十分困难,皮质功能不足的纠正容易,但替代治疗剂量的糖皮质激素往往不能完全抑制ACTH的分泌,因而高雄激素血症的纠正相当顽固。如果以血清ACTH和17-OHP作为糖皮质激素应用的评价指标,那么实际应用的糖皮质激素已经超过了生理剂量,因而必然出现不良反应。看来,寻求上述两者的折中方案(中庸之道,golden mean)是一种可取之策,但因个体差异大而难以作出统一规定或建议。而且,对于儿童患者来说,一般的基本方案是每天给予3~4次糖皮质激素,但成年患者可能以每天1~2次的长效制剂更实际,如泼尼松5~7.5mg/d,或泼尼松龙5~10mg/d,或地塞米松0.25~0.5mg/ d,或氢化可的松15~45mg/d,或这些制剂的联合方案。一般成年患者的氟羟可的松剂量为50~200μg/d,但随着增龄,个体对失钠的敏感性降低,因而成年患者对盐皮质激素的需要量较低。
早期的研究发现,对于绝大多数患者来说,1mg地塞米松≈16mg泼尼松≈27mg的氢化可的松效应。但后来的研究又认为,1mg地塞米松≈7mg泼尼松≈80mg氢化可的松的效应。差异如此之大,主要与研究的对象和比较技术不同有关。因而,上述的换算仅供参考,糖皮质激素的补充必须强调病例个体化和年龄与时间的个体化。目前,经典失盐型CAH除补充氟羟可的松外,最常用的糖皮质激素为泼尼松(约50%),其余病例用泼尼松龙、地塞米松或氢化可的松。经典非失盐型和非经典型CAH仅用糖皮质激素治疗。为了防止早晨的血清ACTH与17-羟孕酮过度升高,成年经典失盐型CAH患者应在傍晚服药,或将最大剂量安排在傍晚。有症状的男性非经典失盐型CAH患者或存在高雄激素血症、月经紊乱与不孕的女性患者,亦需接受糖皮质激素治疗。女性患者经过数个月的治疗后,如果月经不规则、痤疮、多毛仍很明显,此时需要加用抗雄激素治疗,如果仍不能消除,提示有3种可能:①原先存在的糖皮质激素缺乏未纠正;②糖皮质激素抑制性替代治疗剂量过大;③合并有睾丸的肾上腺残余组织肿瘤(ART)。
对于所有类型的CAH(包括表观皮质素还原酶缺陷症),临床上以选用生理性氢化可的松(hydrocortisone)口服为宜,糖皮质激素的用量必须适当,可根据血ACTH和17-KS对剂量进行调整,其原则是先大剂量后小剂量。如果糖皮质激素剂量太小,则不能充分抑制ACTH的分泌,女性男性化临床表现得不到控制;如果剂量过大,则会引起医源性Cushing综合征。目前对非经典型3β-HSD缺陷症儿童只主张病情追踪和对症治疗。开始时的剂量宜偏大,一般维持量为每日氢化可的松10~20mg/m2(20~40mg/d),分2次口服;醋酸可的松(cortisone acetate)与氢化可的松类似。如果常规剂量的氢化可的松疗效不佳,可每日用醋酸可的松20~30mg/m2。泼尼松或DXM的作用强,作用时间持久,对生长的抑制作用更大,故不宜用于儿童。在应激情况下,可酌情将糖皮质激素增加至维持量的2~3倍,几天后减至维持量;严重应激(如外科手术)时,可于第1个24小时内将糖皮质激素加至维持量的5~10倍。
(2)治疗监测:
对于所有类型的CAH患者,治疗过程中调整糖皮质激素和盐皮质激素的剂量时必须监测PRA、血浆17-羟孕酮、DOC、11-去氧皮质醇、雄激素,24小时尿17-KS、 17-OHCS和孕三醇或17-KGS等,并定期监测儿童患者的身高增长速度和骨龄。血浆17-羟孕酮、雄烯二酮、DHEA、PRA,24小时尿中17-KS、孕三醇或17-KGS是观察CYP21缺陷症治疗效果的敏感生化指标,血浆睾酮也是女性患者和青春期前男性患者的较好观察指标,但睾酮对青春发育后的男性患者无意义。PRA测定也可用于监测所有类型CAH的治疗,CYP21缺陷症、3β-HSD缺陷症和StAR缺陷症伴失盐而疗效差时,血PRA升高,疗效好时降低;CYP11B缺陷症和CYP17A缺陷症伴血容量增加而疗效差时,血PRA受抑制,疗效好时回升。一般不建议将ACTH和17-OHP正常作为治疗有效的标准,因为ACTH和17-OHP正常提示替代治疗已经过度,因而将17-OHP抑制到4~12 ng/ml即可,而ACTH应控制在正常上限的2倍以内。
(3)长期替代抑制治疗的不良反应:
自幼年开始的糖皮质激素替代抑制治疗可能产生一系列不良反应,已成为内分泌临床上的一类新问题,主要包括不孕、不育、肿瘤和慢性皮质醇治疗反应症(cortisol-treatment consequences)等。因而,成年CAH的治疗难度极大,如CAH或多囊卵巢综合征导致的青少年雄激素性脱发(adolescent androgenetic alopecia)。成年患者用CRH受体拮抗剂(CRH receptor antagonists,如antalarmin)抑制ACTH的作用明显强于糖皮质激素。成年CAH的治疗方案见下图。
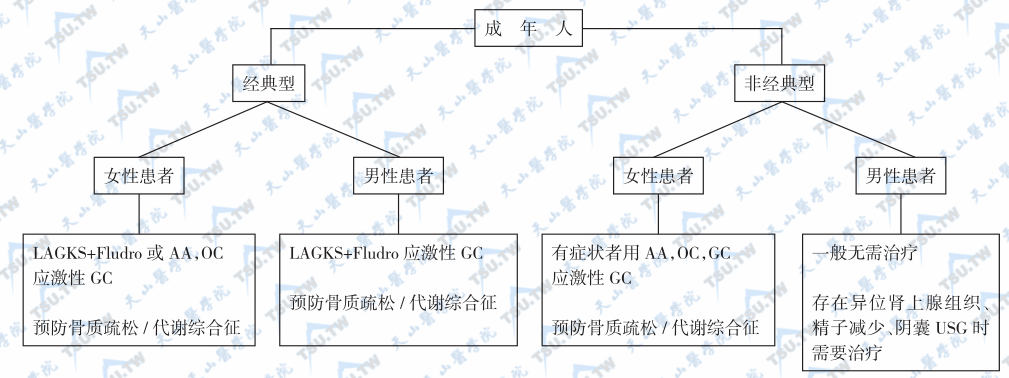
成年先天性肾上腺皮质增生(21-羟化酶缺陷症的治疗)
注:LAGKS:long-acting glucocorticosteroids,长效糖皮质激素;Flutro:氟羟可的松;AA:antiandrogens,抗雄激素治疗;OC:oral contraceptives,口服避孕药;GC:glucocorticosteroids,糖皮质激素;应激性GC:较平时用量增加2~5倍
盐皮质激素补充治疗
9α-氟氢可的松(9α-fluorohydrocortisone,9α-FF)的常用替代剂量为0.05~0.15mg/d,可不考虑患者的体重和年龄。婴幼儿对盐皮质激素相对不敏感,其需要量甚至超过成人(替代剂量0.15~0.30mg/d)。严重失盐者可每日静脉输给氢化可的松(100mg/m2,20mg氢化可的松相当于0.1mg 9α-FF)和生理盐水,或肌内注射醋酸去氧皮质酮(deoxycorticosterone acetate,DOC)。
单纯男性化型21-羟化酶缺陷症患者在婴幼儿期及儿童期也应给予盐皮质激素治疗,抑制PRA。绝大多数失盐型CAH患者在成年后可停止盐皮质激素替代治疗和补盐,因为肾脏11β-羟类固醇脱氢酶(11β-HSD)使皮质醇(cortisol)转变为皮质素(cortisone)而失去活性,随着生长发育,肾脏11β-HSD的活性下降,其对皮质醇的作用减低,因此成人对氢化可的松的盐皮质激素作用变得更“敏感”而不再需要另外补充。CAH的常规治疗见下表。
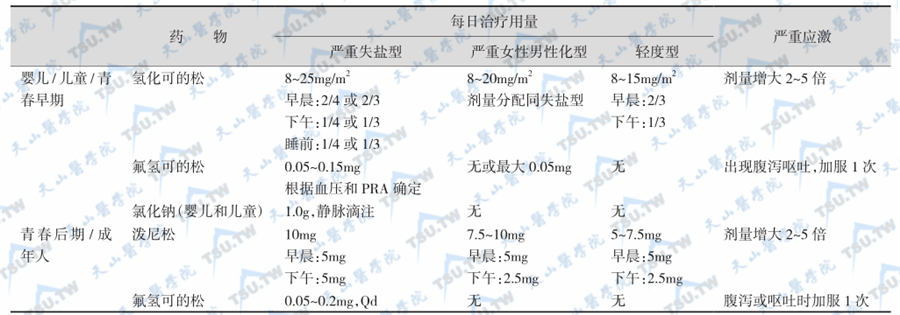
CAH常规治疗,注:PRA:血浆肾素活性
特殊CAH治疗
特殊类型CAH主要包括妊娠妇女CAH、女性胎儿CAH、婴幼儿CAH和伴严重性发育障碍(女性男性化)几种情况。
1、CAH合并妊娠
妊娠妇女患CAH应接受或继续糖皮质激素治疗。妊娠妇女本身患有CAH时,糖皮质激素(泼尼松、泼尼松龙、氢化可的松)治疗首选氢化可的松,禁用地塞米松(女性经典型CAH胎儿除外)。治疗检测的主要指标与一般CAH患者基本相同,但血清睾酮是个例外。但事实是:妊娠期妇女的高雄激素血症并不引起健康女性胎儿雄性化,原因是胎盘的芳香化酶活性高,高SHBG血症和高孕激素血症均可抑制女性胎儿雄性化。妊娠期的糖皮质激素用量较平时大,应使血清睾酮<2ng/ml。哺乳亦不影响糖皮质激素治疗。
2、女性胎儿CAH
DXM可预防女性胎儿性发育障碍,但如果女性计划受孕,应避免使用地塞米松。如果女性患者发生药物抵抗性高雄激素血症(drug-resistant hyperandrogenism),应考虑进行双侧肾上腺切除术(bilateral adrenalectomy)。CAH是一种应用产前治疗可以预防性发育障碍的疾病。在糖皮质激素中,地塞米松不是胎盘2型11β-羟类固醇脱氢酶(l 11b-hydroxysteroid dehydrogenase 2,11bHSD2)的作用底物,可以通过胎盘。因而,女性经典型CAH胎儿是妊娠期地塞米松治疗的适应证,其目的是预防胎儿外生殖器男性化。但必须注意以下几点:
- 胎儿为女性,并存在经典型CAH;
- CYP21A2基因杂合突变,检测标本来源于滋养层活检和羊膜穿刺(trophoblast biopsy and amniocentesis),但问题是检测标本最早也需要在9~11周和15~18周才能获得;
- 妊娠妇女坚持保留胎儿;
- 从最后1次月经算起,于妊娠第9周前口服地塞米松(有人建议在确定妊娠后立即开始治疗)的效果更好;
- 目前没有相关共识,母亲口服DXM避免女性胎儿男性化的近期和远期意义未明。
糖皮质激素治疗的方法为:DXM 1~2mg/d,母亲每天分1~4次服用。治疗时间没有达成共识,一般可从孕第4~9周开始。某些病例在行羊膜腔穿刺术前停药5~7天,少数病例在21~26周停药。在一个54例治疗对象组中,52例为典型CYP21缺陷症,2例男性为经典型CYP11B缺陷症。从胎儿期第10周开始直至出生,治疗的新生儿有34%外生殖器正常,52%有轻度外生殖器男性化,但不必手术,14%的外生殖器男性化需要手术治疗。因此,从妊娠第1个三月期开始DXM治疗的患者大部分在出生后不需手术。如果产前治疗在第2个妊娠三月期中断或妊娠期10周后开始,新生儿将有严重的男性化外生殖器。母亲在妊娠期第1周服用DXM 0.5mg(每月3次)的疗效最佳,但应注意其不良反应的发生与防治。
3、婴幼儿CAH
患儿不管是否有肾上腺危象症状和体征,对筛查出的CAH患儿都应立即开始治疗,并监测血17-羟孕酮、雄激素和皮质素的变化。若失盐表现重与性分化异常,应立即静滴5%葡萄糖盐水,内加氢化可的松或醋酸可的松(初始剂量为25mg),其后几天约25~30mg/d。
4、女性性发育障碍的非激素治疗
Oqilvie等追踪5例行双侧肾上腺切除治疗的CAH患者4.2年,发现该治疗适合于部分女性患者,能使患者受孕,但并发症较多。在糖皮质激素替代不够时,易发生急性肾上腺皮质危象或低血糖症。CAH的性分化异常要先明确是何种酶缺陷,并进行染色体核型检查以决定遗传性别。但遗传性别并不是唯一重要的因素。已经证实,类固醇激素对中枢神经系统的发育和功能具有确切的影响。有人认为,CAH患者中,胎儿期过量分泌的雄激素与女性患者出生后的男性化行为,如成年后的性角色和性心理等有关。在人类,社会性别的作用远远超过激素的作用。在选择假两性畸形的社会性别时,需要更多地考虑外生殖器的生理学和解剖学特点、外生殖器的发育和功能情况,以及患者的心理、社会环境等因素。
女性CYP21缺陷症、CYP11B缺陷症和3β-HSD缺陷症患者无论其外生殖器男性化的严重程度如何,都应以女性进行抚养。这些患者在开始治疗后,增大的阴蒂会有所回缩,如果治疗开始得较早,随着阴蒂周围结构的正常发育,有些不需要进行手术矫形。但如果患者有明显的阴蒂增大和阴唇融合,则需尽早进行外生殖器矫形手术。手术通常分两期进行,一期手术为保留背侧神经血管束和一些勃起组织的阴蒂缩小术(clitoral recession),而不主张进行单纯的阴蒂切除术(clitoral resection)。目前多主张在2岁以前进行一期手术。二期手术则在青春期后,当患者开始规则的性生活或能应用阴道扩张器预防再狭窄和粘连时进行,可行会阴体正中切开及阴道成形手术(vaginoplasty)。另外,在月经初潮前,还需明确阴道是否有先天性畸形,及时手术矫形对患者的性别化行为和性心理很重要,手术过晚会对患者造成性心理伤害。正确而早期开始的治疗可使这种患者获得正常的青春发育和生育力。
