各种急性应激对机体的影响不同,但机体对急性应激的反应则有许多共同之处:
- 交感神经兴奋,机体的应激能力增强,心、肺和脑等器官的活动加强,耗氧量增加,心率加快,心排血量增多;
- 交感神经-肾上腺髓质活动增强,儿茶酚胺释放增多;
- 下丘脑释放CRH、GHRH、AVP和TRH等增多,GH、肾上腺皮质激素和甲状腺素分泌增加;
- 血糖因拮抗胰岛素作用的激素分泌增多及糖原分解增强而升高;
- 失水时,AVP、肾素、血管紧张素和醛固酮的分泌亦增加,是导致水钠潴留的主要原因,有时也导致高肾素性低醛固酮症。
急性应激影响神经-内分泌功能
应激系统的神经内分泌系统由下丘脑-垂体-肾上腺(HPA)、延髓交感神经、肾上腺髓质和副交感神经组成。主要包括下丘脑和脑干的CRH细胞、AVP细胞、旁神经原细胞(paragiganto-cell)、脑髓质腮旁核(parabranchial nuclei)细胞、蓝斑(locus ceruleus,LC)细胞和其他去甲肾上腺素能(norepinephrine,NE)细胞等。下丘脑为肾上腺素能神经末梢的密集区,主要接受来自延髓腹外侧A1区和背中线A2区及部分来自蓝斑的去甲肾上腺素能神经支配。因此下丘脑的CRH细胞在去甲肾上腺素的刺激下持续性兴奋,释放过多CRH。另一方面,兴奋性氨基酸为HPA轴的重要中枢调节因子,兴奋CRH细胞的作用途径可能与N-甲基-D-门冬氨酸(N-methyl-D-aspartate,NMDA)受体的介导有关。
HPA轴变化
在应激过程中,下丘脑以外的边缘系统、前脑基底部、脑干交感系统和脊髓等可分泌CRH,其在协调应激反应中的作用广泛。在应激系统中,中枢的蓝斑/去甲肾上腺素神经元(LC/NE)和CRH神经元两者之间存在着反射性相互作用。室旁核的CRH神经元和脑干的NE神经元均有自身超短负反馈的神经纤维联系和功能联系,分别通过突触前CRH及α2-去甲肾上腺素能受体抑制CRH及儿茶酚胺的分泌。γ-氨基丁酸/苯二氮 (γ-amino-butyric-acid/ benzodiazepine,GABA/BZD)及阿片肽样神经元系统(opioidpeptide-neuronal-systems)的抑制性传入信号产生应激行为和适应性反应。另外,P物质和NPY亦有相互作用。P物质抑制CRH神经元而兴奋LC/NE交感系统。应激时,CRH和AVP呈比例增加,慢性炎症和疼痛时中枢神经的P物质升高,使机体状态在应激系统的激活中得到适当的改善。
(γ-amino-butyric-acid/ benzodiazepine,GABA/BZD)及阿片肽样神经元系统(opioidpeptide-neuronal-systems)的抑制性传入信号产生应激行为和适应性反应。另外,P物质和NPY亦有相互作用。P物质抑制CRH神经元而兴奋LC/NE交感系统。应激时,CRH和AVP呈比例增加,慢性炎症和疼痛时中枢神经的P物质升高,使机体状态在应激系统的激活中得到适当的改善。
各种急性应激刺激传入中枢神经系统,被神经元整合后,兴奋CRH释放的神经递质增多,CRH分泌增加,HPA轴被兴奋,肾上腺糖皮质激素释放入血,血皮质醇升高。同时还可见肾上腺血流增多、细胞肥大和增生,线粒体增加,脂质体减少。但术式不同和麻醉方式不同,反应也不尽相同。一般血皮质醇在术前即开始升高,术后2小时达高峰值(增加3.8倍),术后2天后逐渐恢复正常。在ICU病房,有70%以上的败血症和心源性休克患者存在“相对性肾上腺皮质功能不足”(relative adrenal insufficiency),这是主张应用小剂量糖皮质激素的原因和依据。但是,近年对这一理念有了较大质疑。部分患者的相对性肾上腺皮质功能不足是一种保护性反应,没有使用大剂量糖皮质激素的必要,或者说,甚至是有害的。交感神经-肾上腺髓质-肾上腺皮质轴主要参与亚急性和慢性应激的肾上腺皮质功能调节。交感神经兴奋时,肾上腺髓质可释放肾上腺素、去甲肾上腺素、多巴胺、血清素、乙酰胆碱、脑啡肽、CGRP、VIP、CRH、PACAP、ANP和AM等,并在免疫细胞的协助下,促进肾上腺皮质合成和释放糖皮质激素、生长因子和细胞因子。肾上腺糖皮质激素的调节可分为CRH/ACTH依赖性和非CRH/ACTH依赖性两条途径。
自主神经系统对应激反应能迅速广泛的控制心血管、呼吸、消化道、肾、内分泌和其他系统,这些器官均由交感神经系统、副交感神经系统或两者共同调控。副交感系统有拮抗和消除交感神经的作用,在应激反应中副交感神经的兴奋性增强以拮抗交感神经的功能。来自脊髓的神经元的节前纤维(preganglionic fibers)将应激刺激传入交感神经支配的周围器官。交感神经节两侧链的神经突触与交感神经元的节后纤维共同支配血管平滑肌、心脏、肾、肠道、脂肪和其他许多器官。交感神经系统通过肾上腺髓质也将肾上腺素和去甲肾上腺素等分泌到体液和血循环中。自主神经除分泌乙酰胆碱及去甲肾上腺素两种神经递质外,还释放多种神经肽、ATP、一氧化氮和炎症脂质。CRH、NPY、生长抑素和甘丙肽位于去甲肾上腺素能神经元内,VTP、P物质和降钙素基因相关肽(CGRP)共同存在于胆碱能神经元内。交感神经节的节前纤维的神经递质和神经元内短的纤维传导也介导神经肽的释放。
非CRH/ACTH依赖性肾上腺糖皮质激素调节的生理和临床意义可归纳为:
- 肾上腺皮质的非CRH/ACTH调节途径是生理和病理情况下(包括应激)均发挥作用的内分泌调节机制。正常情况下,维持基础糖皮质激素分泌和肾上腺皮质与髓质功能。
- 由于非CRH/ACTH依赖性糖皮质激素分泌,患者往往出现血ACTH/皮质醇分离现象,即ACTH正常甚或下降,血皮质醇升高。临床上遇见这种分离现象时,要想到患者存在慢性或亚急性应激(如自身免疫性疾病和慢性感染等)可能。
- 给患者做地塞米松抑制试验,血皮质醇无抑制反应。同理,患者对甲吡酮亦无兴奋反应。
- 新生儿、老年人、糖尿病及其他全身性疾病患者,尚可有血雄激素/皮质醇的分离现象,表现为血雄激素降低,血糖皮质激素升高,其发生机制未明,亦可能与非CRH/ACTH依赖性糖皮质激素的释放有关。
- 临床上鉴别CRH/ACTH依赖性和非CRH/ACTH依赖性皮质醇升高较困难,如ACTH正常或下降、皮质醇升高和胰岛素低血糖-地塞米松抑制联合试验(低血糖能增加而地塞米松不能抑制皮质醇的分泌)有助于非CRH/ACTH依赖性皮质醇分泌增多的诊断。
选择性1型CRH受体和3型AVP受体阻滞试验亦有助于鉴别,这些阻滞剂可抑制ACTH介导的皮质醇分泌而对非CRH/ACTH依赖性皮质醇分泌无抑制作用。
交感-血管紧张素系统变化
AT-2既是肾素的作用底物又是神经递质,大脑皮质、下丘脑、交感神经元和AT-2神经元在脑内分布广泛。当应激使交感神经兴奋时,中枢神经的AT-2释放明显增多,并进一步促进儿茶酚胺、AVP和CRH等分泌,故AT-2在脑内起加强、扩增和易化中枢交感神经兴奋作用来提高机体的急性应激能力。在交感神经末梢,释放的去甲肾上腺素通过β受体使肾素-血管紧张素系统活动增强。而且,AT-2又可通过交感神经末梢的突触前受体,使去甲肾上腺素进一步释放,形成AT-2和去甲肾上腺素间的恶性循环(正反馈)。在肾上腺,AT-2促进醛固酮分泌及髓质激素释放,进一步促进各种应激激素分泌。醛固酮的作用分为基因依赖性和非基因依赖性两个方面。非基因依赖性作用可能是靶细胞膜结合物(可能为膜受体)作用,调节Na+反极转运体(antiporter)和胞内第二信使系统,改变血管平滑肌细胞和内皮细胞等的活动而出现血压升高和钠潴留等应激反应,而且还参与了急性应激时细胞内氧化调节过程。在慢性应激情况下,常因应激反应引起肾素过度分泌,但由于交感神经兴奋也抑制肾上腺皮质醛固酮合成的后期步骤而阻滞了醛固酮的合成和分泌,导致高肾素性低醛固酮综合征。
下丘脑-腺垂体-甲状腺(HPT)轴变化
急性应激时,由于交感神经兴奋,下丘脑TRH分泌增多,通过TSH刺激甲状腺,释放较多甲状腺激素入血,代谢率加速,以适应机体代谢的需要。如果应激时间延长,或因为某些原因病情危重,HPT轴功能往往处于抑制状态。如急性心肌梗死、高血压危象、脑血管意外、急性心力衰竭、急性肺功能衰竭、急性颅内高压和中毒性休克等患者,血清甲状腺激素变化有一定规律性。通常随着病情进展,血T3和T4下降,rT3逐渐升高,T3的下降与rT3增高呈反变关系;至疾病恢复期,T3、T4和rT3逐渐恢复正常。故有人认为,血T3和rT3是判断病变严重程度和预后的良好指标。相对血液中的T3和T4浓度变化来说,脑组织中的T3变化最为明显(T3显著增加),这是因为脑组织Ⅱ型5′-脱碘酶对急性应激十分敏感所致。
下丘脑-腺垂体-性腺轴变化
应激时,性腺轴被HPA轴抑制。HPA轴直接或通过弓状核POMC神经元刺激β-内啡肽和CRH,在弓状核抑制促性腺激素释放激素神经元。另一方面,糖皮质激素抑制GnRH 和LH的分泌,使性腺类固醇激素的靶组织产生抵抗。在炎性应激时,炎性细胞因子也可抑制生殖功能,而瘦素起允许和激活作用。慢性HPA轴的激活引起性腺功能的抑制(如赛跑运动员和芭蕾舞蹈演员),其夜间血皮质醇和ACTH及尿游离皮质醇增高,ACTH对外源性CRH的反应迟钝。男性LH、睾酮和雌二醇水平均低,女性无月经。HPA轴的活性增高引起的病理生理变化有:①抑郁、神经性厌食和营养不良;②烦躁-强迫症;③烟(酒)戒断综合征;④糖尿病或代谢综合征;⑤精神性矮身材;⑥Cushing综合征;⑦胃肠疾病、纤维肌肉疼痛和病态甲状腺综合征等。尿中皮质醇排出量增高,对外源性CRH反应减低,脑脊液CRH升高。
无论在急性、亚急性或慢性应激情况下,HPA轴兴奋均可导致HPG轴的功能抑制。在临床上,引起神经精神症状、月经紊乱、闭经、性欲减退、阳痿、精子生成减少和不育症等,其中以生育期女性的HPG轴功能紊乱表现最为突出。应激所致性腺功能减退或功能紊乱的原因很多,以下丘脑GnRH的脉冲性分泌功能丧失最明显。应激状态下,HPG轴功能抑制主要与HPA轴兴奋有关,表现在:
- 应激性闭经、神经性厌食或剧烈运动妇女的皮质醇分泌增多,昼夜节律仍存在,脑脊液中CRH浓度升高;
- 使用外源性CRH后,卵巢切除动物表现为GnRH和LH的脉冲性分泌消失;
- 使用IL-1和内毒素等应激物质后,HPA轴被兴奋,同时可见HPG轴功能抑制(LH和FSH的脉冲性节律消失,分泌量下降);
- 位于GnRH脉冲发生器(GnRH pulse generator)附近的β-内啡肽分泌增多,使用阿片样肽受体拮抗剂则使GnRH脉冲性分泌功能迅速恢复,而纳洛酮(naloxone)或纳曲酮(naltrexone)可拮抗应激对HPG轴的抑制。这提示,β-内啡肽至少是联系HPA轴(CRH)与HPG轴(GnRH)的应激性调节物(神经调质)之一。
禁食时间过长也是一种病理性刺激。禁食时,胃分泌一种神经调节物质,通过迷走传入纤维到达下丘脑的室旁核(PVN),兴奋去甲肾上腺素能神经,CRH分泌增加再抑制GnRH的释放,雌激素则兴奋这一系统。下丘脑的PVN和A2区为雌激素的负反馈作用部位,禁食时该部位的雌激素受体数目增多,故禁食时雌激素可抑制LH的分泌。因此,可认为禁食首先引起去甲肾上腺素的分泌,促使下丘脑雌激素靶细胞中的受体数目增多,由胃部而来的传入神经冲动对去甲肾上腺素的敏感性增加。在雌性动物中,应激性刺激对性腺功能的作用还受卵巢类固醇激素的调节,但其对PVN和A2区的反馈作用与通常的“负反馈作用”机制不同,因为这种反馈信息不是来源于卵巢而是来源于环境因素,如应激。由于GnRH分泌下降可致垂体LH释放明显减少,如持续时间过长,可导致闭经或性欲减退。男性血睾酮下降,但对性腺活动的影响不明显。应激时神经系统、HPA轴和HPG轴的主要变化见下图。
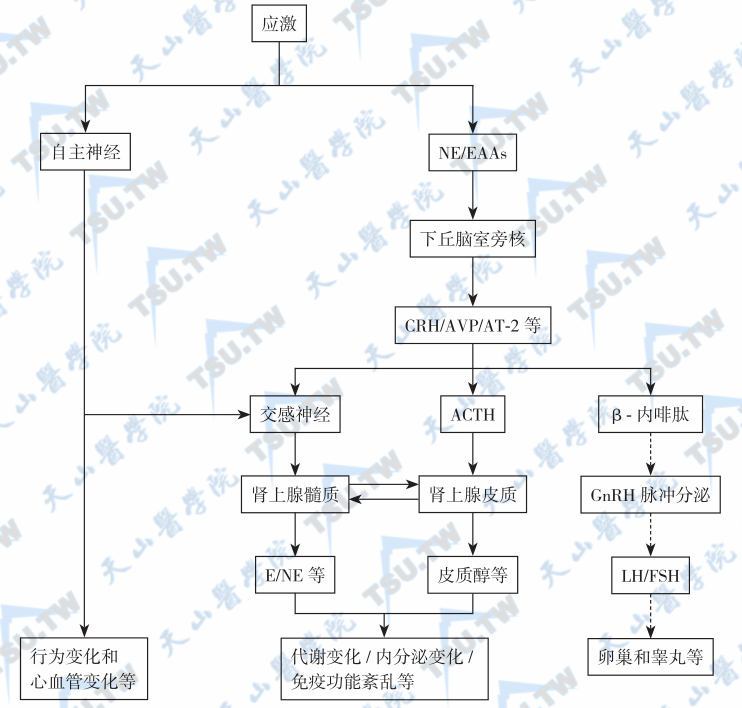
应激对神经、内分泌和免疫调节功能的影响
注:实线箭头:表示兴奋;虚线箭头:表示抑制;E:肾上腺素;NE:去甲肾上腺素;EAAs:兴奋性氨基酸类物质;CRH:促肾上腺皮质激素释放激素;AVP:精氨酸血管加压素;AT-2:血管紧张素-2;ACTH:促肾上腺皮质素;LH:黄体生成素;FSH:卵泡生成素;GnRH:促性腺激素释放激素。
中枢神经对急性应激的反应广泛
急性出血者有失血性休克、微循环障碍和神志改变等表现;重症创伤者有剧烈疼痛、功能障碍和器官组织损伤等表现;急性缺氧(低张性)时,动脉血氧分压、氧含量和血红蛋白氧饱和度降低,等等。由于病因不同,其临床表现各异。本节主要讨论神经-内分泌方面的临床特征。具体表现为:①神经系统表现:主要表现为交感神经兴奋,如心率加快、心搏增强、内脏血管和皮肤血管收缩,支气管平滑肌舒张、肺通气量增大,胃肠活动和消化液分泌功能减弱,瞳孔扩大和眼肌收缩,汗液分泌增多,糖原分解,儿茶酚胺分泌增多等;②内分泌系统表现:应激激素和中枢神经递质释放、HPA轴、交感神经-肾上腺髓质、甲状腺轴与交感-血管紧张素系统兴奋,而性腺轴被抑制。
应激激素和中枢神经递质分泌
应激激素(stress hormones)一般系指应激状态下激素分泌细胞兴奋、合成和大量分泌入血的一类激素。应激时,血浆浓度明显升高的激素主要有:
- 下丘脑-垂体激素:CRH、AVP、β-内啡肽、神经肽Y、ACTH、β-溶脂素、PRL、GH和褪黑素等;
- 肾上腺皮质和髓质激素:皮质醇、醛固酮、肾上腺素、去甲肾上腺素、多巴胺和肾上腺髓质素(AM);
- 肾素和血管紧张素;
- 旁分泌激素和细胞因子:前列腺素、激肽、IL-1、IL-6、TNF、兴奋性氨基酸、自由基和应激活化蛋白激酶(stress-activated protein kinase,SAPKs)等。
旁分泌应激激素的释放只在局部组织起作用,血中激素浓度不一定升高。这一类应激激素的主要释放部位在中枢神经系统。例如,应激促进下丘脑及其他脑区去甲肾上腺素和兴奋性氨基酸的释放,并进一步兴奋HPA轴功能。
急性应激反应
应激能明显促进中枢多种神经递质的释放,其中最显著的是去甲肾上腺素和兴奋性氨基酸类。急性应激原能促进中枢尤其是下丘脑的去甲肾上腺素代谢和释放,但发生部位不尽相同,应激促进海马、前脑、皮质、杏仁核和下丘脑的去甲肾上腺素释放,组织中的浓度升高。在慢性应激时,接受了足够强度的应激原刺激后,脑组织对新的应激原敏感性增加;再次应激时,去甲肾上腺素的释放显著高于初次应激反应,称为“应激性去甲肾上腺素增敏”(stress-induced sensitization of norepinephrine)现象。“应激性高血压”是一种生理反应而非病理变化,主要与心排血量增加、心率加快(伴外周血管阻力增加)以及儿茶酚胺、皮质醇、AVP、内啡肽和醛固酮分泌增多等有关。如机体长期处于慢性应激状态,可发生慢性高血压(原发性高血压),血管壁增生、肥厚及动脉硬化。但一些继发性高血压可能主要是血管本身病变所致,如肝和肾等器官移植术后,患者常发生移植后高血压(post-transplant hypertension),这种高血压可能主要与环孢素诱导血管内皮细胞功能紊乱及细胞因子分泌有关,一氧化氮(NO)系统的活动被上调,而环孢素诱导的过氧化物和自由基可拮抗血管扩张导致高血压。此外,器官移植术后高血压也与血容量增多,交感-肾上腺皮质兴奋和应用糖皮质激素等有关。 应激系统除激发觉醒和维持生命体征外,应激时中枢神经系统的皮质边缘多巴胺能系统、杏仁核海马复合体和弓状核POMC神经系统均被激活。
- 皮质边缘系统:属于多巴胺系统,由LC/NE-交感系统支配,对认知功能、欣快或抑郁心理状态有影响。
- 杏仁核/海马复合体:由脑干儿茶酚胺能神经元的神经纤维传入。杏仁核对任何应激情绪有重要作用。
- 阿黑皮素原(POMC):疼痛感觉由LC/NC-去甲肾上腺素能和CRH/AVP神经调节。α-MSH和β-内啡肽能抑制应激系统中枢的LC/NE和CRF的信息,投射到脑干和脊髓,产生镇痛作用。
- 体温和食欲调节:激活LC/NE-去甲肾上腺素和PVN,CRH系统使体温中枢升高体温。CRH对IL-1、TNF-α 和IL-6所介导的部分产热作用是由外源性热源脂多糖(细菌的产物)的刺激所产生的。食欲和饮食中枢位于下丘脑内。CRH和α-MSH是一个主要的厌食性神经肽,它接受神经肽Y的刺激,而NPY却是一个较强的食欲性神经肽。在刺激CRH的同时,NPY还抑制LC/NE-交感系统和副交感神经系统的作用,帮助消化和储存营养。由脂肪细胞所分泌的瘦素是NPY的抑制剂。这些因子在应激系统激活状态下调节食欲。糖皮质激素也可刺激下丘脑NPY基因的表达,并且同时抑制PVN、CRH和LC/NE交感系统。
急性应激导致应激性高血糖症
由于应激时代谢消耗的需要,机体动员葡萄糖调节机制,升高血糖,但有时由于各种原因或血糖调节机制障碍,亦可出现应激性低血糖症。
在儿科急性疾病患者中,约占4%~5%。应激时,由于一些抗胰岛素激素(胰高血糖素、肾上腺素、GH和皮质醇等)分泌增多和胰岛素分泌受抑制所致。血糖升高程度不一,如血糖调节机制正常,不会引起持续性高血糖,但如原有糖耐量异常(IGT)可加重病情并出现糖尿病;如原患有糖尿病者,可诱发高渗性非酮症性昏迷或酮症酸中毒。因此,凡遇有急、慢性应激者,均不宜作OGTT检查(假阳性),但应进行常规血糖测定。
应激性高血糖是应激反应的评价指标之一,长期存在的高血糖和糖耐量减退(病前正常)提示机体应激反应没有解除;另一方面,应激性高血糖是心血管疾病的危险因素之一,研究表明与急性心肌梗死相关的高血糖明显增加充血性心衰和心源性休克的危险性。心肌梗死的死亡率也明显高于无高血糖者。对糖尿病患者来说,应激性高血糖增加了氧化应激(oxidative stress)的严重程度,氧自由基生成增多引起胰岛素抵抗、糖利用减少及细胞的各种损害。形成胰岛素抵抗和氧自由基间的恶性循环,而高血糖是该恶性循环的始动和促发因素。慢性应激和糖尿病时,高血糖氧化应激诱导细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)表达,促进动脉粥样硬化形成。此外,1型糖尿病患者由于内源性吗啡样肽的反应减退症又减弱了机体的应激防御能力。应激时,增高的糖皮质激素不仅抑制GH和类固醇性激素的产生,还拮抗这些激素在脂肪组织中的分解代谢作用及肌肉和骨骼中的合成代谢。抑制成骨细胞的活性,产生骨质疏松。糖皮质激素又可导致胰岛素抵抗,因此各种应激激活HPA轴后,会使糖尿病的血糖不易控制。糖皮质激素引起的进行性腹部脂肪增加会直接加重2型糖尿病患者的胰岛素抵抗,产生高血糖和高胆固醇血症,还可能引发神经性病变等。
应激性高血糖引起脱水和高渗状态
急性应激时,患者往往不能进食或因为病情和治疗需要被迫禁食,必须由静脉补充足够的糖类,但应激患者宜尽早恢复饮食,减少肠外营养支持量和时间。如因病情需较长时间应用静脉营养,必须考虑高血糖带来的毒性作用。此外,长期静脉输入葡萄糖液也易发生葡萄糖毒性作用。急性高血糖的毒性作用主要表现为脱水和高渗状态;慢性毒性作用则指慢性高血糖状态对机体代谢和免疫的影响。高血糖的主要影响:
- 产生急性氧化应激;
- 胰岛素合成减少,出胞障碍,Ⅰ相分泌减弱或缺乏;
- 糖分子亲水,高渗糖液使血容量增加,心肺负荷加重;
- 糖的渗透性利尿作用可直接损害肾小管上皮细胞,使肾小管的重吸收和分泌功能降低,无机盐丢失;
- 糖进入肝脏,导致脂肪与氨基酸代谢障碍,体内成糖成酯作用消耗胰岛素,生成过多三酰甘油,使肝脏解毒功能下降;
- 干扰正常免疫功能,致细胞免疫功能下降;
- 损害微血管;
- 损害大血管,引起大动脉粥样硬化;
- 糖化蛋白形成(HbA1c、清蛋白、球蛋白、抗体、膜蛋白、转运蛋白和酶等)和糖化脂类形成(糖化IDL、糖化VLDL、糖化LDL和糖化HDL等),干扰细胞的正常代谢过程;
- 胰岛β细胞损害。慢性高血糖干扰凝血和纤溶过程,形成高凝状态:如肺水肿、脑水肿、肺炎、肾炎、肝炎、心肌炎和浆膜积液等疾病伴有高血糖,除加重原有病情外还可诱发或加重感染。
血糖对糖利用的影响遵循“质量作用定律”原理。不依赖于胰岛素但有赖于糖转运蛋白(GLUT)的携带,胰岛素促进GLUT4的“转位”(translocation),以加强糖利用。正常情况下,约50%的糖利用是通过质量作用原理来完成的。1型和2型糖尿病的空腹高血糖状态从组织糖利用的角度来看,代偿了胰岛素抵抗或缺乏所致的糖利用不足,但代偿不能或不全(部分代偿)。而糖的浓度效应减弱,这就是所谓的“ 葡萄糖抵抗”或“ 葡萄糖中毒”现象。肌肉和脂肪组织既是胰岛素抵抗也是葡萄糖抵抗的主要组织。骨骼肌遇有氧化应激时,出现胰岛素抵抗现象,肌细胞在接触H2O2时,葡萄糖的转运和糖原合成被抑制,蛋白激酶被激活。激活后酶的活性为通常情况的8~38倍,其中p38-MAPK的活化是导致胰岛素抵抗的最主要因素。葡萄糖抵抗的原因未明,可能与GLUT的降调节、糖氧化通路阻滞、非酯化脂肪酸(NEFA)升高并优先氧化以及无氧氧化过多等有关。
另外,许多氨基酸和嘌呤代谢中间物或终末产物的堆积均可使糖氧化酶失活。正常人输注大量葡萄糖液后血糖可呈短时升高,一般不会出现毒性作用,但老年人,心、肾、脑功能不全及有IGT或糖尿病者则可发生水中毒、急性心衰、肺水肿和脑水肿等并发症。2型糖尿病(尤其是老年患者)存在明显的氧化应激反应,血中氧化型谷胱甘肽浓度升高,还原型和氧化型谷胱甘肽比值下降,血维生素C降低,单核细胞和粒细胞生成的NO增多,如再作OGTT试验,上述变化加剧。
应用高渗性葡萄糖液诱发的高渗性非酮症性昏迷病例屡有报道。应激时,由于拮抗胰岛素作用的应激激素分泌增多,加上老年人、孕妇或原有糖代谢紊乱者的失水和渴感中枢敏感性下降等原因,可于数小时至数日内发生高渗性昏迷,其死亡率高。因此凡重症患者必须监测血糖和血(尿)渗透压等指标。
慢性高血糖症是导致糖尿病一系列慢性并发症的重要原因,大血管和微血管长期处于“葡萄糖中毒”、氧化应激和免疫失调状态,高血糖可通过自由基损害血管壁、肾系膜细胞、视网膜细胞和神经纤维及胰岛β细胞,导致各种慢性并发症。从细胞水平和分子水平来看,这些病理变化均与氧化应激有直接或间接联系。
急性应激导致应激性低血糖症
除药物(包括胰岛素制剂)外,应激因素是常见的低血糖症病因,其中以肝源性、心源性和肾源性低血糖症更常见。如进食过少、消耗过多、拮抗胰岛素激素缺乏或肝糖原和肌糖原被消耗后,易发生低血糖症。禁食或餐后血糖的重要来源是肝糖原分解和肝糖异生,低血糖伴血乳酸增加提示糖异生障碍。肝功能严重损害时常伴发严重的空腹低血糖症,慢性广泛性肝损害引起低血糖的另一原因是肝脏灭活胰岛素的能力下降及胰岛分泌的胰岛素由侧支循环大量进入体循环,表现为胰岛素/C肽比值明显升高。心源性低血糖症较少见,可能与肝淤血、心源性肝硬化、进食过少和肝糖异生障碍等有关。肾源性低血糖症主要与葡萄糖转换降低、丙氨酸成糖作用减弱以及肾灭活胰岛素减少等有关,部分患者的血丙氨酸降低。
