胰岛素的历史
1776年,英格兰医生Mathew Dobson 发现,糖尿病是一种全身性疾病,糖尿病患者的血液和尿液一样都是甜的。1788年,Thomas Cawley首次报道,损伤胰腺可引起糖尿病。1869年,Paul Langerhans发现在胰腺的外分泌和导管组织间隙可见细胞团块。1889年,两位德国医生发现切除狗的胰腺后发生了糖尿病。1893年,人们将胰腺外分泌和导管组织间隙的细胞团块命名为Langerhans岛,而比利时的Jean de Meyer将Langerhans岛分泌的物质称为胰岛素(insulin)。1904年,德国医生George Zuelzer发现狗的胰腺提取物具有降低血糖作用,他用自己制备的胰腺提取物注射治疗了8名糖尿病患者,并获得美国专利,但这种粗提取物有严重的不良反应。在此期间,其他的研究者们也在从事提取分离胰岛素的研究,但均以失败告终。
1921年1月1日,加拿大的Frederich Grant Banting医生给1名14岁男孩注射了由生物化学家James B Collip改进了提纯方法的胰腺提取物,使这位处于死亡边缘的男孩的血糖下降到正常,尿糖及尿酮消失。胰腺提取物使这位患者生存到35岁,而首批接受胰岛素治疗的Ted Ryder享年76岁。由于在胰岛素发现及其对糖尿病患者治疗上所取得的杰出成就,Banting和Macleod于1923年被授予诺贝尔医学和生理学奖。同年,丹麦生理学诺贝尔奖获得者August steenberg Kronh在前往美国讲学途中,获得了Banting发现胰岛素的消息。他的妻子正巧也是糖尿病患者,Kronh马上改变行程,前往Toronto与Banting和Best会面,商谈胰岛素的生产事项。并于1923年开始在北欧半岛生产胰岛素,创立了诺和诺德公司。1923年,印第安纳州的礼来公司(Eli Lilly Co.)也开始在北美生产胰岛素。
从人尸胰腺中提取的胰岛素和结晶出的胰岛素不纯,仍含有较多杂质。20世纪70年代,由于层析分离技术在工业上广泛应用,使动物胰岛素制剂进一步纯化,凝胶过滤层析分离技术使大多数杂质被除去;离子交换层析分离可以将胰岛素溶液中的污染物含量降低到最低程度。另一方面,不同物种(牛、猪和人)的胰岛素一级结构有差异,可能发生交叉免疫反应,产生胰岛素抗体,既降低胰岛素的疗效,又能诱发自身免疫性低血糖反应,或出现注射部位脂肪萎缩与水肿。
1965年,我国合成了牛胰岛素;但成本高,批量生产困难。1974年,Sieber等从氨基酸化学合成了人胰岛素;20世纪70年代末丹麦诺和诺德公司首先生产半合成人胰岛素;1982年,美国礼来公司首先用基因重组技术合成了人胰岛素。通过基因工程/重组DNA技术生产出的胰岛素被称为生物合成人胰岛素,其大致合成过程是:带有编码的人胰岛素前体的DNA被植入质粒→质粒引入酵母细胞→细胞分泌人胰岛素前体→发酵→离子交换层析分离技术→胰岛素粗晶体→HPLC→胰岛素纯晶体(99.9%)→加入锌盐→胰岛素锌晶体。
胰岛素原基因高度保守
含1355个碱基对,编码区域由3个外显子组成。在人类,编码前胰岛素原的基因位于11p上,接近于IGF-2基因。前胰岛素原含1355个碱基对,编码区域由3个外显子组成。第1个外显子编码前胰岛素原N端的信号肽;第2个编码B链以及部分C肽;第3个编码C肽的剩余部分以及A链。经过转录以及缝接移去内含子编码的序列后,产生1个含有600个核苷酸的mRNA,由此翻译分子量为11.5kD的多肽,即前胰岛素原。前胰岛素原被迅速释放到粗面内质网池腔中(1min以内),在这里,蛋白裂解酶立即将信号肽裂解,形成胰岛素原。
现已阐明了人、猴、牛、猪、犬、大鼠和小鼠等近20种动物的前胰岛素原基因的cDNA序列。人胰岛素基因定位于11p,含有3个外显子和2个内含子,其中内含子1位于外显子1和外显子2之间。种属间胰岛素基因的主要差别在内含子的长度,而外显子的种属间差异较小,位置较固定,说明胰岛素基因是一种高度保守的古老基因。
多数可影响胰岛素合成的因素均对胰岛素基因的表达有调节作用。另一方面,受胰岛素调节的营养素(如葡萄糖、氨基酸和脂肪酸)也对胰岛素基因的表达有影响(直接的或间接的作用)。
胰岛素原裂解出胰岛素
胰岛素来源于胰岛素原的裂解,胰岛素分子由两条多肽链组成,分别称为A链和B链,两条肽链由两个二硫键连接。在A链内部还有一个二硫键,将第6位和第11位氨基酸残基连接起来。A链含有21个氨基酸残基,而B链则有30个。胰岛素的分子结构见图5-27-9。人、猪和牛的胰岛素分子之间有差异。人胰岛素与猪胰岛素的区别仅限于B链最后一个氨基酸残基的不同,在人是苏氨酸,而在猪则为丙氨酸。而人胰岛素与牛胰岛素的不同则在A链上另两个氨基酸残基的区别,人胰岛素的A链第8位与第10位的氨基酸残基分别是苏氨酸和异亮氨酸,而牛胰岛素则分别为丙氨酸和缬氨酸。
锌-胰岛素的理化特性主要由分子结构和pH决定
含有2个锌离子的胰岛素6聚体由3个相同的二聚体组成,3个胰岛素二聚体以三折对称的模式进行交链。单体胰岛素B链的螺旋区域与N端区域中疏水氨基酸残基连接,并且通过两个锌离子在6聚体中心轴附近的Bl0氨基酸残基上的配位,使得二聚体聚合在一起。胰岛素以锌-胰岛素6聚体的形式储存在β细胞储存颗粒中,另外在6聚体中心附近6个谷氨酸侧链上有钙离子的配位,可使颗粒的稳定性得到进一步加强。由于大量分泌后的稀释作用,6聚体迅速解离以形成胰岛素单体。晶体结构形式决定了溶液中胰岛素的特点,但在极度稀释的溶液中和在有某些溶媒存在的情况下,与聚合形式的胰岛素相比,单体胰岛素形成多聚体的程度较低。
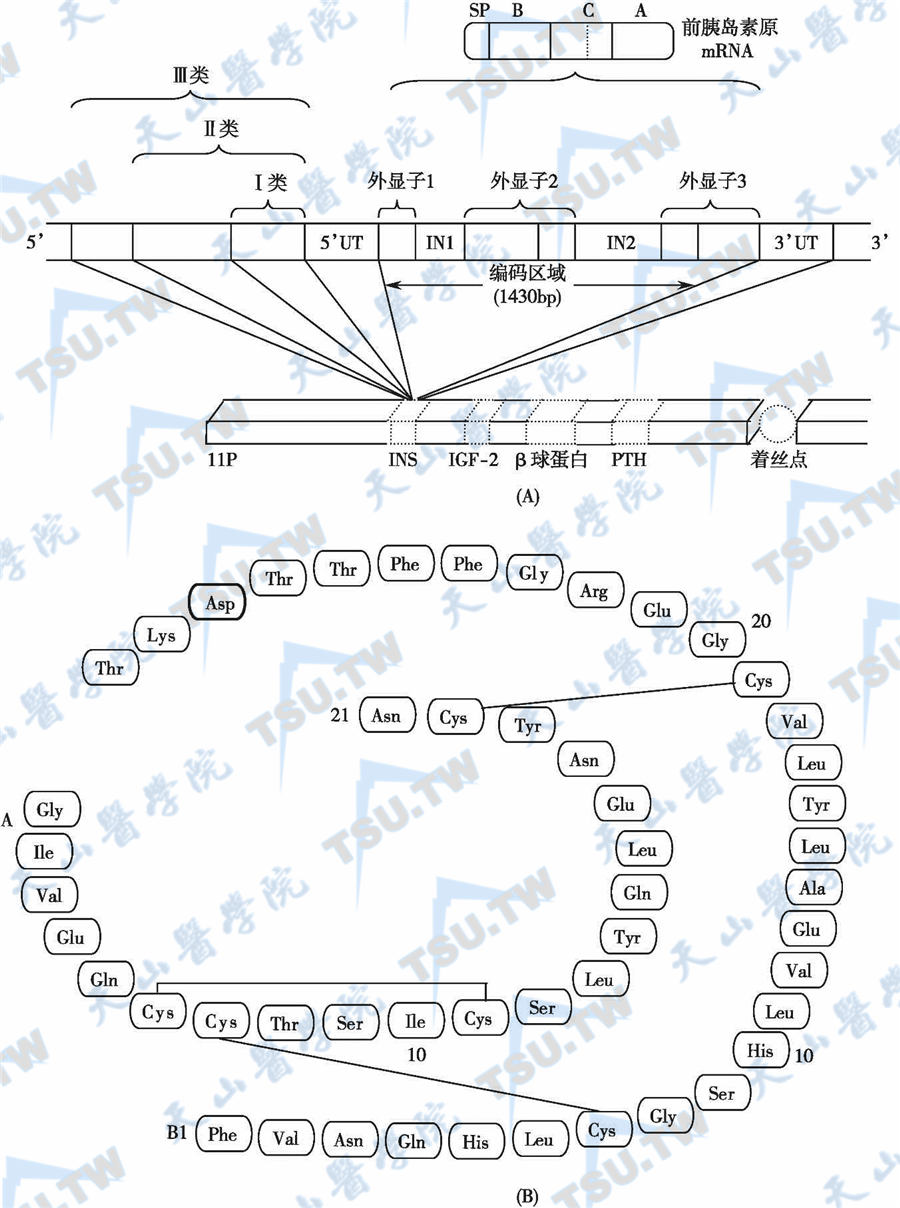
胰岛素基因与胰岛素分子的结构
注:(A):胰岛素基因结构。SP:信号肽;B:胰岛素B链;C:C肽;A:胰岛素A链;INS:胰岛素;IN:内含子;IGF-2:胰岛素样生长因子-2;PTH:甲状旁腺素。(B):胰岛素分子结构。本图显示的为Novo Rapid胰岛素(AspB28)的分子结构。
牛胰岛素在A8~A10袢区的氨基酸序列与人和猪的胰岛素有差别。这些区域突起于胰岛素6聚体分子的表面,正好填进相邻6聚体分子的凹陷中。这有可能部分解释牛胰岛素在可溶性与结晶性上所存在的轻度差异可影响牛胰岛素的药动学,这也解释了为什么有些糖尿病患者在由牛胰岛素更换成其他类型胰岛素后,代谢控制有改善。猪胰岛素与人胰岛素有一个氨基酸残基不同,也可引起生理效应和胰岛素动力学方面的改变。例如,与猪胰岛素相比,人胰岛素的脂溶性较低,因此其吸收速率较快。
胰岛素原亦可形成二聚体和锌6聚体。有人推测,C肽的包装有可能妨碍胰岛素分子表面暴露在6聚体中。但是,这需要经结构分析来进一步证实。磁共振分光镜检查显示,C肽有较高的可变性,但是在C肽和A链的结合处却存在着一个局部稳定区域。这一结合处被称为“CA指节”,此处有可能为Ⅱ型胰岛素原肽链内切酶(激素原转换酶2)提供识别位点。
改造一级结构获得胰岛素类似物
胰岛素的A链含有两个螺旋区,即A1~A8和A13~A19,这两个区域的轴是逆向平行的。它们之间由延伸的袢相连,这一延伸的袢由链内的二硫键相连。B链最明显的二级结构是B9和B19之间的α螺旋,随后突然转向B23位。剩余的B1~B8区域以及B23~B30区域处在一个延伸了的结构中。但是在晶体形式中,B1~B8区域为一螺旋结构,与4个而不是通常的2个锌离子一起形成6聚体结构。近年来,又发现了一个与之相似的晶体结构,在这一结构中,由6个酚基与胰岛素形成6聚体。
A链和B链折叠在一起形成了致密的胰岛素颗粒。胰岛素的氨基酸残基侧链的加工处理与大多数蛋白质的处理方式是一致的,除两个无极性区域在分子表面外,疏水的核心被包埋在亲水的分子里面。在聚合过程中,胰岛素的B链为分子之间的相互接触提供了较为广大的空间。在二聚体形成过程中,两个相邻单体分子的B24~B26氨基酸残基区域交互反应,形成了逆向平行的B片层结构。4个参与的氢键被一连串无极性侧链所遮蔽,无极性侧链为B24和B25(均是苯丙氨酸)、B16和B26(均是酪氨酸)以及B12(缬氨酸)。在含有两个锌离子的晶体中,两个胰岛素单体成分有可能是相似的,但不会是相同的。
胰岛素类似物是糖尿病治疗的一次革命。1992年,在实验室用基因重组技术合成了胰岛素类似物。1996年,美国礼来公司用基因重组技术合成了第1个人胰岛素类似物——赖脯胰岛素(insulin lispro);1999年,丹麦诺和诺德公司生产第2个胰岛素类似物——门冬胰岛素(insulin aspart);2000年,法国赛诺非-安万特公司开发了长效胰岛素类似物——甘精胰岛素(insulin glargine);2004年,丹麦诺和诺德公司的长效胰岛素类似物——地特胰岛素(insulin detemir)上市,同时,法国赛诺非-安万特公司的另一胰岛素类似物——insulin glulisine也上市。
根据作用快慢可分为速效类似物和特慢类似物。前者有赖脯胰岛素(lispro)和门冬胰岛素(aspart),后者有甘精胰岛素(glargine insulin)。赖脯胰岛素通过将人胰岛素B链28、29位脯氨酸、赖氨酸的次序颠倒,而门冬胰岛素是将28位脯氨酸置换为天冬氨酸,胰岛素一级结构的这些改变使其从6聚体变为单体或二聚体的速度较人胰岛素快,通常在注射后15分钟起效果,达到最高血药浓度的时间为注射后30~70分钟,持续时间为2~5小时。甘精胰岛素是通过重组DNA技术生产的长效胰岛素类似物,其特点是胰岛素A链21位天门冬氨酸换成甘氨酸,在B链末端加两分子精氨酸(B31 Arg,B32Arg),使等电位从pH 5.4升至6.7,胰岛素在皮下吸收缓慢,稳定性增加,模拟人体基础状态的胰岛素分泌。起效时间为1.5~2小时,持续24小时,没有峰值。
