胰岛素原为一分子量为9kD的肽链,含有胰岛素的A链和B链,两条肽链之间由C肽相连。随后,胰岛素原被微囊转运到高尔基(Golgi)体中,并被包裹进有包膜围绕的囊泡中,此包膜上含有依赖ATP的质子泵。在高尔基体中,就开始了胰岛素原向胰岛素的转换,并且逐渐形成成熟的分泌颗粒。此过程是在两个肽链内切酶(激素原转换酶2和3)以及羧肽酶的连续作用下完成的。这些酶自身的作用特点确保了在特定位点上进行迅速的特异性裂解,移去C肽链,释放出两个裂解的二肽,并进一步组装成胰岛素。胰岛素与C肽储存在同一个颗粒囊中,最终以等分子量的形式释放。在正常情况下,激素产物的95%以胰岛素的形式分泌,少于5%以未被转换的胰岛素原的形式释放。
在正常β细胞中,通过储存颗粒途径分泌出来的胰岛素约占95%。但是,在某些类型的胰岛素瘤细胞中,还存在另一种分泌途径。在这种途径中,释放的胰岛素未经转换及包裹,即直接从由内质网转化来的囊泡中释放出来,其分泌过程绕过了加工处理胰岛素原所需要的一些细胞器,其主要产物是胰岛素原。在某些T2DM患者中,存在未完全加工处理的胰岛素前体(胰岛素原以及其分裂产物),其分泌量不成比例地升高。
β细胞根据血糖变化调整胰岛素释放量
细胞外葡萄糖以及其他某些糖类的迅速升高,可引起胰岛素原合成加速。在葡萄糖浓度与胰岛素的生物合成之间,存在着“类S型”的相关关系,此葡萄糖阈值为2~4mmol/L。刺激胰岛素分泌的葡萄糖阈值略低于此阈值,这可能是为了确保在β细胞内有一定量的胰岛素储存,但β细胞内葡萄糖的浓度不影响胰岛素原向胰岛素转换的速率。
B颗粒蛋白为嗜铬粒蛋白A的肽类类似物,其作用是使颗粒中的激素易于储存。胰岛中有较高浓度的胰淀粉样多肽(IAPP),在正常β细胞中,此物质占胰岛素的3%,与胰岛素一同存在于B颗粒中。在某些种系中,IAPP可以进行聚合,形成不溶性淀粉纤维在胰岛中沉积。IAPP致糖尿病发病的原因可能是通过对β细胞的毒性作用及其诱发的胰岛素抵抗(在超生理浓度水平)。但是,IAPP在胰岛中的沉积只发生于人类、灵长类动物以及猫中,而在一些有T2DM样症状的种系中却未发现其沉积。此外,过度表达IAPP的转基因小鼠不发生糖尿病,因此,IAPP在糖尿病病因学中所起的作用尚待进一步研究。
兴奋-分泌耦联是胰岛素分泌的基本机制
在β细胞膜上存在ATP敏感性钾通道,可以传递葡萄糖以及磺脲类降糖药物等胰岛素分泌促进剂的信号。其他一些促胰岛素分泌的假定途径还包括细胞内钙离子浓度的增加以及蛋白激酶C和三磷酸肌醇活性的升高等。
ATP敏感性钾通道
与细胞膜外部相比,β细胞膜内部保持着负性电位。像所有细胞那样,β细胞内有较高的钾离子浓度,这就造成了细胞内钾离子顺着其浓度梯度向细胞外移动的趋势,钾离子外流中断引起细胞膜除极,当除极到达一定阈值时,触发胰岛素分泌。补片-钳夹技术(能够测定跨细胞膜微小区域内电传导的变化)表明,在β细胞内部的ATP可以引起细胞膜上钾通道的关闭,使葡萄糖的代谢与电生理作用耦联起来,钾通道关闭促进钙离子通过电压依赖性钙通道向细胞内流动,其结果是细胞内钙离子增加,刺激胰岛素分泌。在细胞内部,有可能是ATP/ADP比值,而不是总的ATP浓度决定了这些离子通道的开启与关闭。
胰岛β细胞的K+通道由(SUR1/Kir6.2)4分子组成。其中SUR为磺脲类受体(sulphonylureas receptor),有2类;Kir 为K+内向调校子(potassium inward rectifiers),有6类,依照它们的电化学特性及对核苷酸的敏感性和药学特性,K+通道异构体分下列几类。
K+-ATP通道异构体
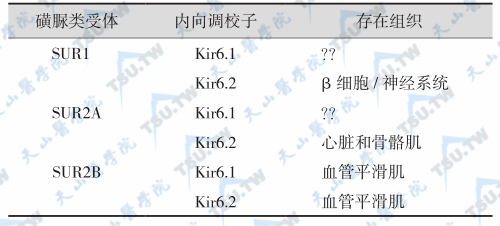
SUR1是ATP结合盒子(ATP binding cassette,ABC)超级家族的成员。SUR1由424个氨基酸残基组成,分子量140kD,是一个高亲和力的受体,而SUR2是一个低亲和力的受体,其亲和力为SUR1的1/1000~1/100。在424个氨基酸残基中,SUR1与SUR2有390个氨基酸(70%)是相同的。SUR2主要分布在胰岛β细胞以外的组织。人类的SUR1 和Kir6.2基因位于11p15.1。SUR1基因含39个外显子,约100kb。Kir6.2基因位于SUR1基因的下游,间隔4900bp。SUR1具有不同程度的糖化,其中140kD蛋白是受体的核心部分,存在于膜内,而150~170kD蛋白是一个多糖化的复合体(成熟受体),存在于浆膜中。Kir6.2组成钾通道孔径,而SUR1与Kir6.2紧密结合,介导腺苷酸对通道的调节作用。Kir也影响SUR的成熟,使它们在结构和功能上形成一个完整的复合体,再由4对1∶1的复合体组成一个ATP敏感性钾通道(SUR1/Kir6.2)4,见下图。
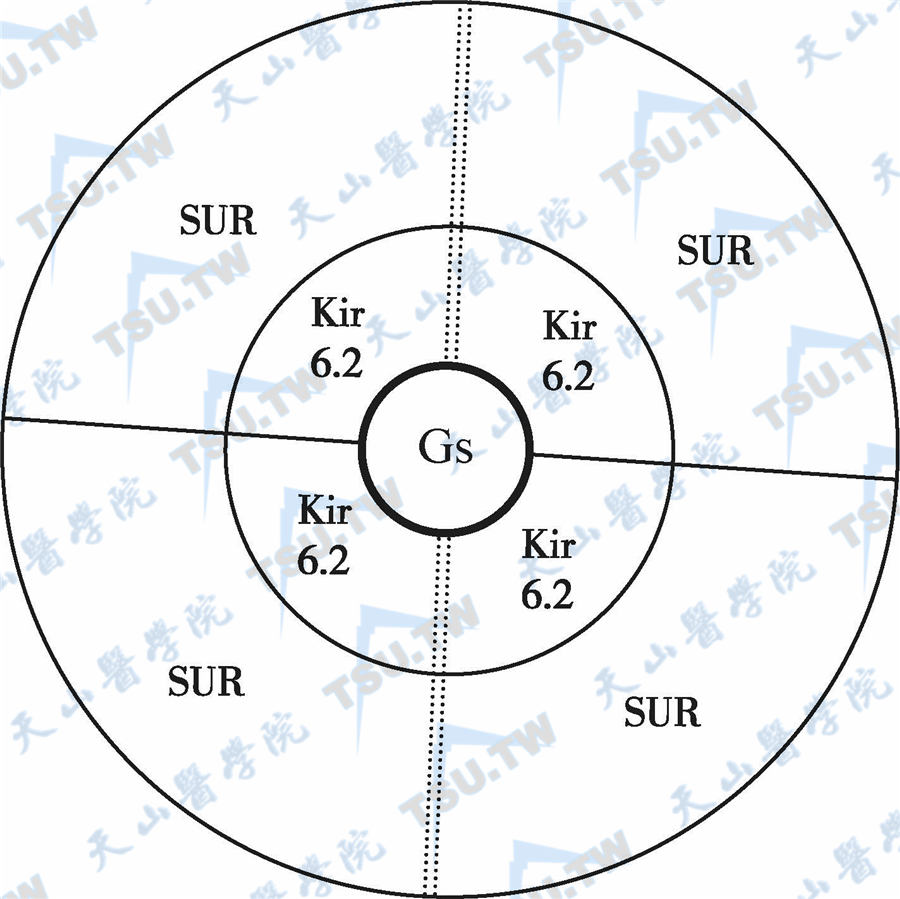
SUR/Kir6.2钾通道的结构模型
ATP、ADP及ATP/ADP比值调节K+-ATP通道的活性,使其复原(refreshment,抑制或兴奋)。缺乏ATP(如在无ATP液中)时,钾通道的活性丧失或下降,加入Mg2+后,ATP可使通道活性复原,但ATP的作用仍是抑制通道的活性。Mg2+-ADP是刺激通道开放的,其中有Mg2+的存在至关重要,同时,ATP/ADP比值也是调节通道活性的关键因素。尽管ATP的结合部位在SUR,但ATP可以直接作用于Kir6.2。SUR1的作用是使Kir6.2通道对ATP的抑制作用敏感。与SUR1/Kir6.2有关的调节胰岛素分泌的水孔蛋白2 (aquaporin2,AQP-2)可通过调节β细胞水和电解质的平衡而影响胰岛素的分泌。
cAMP和钙离子
cAMP并不启动葡萄糖诱导的胰岛素分泌,而是胰岛素分泌的增效剂,一些因素激活腺苷环化酶(如胰高血糖素)或者抑制cAMP磷酸二酯酶(如异丁基甲基黄嘌呤)后,可以引起细胞内cAMP浓度的增加,从而发挥cAMP的作用。胰高血糖素样肽-1(GLP-1)以及GIP是另外一些对胰岛素分泌具有调节作用的因素,它们也可通过这一机制调节胰岛素的分泌。
胰岛素的分泌是一个依赖钙离子的过程,有些胰岛素分泌促进剂可将钙离子从细胞内的贮库中动员出来,即使在有某些拮抗钙离子向细胞内流动的药物存在的情况下,这些分泌促进剂也可发挥作用。以这种方式发挥作用的化学成分可产生三磷酸肌醇(IP3)。随后,IP3可以将钙离子从内质网的钙离子贮库中释放出来。在胰岛细胞中,存在依赖钙离子的调节蛋白(如钙调蛋白),这些调节蛋白间接影响葡萄糖诱发的胰岛素分泌。在β细胞中,钙调蛋白可能通过激活“依赖钙离子-钙调蛋白的蛋白激酶”的活性而发挥其作用,蛋白激酶的激活会引起一些蛋白质磷酸化。可能的目标蛋白包括微管蛋白的亚基、微丝蛋白以及肌浆球蛋白的轻链等。蛋白质的磷酸化可调控分泌颗粒的运动。
蛋白激酶/C磷脂/IP3/花生四烯酸
蛋白激酶C (PKC)的活性被钙离子和磷脂酰丝氨酸激活。这些蛋白激酶在β细胞内将底物磷酸化而发挥其作用。它们可使底物产生单一的磷酸化中间产物,以触发颗粒的转位和细胞排粒作用。细胞膜上含有二磷酸磷脂酰肌醇,可被“依赖钙离子的酶”——磷脂酶C水解,产生IP3,刺激内质网中的钙离子释放,诱发胰岛素分泌。在体外试验中,将花生四烯酸加入胰岛内,可以刺激胰岛素分泌,并且使颗粒膜与细胞膜易于融合,说明花生四烯酸在胰岛素分泌过程中有作用。花生四烯酸有两条代谢途径(环氧化酶和脂氧化酶途径),其中,脂氧化酶途径(12-HETE)的主要产物存在于胰岛中,在β细胞兴奋-分泌耦联中,可能有花生四烯酸的参与。
