β细胞分泌颗粒含胰岛素/胰岛素原/胰淀粉样多肽
细胞排粒
胰岛素的释放是通过细胞排粒作用来完成的。颗粒首先移动到近细胞膜处,随后,颗粒膜和细胞膜融合,并将颗粒内容物释放出来。随着颗粒膜的插入,新扩展的细胞膜通过细胞摄粒作用被“吸”入细胞中,并且再循环进入Golgi体中,以备重新使用。细胞排粒后,遗留在细胞膜上的不规则部分称为微绒毛。在分泌过程中,对分泌颗粒向细胞膜的转运可以进行独立的调控,使颗粒在接近细胞膜的区域内进行聚集,形成了膜下的颗粒池。这些颗粒池易于释放,其释放量反映了葡萄糖刺激后的第1时相胰岛素分泌。
颗粒转位
细胞骨架(即微管和微丝系统)可引起胰岛素储存颗粒的运动和释放。微管蛋白亚基(54kD)的聚合形成微管系统。秋水仙碱以及各种其他微管(纺锤体)毒素可抑制胰岛素的释放,提示微管系统在胰岛素释放中起作用。秋水仙碱通过与微管蛋白亚基结合,引起微管系统的解聚;长春新碱能与微管蛋白尾端结合而抑制微管形成,使细胞分裂终止在M期;诺考达唑(nocodazole)则通过微管系统的解聚抑制葡萄糖刺激的胰岛素分泌。
在通常情况下,微管系统从核周区域开始向外呈放射性分布,形成一个网络。当细胞暴露在秋水仙碱中时,可以导致此网络的破坏。微管系统可能以定向模式为分泌颗粒的移动提供途径,但微管系统并不提供动力。其他一些收缩蛋白,特别是肌动蛋白和肌球蛋白,可能参与了分泌过程。
分泌出泡
除胰岛素和胰岛素原外,分泌出泡的胰岛素颗粒里还含有胰淀粉样多肽和GLP-1。在大部分应答调节β细胞功能的因素的刺激中,胰淀粉样多肽与胰岛素一起分泌;胰淀粉样多肽对含有胰岛素和胰淀粉样多肽不同成分的颗粒有选择性抑制释放作用,具有自分泌作用。此外,有些胰淀粉样多肽不被包装进分泌颗粒中,而是进行聚合,形成不溶性的淀粉纤维。这些纤维的沉积有可能对T2DM中β细胞功能不足的发生具有一定的作用。IAPP的毒性主要表现为对胰岛素的分泌抑制,然而不同的细胞株对胰淀粉样多肽的敏感性不同。
小肠神经内分泌细胞分泌GIP和GLP-1
葡萄糖和其他可以主动转运的糖类、氨基酸以及长链脂肪酸的吸收都可引起其分泌。GIP作用于β细胞膜的特异性受体上,激活腺苷环化酶,导致cAMP的产生,改变细胞内钙离子的分布,通过激活PKA,使相关蛋白磷酸化,以增强β细胞对钙离子的敏感性。GLP-1为小肠上段细胞分泌的另一种多肽,与特异性G蛋白耦联受体结合后,活化β细胞的碳酸酐酶,促进胰岛素分泌。因此,GLP-1类似物可用于糖尿病的治疗。GLP-17~36酰胺由小肠下段内分泌细胞分泌,是胰高血糖素原另一种加工处理后的产物。糖类、蛋白质和脂肪消化产物的吸收可以刺激它释放入血循环。在循环中,GLP-17~36酰胺的浓度相对较低,但是,它是胰岛素分泌有效的刺激物。给健康者输注GLP-17~36酰胺,使其剂量与餐后血液循环中葡萄糖升高的水平相当,可以引起依赖葡萄糖的胰岛素分泌。GLP-17~36酰胺通过作用于β细胞上的特异性受体,激活腺苷环化酶,使细胞内cAMP浓度增加,也可能对细胞膜上的离子通道有作用。
整合性调节是稳定血糖的重要机制
胰岛素分泌调控的主要生理因素是血糖浓度,但许多其他因素,如代谢性、内分泌性、神经性因素以及药物都可影响β细胞的分泌功能(下图)。
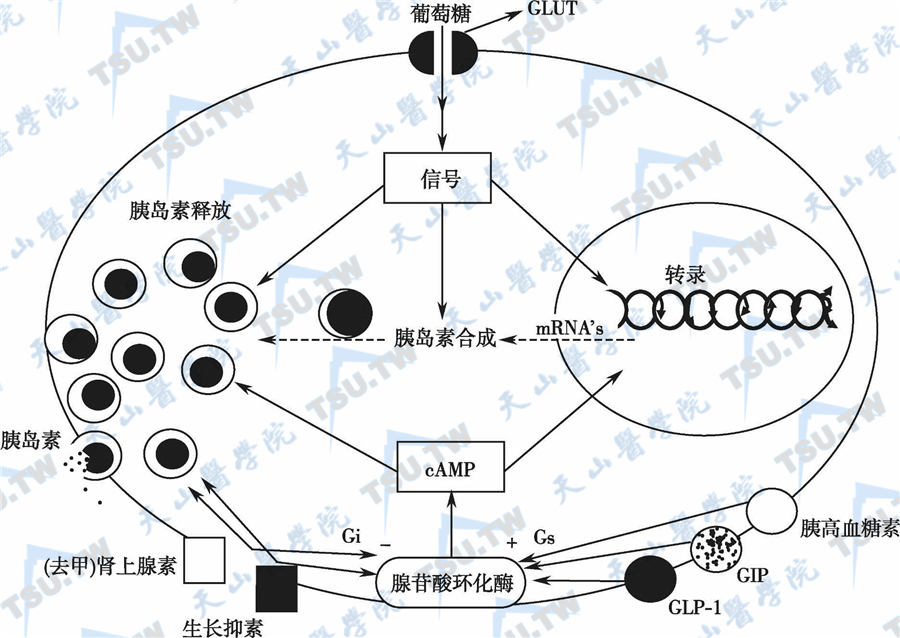
β细胞胰岛素分泌的调节
注:Gi:抑制性G蛋白亚基;Gs:兴奋性G蛋白亚基;GLP-1:胰高血糖素样肽-1;+:代表兴奋;-:代表抑制;GIP:葡萄糖依赖性促胰岛素分泌肽。β细胞膜上含有胰高血糖素、GIP、GLP-1、生长抑素、肾上腺素受体和GLUT。
葡萄糖调节作用
β细胞对细胞外葡萄糖浓度在狭窄的生理范围内变化非常敏感。葡萄糖浓度低于5mmol/ L时,不会影响胰岛素释放的速率。但当细胞外葡萄糖在5.5~17mmol/L时,胰岛素分泌速率将显著提高;当葡萄糖浓度在8mmol/L时,达到最大半数刺激值。这种特征性剂量-反应曲线主要是由葡萄糖激酶活性决定的。葡萄糖激酶是β细胞中葡萄糖磷酸化的限速因子,可以作为“葡萄糖传感器”,使胰岛素的分泌与瞬时的葡萄糖水平耦联起来。然而,葡萄糖通过GLUT2向β细胞内的转运无限速作用。
葡萄糖的刺激触发β细胞膜上的电活动。这由两部分构成,首先是由持续的峰电位活动组成,接下来是没有峰电位的部分复极,在经过上述变化后,有慢波发生。在细胞膜上的突发动作电位期间,电流载体钙离子通过细胞膜上依赖电压的通道向β细胞内流动。诱发胰岛素分泌的葡萄糖必须被代谢才对胰岛素的分泌有调节作用,葡萄糖代谢产生ATP,使ATP/ADP比值增加,引起ATP敏感钾通道关闭,启动胰岛素分泌的一系列过程。研究还发现,β细胞也有胰岛素受体。所分泌出来的胰岛素与β细胞的胰岛素受体结合,通过其下游途径,诱导细胞内Ca2+增加,进一步促进胰岛素分泌(自分泌反馈调节)。
整合性调节机制
一、血糖稳态下的净获得
整合性调节机制是一种胰岛分泌的调节假说,它是从胰岛的整体性出发,阐述了维持血糖浓度稳定性的机制。例如在运动时,肝糖原分解和输出增加以满足糖利用的需要,糖的代谢速率明显加快,但血糖浓度并无变化。这种现象被称为血糖稳态下的净获得。对这一现象曾有过两种解释。一是肌肉活动时,通过自主神经系统的活动,使胰岛素分泌减少,胰高血糖素的释放增多,但由于这是一种开环式调节,缺乏胰岛素和胰高血糖素的自身调节机制,因而两种激素的分泌反应不精确,难以稳定血糖浓度。另一种解释则基于闭环式负反馈调节的机制,但不可能与一般的生理性反馈调节机制相同,因为调节系统不仅要控制两种激素的分泌量,而且还必须对兴奋或抑制的时间进行调节,即整合性调节(integral regulation),用公式表示为:反应=刺激量×时间。
二、整合性调节的意义
整合性调节是一种特殊的闭环式负反馈调节,其与后者的根本区别是反应器(效应器)不仅表达了受刺激(或抑制)因素的强度,而且还表达了被刺激(或抑制)的作用时间。因此,这是一种更为精细的负反馈调节机制。运动时的血糖稳定可能是胰岛多种激素之间整合性调节的结果。运动时,血胰岛素下降,而胰高血糖素升高,动员肝糖输出以维持血糖恒定。相反,当运动减少或停止后,糖利用降低,血糖趋于升高,胰岛素分泌增多。在体内,还有作用相反的调节因素(激素或神经)参与血糖的调节,这种调控方式称为抗调节(counterregulation)。
三、整合性调节机制
人胰岛主要含有α、β和δ激素分泌细胞。β细胞位于胰岛中央,α细胞组成胰岛的周边部位,约为1~3个细胞直径厚度。细胞串(可含有δ细胞)沿毛细血管轴突入胰岛中央区,α细胞的外缘和β细胞之间为δ细胞,这种由α、δ和β细胞团组成的结构称为胰岛亚单位。胰岛细胞具有特殊分化的胞膜结构,包括紧密连接(tight junction)、间桥小粒(desmosome)和隙间连接(gap junction)。α 和β细胞间、δ和α细胞间以及δ和β细胞间存在的隙间连接可将分子量低于1000Da的物质由一个细胞的胞质运送至另一种细胞,这种转运不需要通过细胞间液来传递(隙间连接分泌)。因此,隙间连接将许多胰岛细胞联系在一起,组成功能上统一的胰岛细胞合胞体。在分泌激素时,合胞体对刺激物的反应具有功能整合性(functional syncytia)特点。例如,β细胞对葡萄糖的反应很敏感,而且某一β细胞群的胰岛素分泌具有全或无(all-or-none)特性或开关(on-off)特性。在高糖(11~16mmol/L,200~288mg/dl)钳夹试验中,第1相胰岛素分泌峰持续约数分钟,继而胰岛素分泌逐渐增多,于2小时达到最高浓度。这说明,胰岛素的第1相分泌为“开关式脉冲”释放,而第1相以后的胰岛素分泌很难用以前的理论来解释。
在整合性调节机制中,胰抑素和γ-氨基丁酸起了辅助调节作用。铬粒素A(chromogranin A,CgA)及其分解产物与许多肽类激素(包括胰岛素和胰高血糖素)一起共同贮存于激素颗粒中,并随激素一道分泌入血。胰抑素(pancreastatin,PS)为CgA的裂解片段,存在于α细胞中,PS是胰岛素分泌的强力抑制物。另一方面,γ-氨基丁酸(GABA)存在于胰岛素颗粒中,却对α细胞有明显的抑制作用。此外,在β细胞中,还存在CgA和CgB,这些旁分泌激素的片段对胰高血糖素的分泌也具有抑制效应。因此,更为合理的解释是:
- 被兴奋的β细胞数由刺激程度(糖浓度)和兴奋时间(高糖浓度持续时间)的乘积决定。由于高血糖是持续性的,故兴奋的β细胞越来越多;
- 正常情况下,β细胞的“开关式脉冲”分泌与α细胞密切相关,β细胞何时被兴奋,完全由糖浓度阈值决定。由于阈值的变化,使α和β细胞的兴奋形成往返(flip-flop)性循环,被兴奋的α(或β)细胞的激素分泌均是“全或无”性的。在α细胞受到兴奋后,释放胰高血糖素,随之分泌的PS又使邻近的α细胞兴奋(同时β细胞被抑制),细胞的兴奋反应具有整体(胰岛亚单位内的所有α细胞)统一性(整合性)。随着血糖升高,兴奋性由α细胞群转向β细胞群,参与分泌反应的β细胞逐渐增多,血胰岛素浓度与兴奋性β细胞数呈正比。当血糖降至一定水平,在GABA的作用下,β细胞群的兴奋性又开始转向α细胞群,如此往返不息。在葡萄糖钳夹试验中,由于高血糖持续存在,故兴奋性β细胞逐渐增加,直至所有的β细胞被兴奋,血胰岛素持续升高,故在胰岛素的浓度曲线中看不到脉冲峰;
- 在糖浓度正常或接近正常时,还可通过机体的其他调节系统(自主神经、胃肠激素和肾上腺皮质激素等)来控制这两种激素的分泌。
PS随胰高血糖素同时分泌,PS刺激邻近α细胞分泌胰高血糖素,同时β细胞被抑制,停止分泌胰岛素,在下图中,Ab单位代表与β细胞有功能联系的α细胞的活动占优势;aB单位代表与α细胞有功能联系的β细胞在分泌胰岛素的同时也释放GABA,后者促进邻近β细胞的兴奋,同时抑制α细胞的兴奋,aB单位的活动占优势。当血糖为5mmol/L时,Ab和aB两种单位的兴奋基本相等。从微观上看,在某一具体的合胞体结构中,只有Ab(或aB)单位被兴奋,而处于兴奋状态的细胞群是随机的。但从宏观上看,被兴奋的Ab和aB单位的比例不发生明显改变,血浆存在胰岛素和胰高血糖素两种激素,而血糖恒定在正常范围内。糖利用使血糖下降,Ab单位兴奋胰高血糖素和PS的释放,PS使aB单位(分泌胰岛素)的兴奋立即转向Ab单位(分泌胰高血糖素),血浆胰高血糖素/胰岛素比值逐渐上升(如见于运动时),只要糖利用继续增加,由于Ab/aB单位的兴奋比例增加,就稳定了血糖浓度,这即是所谓的糖稳定状态下的净获得现象。
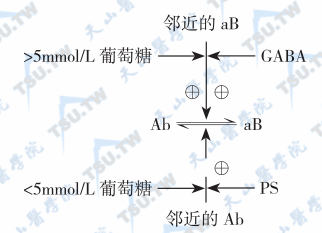
胰岛素分泌的整合调节
注:Ab代表α细胞兴奋,分泌胰高血糖素;aB代表β细胞兴奋,分泌胰岛素;葡萄糖水平升高和GABA使Ab的兴奋性转向aB的兴奋,而葡萄糖水平下降和PS使aB的兴奋性转向Ab。GABA:γ-氨基丁酸;PS:胰抑素(pancreastatin);⊕:代表兴奋。小aB和小Ab分别表邻近的β细胞和α细胞。
血糖升高时出现的情形与此相反。通过GABA对aB单位的兴奋和对Ab单位的抑制,Ab单位的兴奋立即转向aB单位,直至血糖降至正常范围内。在高糖钳夹试验中,由于高血糖是固定的,胰岛中的兴奋单位由Ab转向aB,由于这种转换是单方向持续性的,故胰岛素的分泌量呈进行性升高,直至所有的aB单位被兴奋为止。
其他调节因子
在缺乏葡萄糖的情况下,亮氨酸和精氨酸是非常有效的胰岛素分泌促进剂,可作为胰岛素分泌的启动因子。亮氨酸、酮酸和2-酮异己酸有可能通过各自的代谢而产生ATP,关闭ATP敏感的钾通道,与葡萄糖的作用相似。
非酯化脂肪酸(NEFA或FFA)急剧升高可促进胰岛素的分泌(可能是由于β细胞线粒体的乙酰CoA氧化,增加了ATP的可利用性,而线粒体外的IP3和二酰基甘油生成增多促进了胰岛素颗粒的胞吐作用),但长期的NEFA升高却抑制葡萄糖诱导的胰岛素分泌和合成,胰岛素原/胰岛素分泌比值增加,这是因为脂肪酸影响了β细胞的过氧化物酶体增殖活化受体(PPAR)基因的表达所致,而PPARγ激动剂(罗格列酮)对NEFA诱导的胰岛素分泌受损有保护作用。有许多激素、神经递质以及调节肽都可能影响胰岛素的释放。胰岛素分泌促进剂包括胰高血糖素、抑胃肽(GIP)、胆囊收缩素、阿片肽、血管活性肠肽(VIP)以及胰高血糖素样肽-1 (GLP-1);对胰岛素分泌起抑制作用的物质有肾上腺素、去甲肾上腺素、生长抑素、甘丙素(galanin)以及神经肽Y。胰岛有丰富的自主神经支配,对促进胰岛素的释放也具有非常重要的作用,迷走神经的输入端可以刺激胰岛素的释放,而交感神经兴奋(以及血液循环中的儿茶酚胺)抑制胰岛素的释放。副交感神经系统对胰岛素分泌的刺激作用是通过毒蕈碱样胆碱能受体来完成的,而血液循环中以及局部释放的儿茶酚胺则通过α2-肾上腺素能受体,抑制胰岛素的分泌。
胰岛旁分泌激素精细调节血糖
胰高血糖素
胰高血糖素刺激胰岛素的分泌,在β细胞中,胰高血糖素与其特异性受体结合,激活腺苷环化酶,引起cAMP产生,并刺激GTP抑制蛋白(Gs)来完成其功能。随后,cAMP激活PKA,而PKA将细胞内蛋白质磷酸化,使得β细胞分泌机构对钙离子的敏感性增强。
生长抑素
在胰岛中,从δ细胞中释放出来的生长抑素被认为是对相邻的β和α细胞中胰岛素及胰高血糖素分泌有效的、重要的局部抑制因素。生长抑素引起cAMP形成的降低,将G蛋白介导的作用“对话”(cross-talk)到离子通道上,导致细胞膜超极化,引起细胞质中钙离子浓度下降,从而抑制胰岛素分泌。生长抑素还可能干扰后期的细胞排粒作用。
其他多肽
PS的释放和为应答葡萄糖及一定数量其他分泌促进剂而产生的胰岛素的分泌相平行。PS对葡萄糖诱发的胰岛素分泌的抑制作用是由其对电压依赖性钙通道的抑制作用来介导的。此多肽对于胰岛细胞分泌功能的作用是通过局部效应介导的,这种局部效应可起源于细胞本身(自分泌),也可来自周围邻近细胞(旁分泌)。
含31个氨基酸残基的C肽在胰岛素原的加工处理过程中被释放出来,它也储存在β细胞的分泌颗粒中,在细胞排粒作用中与胰岛素一起分泌。一般认为,C肽不具有生物活性。但是,近期的证据表明,大鼠胰岛素瘤细胞上已发现有特异的C肽受体。还有报道表明,C肽可以抑制胰岛素和胰高血糖素分泌。
自主神经系统调节胰岛素和胰高血糖素分泌
自主神经支配
胰腺的胰岛有非常丰富的自主神经纤维支配,这些神经纤维的末梢中,不仅含有神经递质(乙酰胆碱和去甲肾上腺素),还含有大量已知和推测的神经肽递质。VIP和胃泌素释放肽(GRP)似乎可以出现在副交感神经中,而galanin和NPY则与交感神经有关。这些非肾上腺素能和非胆碱能神经的调节机制有可能参与对内分泌胰腺功能的调控,但是其作用范围还存在争论。
进食期间,副交感神经的活动对于胰岛素释放的第1时相具有关键性意义,而在应激状态(包括运动以及损伤)时,交感神经活动可部分抑制胰岛素分泌。进食以及损伤可以诱发胰高血糖素的分泌。胰高血糖素以及胰多肽(PP)对低血糖的反应,可能受副交感神经活动的介导(下图)。乙酰胆碱刺激胰岛素、胰高血糖素和PP的释放。通过与毒蕈样受体结合发挥其对β细胞的作用。与受体结合后,激活磷脂酶C,产生IP3及二脂酰甘油,这两种物质均可在细胞质内钙离子浓度升高的情况下增强葡萄糖的作用,并且可以通过激活PKC,增强分泌系统对钙离子的敏感性。乙酰胆碱还可以促进钙离子向β细胞内的流动,但该作用途径及机制不明。
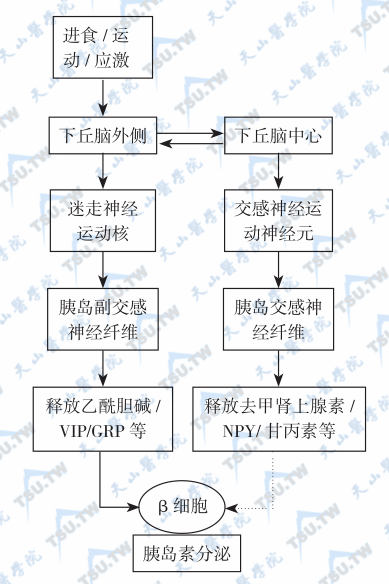
自主神经对胰岛素分泌的调节途径
其他神经支配
VIP刺激胰岛素的分泌,可能与增加细胞质钙离子浓度有关。GRP是胰岛素、胰高血糖素、生长抑素和PP分泌非常强有力的刺激物质。GRP与β细胞膜上特异性受体相结合,导致磷脂酶C的激活,引起IP3和二脂酰甘油的产生,刺激胰岛素分泌。除此之外,GRP还抑制细胞膜上的钾通道,引起细胞的除极,以增加钙离子内流。
PPARγ诱导成纤维细胞生长因子21(FGF21)表达。FGF21是FGF家族的非典型成员,具有广泛的代谢作用,如增强胰岛素的敏感性,刺激肝糖异生、脂肪酸氧化和酮体生成。FGF21亦抑制躯体生长。(刘辉文 袁凌青)
