认识糖尿病心脑血管病
糖尿病心血管病属于糖尿病慢性大血管病变的范畴,主要涉及糖尿病性心脏病(diabetic cardiopathy,DCP)、脑血管病(cerebrovascular disorder,CVD)及外周血管病(peripheral vascular disorder,PVD)三个领域。糖尿病性心脏病(diabetic cardiopathy)是指由于糖尿病所引起的,在糖和脂肪等多代谢紊乱长期得不到纠正的基础上发生的心脏大血管病变、微血管病变以及自主神经病变。其中,大血管病变主要位于心脏表面的冠状动脉,即糖尿病性冠心病;微血管病变是指心肌内的微小血管病变,即糖尿病心肌病(diabetic cardiomyopathy);支配并调控心脏活动的自主神经形态与功能异常主要引起心律失常。
糖尿病心脏病与非糖尿病患者相比,其起病更早,糖尿病患者伴冠心病常表现为无痛性心肌梗死,梗死面积比较大,穿壁梗死多,病情更严重,预后更差,病死率更高。男性糖尿病心脑血管病的发生率约为非糖尿病患者群的2.5倍,女性则高达3.5~4.5倍。如冠状动脉造影和临床排除冠状动脉病变,糖尿病患者出现严重的心律失常、心脏肥大、肺淤血和充血性心力衰竭,尤其是难治性心力衰竭,临床可考虑糖尿病心肌病变。流行病学资料表明,约50%的初诊2型糖尿病患者已有冠脉病变;70%以上的糖尿病患者死于心血管并发症或伴随症,心肌梗死是2型糖尿病的首要致死病因。
糖尿病是脑血管病的独立危险因素,糖尿病者脑血管病发生率较非糖尿病者明显增高,女性尤甚。Framingham研究发现,45~74岁糖尿病脑梗死发生率较非糖尿病者男性高2.5倍,女性高3.7倍。而且,糖尿病者各年龄段缺血性脑卒中的发生率均高于非糖尿病者。糖尿病脑血管病以脑动脉粥样硬化所致缺血性脑病最常见,如短暂性脑缺血发作(transient ischemic attack,TIA)、腔隙性脑梗死、多发性脑梗死和脑血栓形成等。脑血栓形成多发生于大脑中动脉,而腔隙性脑梗死则多见于脑内深穿支的供血区,如壳核、内囊、丘脑及脑桥基底等。由于糖尿病高血压发生率甚高(20%~60%),出血性脑病亦很常见。
糖尿病患者有易发血管闭塞性疾病的倾向,外周血管病变(PVD)的发生率至少是非糖尿病患者的4倍,且随年龄增长和病程延长而增加。多中心流行病学调查显示,我国50岁以上的糖尿病人群中有近1/5患有PAD,糖尿病患者是否容易患PAD与年龄、吸烟、糖尿病病程、血糖升高水平及收缩期血压有关,但与性别无关。糖尿病患者的PVD具有发病年龄早、进展快和病情重等特点。据报道,糖尿病患者中,62%的足部难治性溃疡和46%的截肢与动脉缺血有关。本节主要讨论糖尿病心血管病。
糖尿病患者发生动脉粥样硬化的机制不仅包括传统的危险因素如高龄、女性、遗传、高血糖、血脂紊乱、高血压、吸烟和肥胖等,还包括胰岛素抵抗(IR)、内皮细胞功能受损、纤溶系统异常、氧化应激反应增强、慢性炎症反应、细胞因子增高和白蛋白尿等非传统危险因素。传统的和非传统的危险因子相互联系与共同作用,导致动脉粥样硬化的发生与发展(下图)。许多因素促进动脉粥样硬化的进展,最初是其中的一种危险因素参与,从改善内皮细胞功能或者是改变脂质氧化到巨噬细胞和血管平滑肌增生,其共同途径是因内皮细胞损伤而形成动脉硬化斑块。
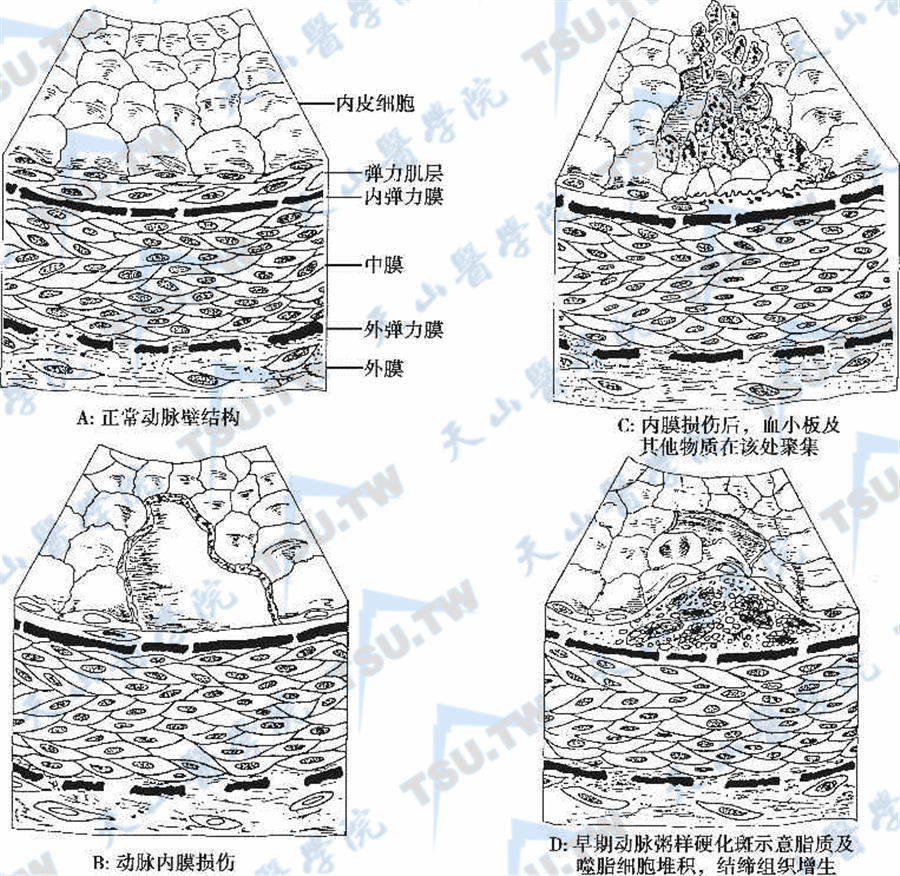
动脉粥样硬化斑的形成过程
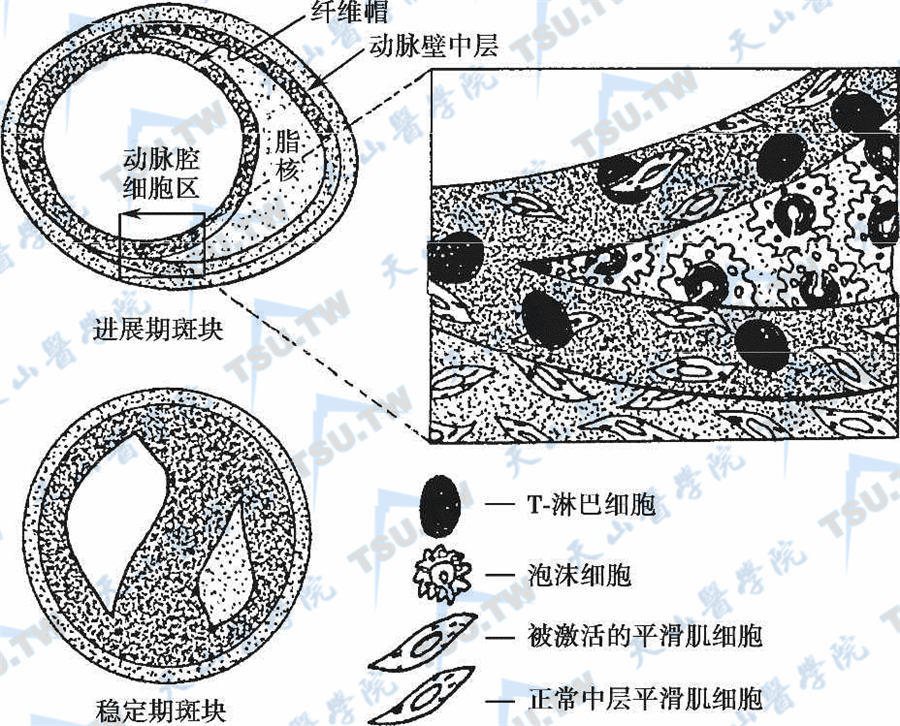
脆性斑块和动脉硬化性血栓的形成
注:脆性斑块破裂导致动脉血栓形成,后果由动脉壁损伤或缺血所诱发。在一般情况下,脆性斑块并非动脉狭窄的原因,当斑块的纤维帽破裂时,平滑肌细胞、巨噬细胞和淋巴细胞被激活,与纤维帽作用,合成的金属蛋白酶等降解基质蛋白(胶原纤维),使不稳定的斑块纤维帽破裂
传统危险因素引起动脉粥样硬化和心血管病
遗传因素
2型糖尿病、高血压、高脂血症、冠心病和肥胖症均被发现有家族聚集现象,尤其与红细胞膜钠-锂逆转换(sodium lithium countertransport,SLC)、血管紧张素转换酶基因、瘦素基因和载脂蛋白E基因的多态性等有关。
高血糖
高血糖时,血红蛋白与葡萄糖结合成糖化血红蛋白(HbA1c),其输氧功能下降,尤其在葡萄糖酵解中,2,3-二磷酸甘油酸(2,3-DPG)下降,氧分离困难,组织缺氧;高血糖还通过醛糖还原酶(aldose reductase)生成更多的山梨醇,刺激动脉平滑肌细胞及成纤维细胞增生。英国前瞻性糖尿病研究(UKPDS)表明,HbA1c可以预测缺血性心肌病,HbA1c每增加1%,冠心病的危险性增加10%。
餐后高血糖与糖尿病大血管并发症的关系更密切。目前认为,即使是餐后血糖一过性波动也可通过以下的机制产生心血管损害:
- 葡萄糖毒性作用:过高的餐后血糖加速蛋白非酶促糖化(早期产物由HbA1c表示,晚期产物由蛋白糖化终产物AGEs表示),并可通过众多机制影响血管,如红细胞膜糖化后,红细胞变形能力下降;糖化低密度脂蛋白(LDL)很难被LDL受体识别,吞噬细胞通过清除途径增加对LDL的摄取,并形成泡沫细胞;LDL更易氧化,并刺激血小板聚集;AGEs通过细胞因子的增殖作用,促进血管基质增生。
- 餐后高血糖增强氧化应激反应,加剧血管病变发展。
- 餐后高血糖使D-二聚体和凝血酶原片段释放入血,凝血酶形成增加,继而导致纤溶增加和反复的凝血机制激活。
- 高血糖激活内皮细胞蛋白激酶C(PKC),刺激黏附因子表达。
肥胖
中心性肥胖和高胰岛素血症、胰岛素抵抗、脂代谢紊乱、前炎症/前血栓状态关联。脂肪组织合成和分泌许多生物活性物质(如脂联素、抵抗素、瘦素、纤溶酶原激活物抑制物、TNF-α和IL-6等),促进心血管损害(见本篇第31章第248节)。脂联素通过各种途径发挥其抗动脉粥样硬化作用(图5-29-20):①抑制TNF-α诱导的单核细胞黏附和E-选择素(E-selectin)、VCAM-1及ICAM-1等在内皮细胞表达;②激活环一磷酸腺苷(cAMP)-蛋白激酶A,抑制核因子-κB (NF-κB)的信号传导,抑制内皮细胞黏附;③直接与血小板衍生生长因子(platelet-derived growth factor,PDGF)-BB结合并间接抑制PDGF-BB刺激的平滑肌细胞(P42/44)细胞外信号相关酶表达,从而抑制PDGF-BB诱导的血管平滑肌增殖与迁移;④通过磷脂酰-肌醇3激酶(PI3K)途径间接刺激内皮细胞产生NO,改善内皮细胞的舒张功能。研究发现,冠心病患者的血浆脂联素明显降低,糖尿病伴冠心病者脂联素更低,因而特别容易发生动脉粥样硬化。
心脏外脂肪覆盖了80%的心脏表面,紧靠心脏的脂肪组织沿冠状动脉分布,几乎覆盖了全部右心室。从生理上看,心外脂肪垫起了保护和缓冲冠状动脉和心脏作用,并为冠状动脉和心肌的微循环提供能量(脂肪酸)。但肥胖引起的心脏外脂肪堆积是冠状动脉粥样硬化独立危险因素。
脂质代谢紊乱
美国国家胆固醇教育计划成人治疗方案第3次指南(NECP-ATPⅢ)把糖尿病从冠心病危险因素中删除,而将糖尿病视为冠心病的等危症,因为无冠心病史的糖尿病患者发生主要冠脉事件的危险与冠心病患者等同,其在10年内发生初次心肌梗死的危险>20%,等同于患过心肌梗死的非糖尿病患者10年内再发心肌梗死的危险度。UKPDS研究发现,血脂谱异常是冠心病的独立危险因素,糖尿病合并血脂谱异常显著增加心血管事件的发生率。在糖尿病中,以LDL-C升高者冠心病风险最大,其次是HDL-C降低、HbA1c、高血压和吸烟。2型糖尿病的血脂谱特点是:①LDL-C升高或正常,但是即使LDL-C正常,也常伴有小而密LDL颗粒增加,而后者的致动脉粥样硬化作用更强;②HDL-C降低;③TG升高。
一:HDL-C下降
是糖尿病患者血脂紊乱的特点之一。在糖尿病患者中,血浆HDL-C低于正常,其降低程度与TG增高相关,提示在T2DM中血浆HDL-C可能与病情控制有关。TG增高时,胆固醇酯酰基转运蛋白(cholesterolestertransf erprotein,CETP)将HDL-C中的胆固醇转到VLDL的交换增加,促进了HDL-C的分解。另外,VLDL清除障碍和LPL活性降低也使HDL3向HDL2转换减少。所以,有冠心病的糖尿病患者更常出现血浆TG升高和HDL-C低下。血浆HDL浓度受下列3个因素的调节:①新生态HDL合成与进入血循环的速度;②周围毛细血管壁脂蛋白脂酶的活力;③肝内脂肪酶活性。此三者均受胰岛素调节,故HDL浓度与血浆胰岛素浓度亦有关系,糖尿病经胰岛素控制后HDL可恢复正常。
二:小而密低密度脂蛋白增多
由于每个小而密低密度脂蛋白颗粒中的胆固醇含量较低,所以糖尿病患者血浆LDL-C正常或轻度升高,其重要特点是LDL质的异常,即小而密低密度脂蛋白(sLDL)增多。sLDL容易在动脉壁沉积和被单核巨噬细胞吞噬。高TG和高VLDL刺激CETP活性,促进TG向LDL转移,从而形成sLDL。因此,sLDL较大而疏的LDL更具致动脉粥样硬化危险。许多横断面研究提示,T2DM患者sLDL明显占优势,肝脂酶(HL)活性增高,HL使富含TG的LDL脂解,形成更多的sLDL,血浆TG、CETP和HL的改变可分别解释sLDL变异的10%、5%和3%。sLDL有以下特点:①较大而轻的LDL易被氧化修饰,容易被巨噬细胞氧化和促进细胞因子的级联反应,进一步引起血管内皮和平滑肌的损伤;②与糖蛋白亲和力增加,更易与糖蛋白结合并进一步沉积在血管内膜中;③sLDL与LDL受体(apoB/ E受体)亲和力下降,使血浆LDL清除延迟,水平增加。
三:高TG血症
IR是导致脂代谢紊乱的中心环节。IR时,血中非酯化脂肪酸(FFA)增多,进入肝脏的FFA使肝脏合成极低密度脂蛋白(VLDL)及胆固醇酯。胆固醇酯浓度调节VLDL的产生,其浓度高时VLDL合成增加,富含TG的脂蛋白增多,脂蛋白脂酶(lipoprotein lipase,LPL)活性下降使VLDL和TG清除率降低。糖尿病患者高TG血症与冠心病的危险性增高相关。
四:载脂蛋白异常
载脂蛋白A1(apoA1)的糖化与血糖直接相关。研究表明,apoA1糖化使HDL-C与HDL受体亲和力下降。由于新生态的HDL-C主要由肝脏产生,进入血液循环后的主要功能是清除胆固醇,使总胆固醇水平下降,故为动脉粥样硬化和冠心病的保护因子。研究显示,血浆HDL-C升高1mg/dl(0.026mmol/L)使冠心病的危险性下降2%~3%。
apoB糖化可能对LDL代谢起重要作用。资料显示,2%~5%的LDL糖化可以减少5%~25%的LDL分解代谢,而且apoB糖化使巨噬细胞摄取糖化型LDL增多,刺激泡沫细胞形成和LDL氧化。另外,糖化型低密度脂蛋白(Gly-LDL)和氧化型低密度脂蛋白(ox-LDL)与糖尿病血管并发症的关系密切,其可能机制是:①ox-LDL被巨噬细胞识别并吞噬,使细胞内胆固醇酯聚集,形成泡沫细胞,促进早期动脉粥样硬化。Gly-LDL直接与血管基质蛋白结合,使基底膜增厚,血管壁弹性降低,两者均直接损伤血管内皮细胞,增加凝血酶原活性,刺激血小板聚集;②引发免疫反应,使吞噬细胞释放IL-1β和TNF-α等,进而导致血管病变;③T2DM患者体内自动氧化-糖基化过程增强,自由基增多,抗氧化防御作用降低。群体研究发现,HDL-C水平与冠心病的危险性呈负相关,说明HDL-C具有心脏保护作用。
性激素异常
行经期妇女较少发生动脉粥样硬化与冠心病,提示雌激素有保护作用。雌激素提高血HDL水平,故育龄期女性血HDL高于男性;但给男性患者用雌激素反使冠心病恶化。
脂联素和网膜素-1
脂联素抗动脉硬化的机制见下图。脂联素(adiponectin)有三聚体、六聚体和更大的高分子量结构(high molecular weight,HMW)等多种同型异构体,其中三聚体主要介导其在心脏、骨骼肌和下丘脑的效应。脂联素具有抗糖尿病、抗炎和抗动脉粥样硬化作用。血浆脂联素水平往往先于肥胖和胰岛素抵抗而下降。脂联素表达增加可增强胰岛素的敏感性。血浆PAI-1增加和脂联素降低共同导致肥胖患者心血管病变的发生。网膜素-1是联系骨质疏松和动脉钙化的共同因子,网膜素-1(omentin-1)通过降低RANKL/OPG比值而抑制血管钙化,但对动脉粥样硬化是否有效仍需进一步研究。
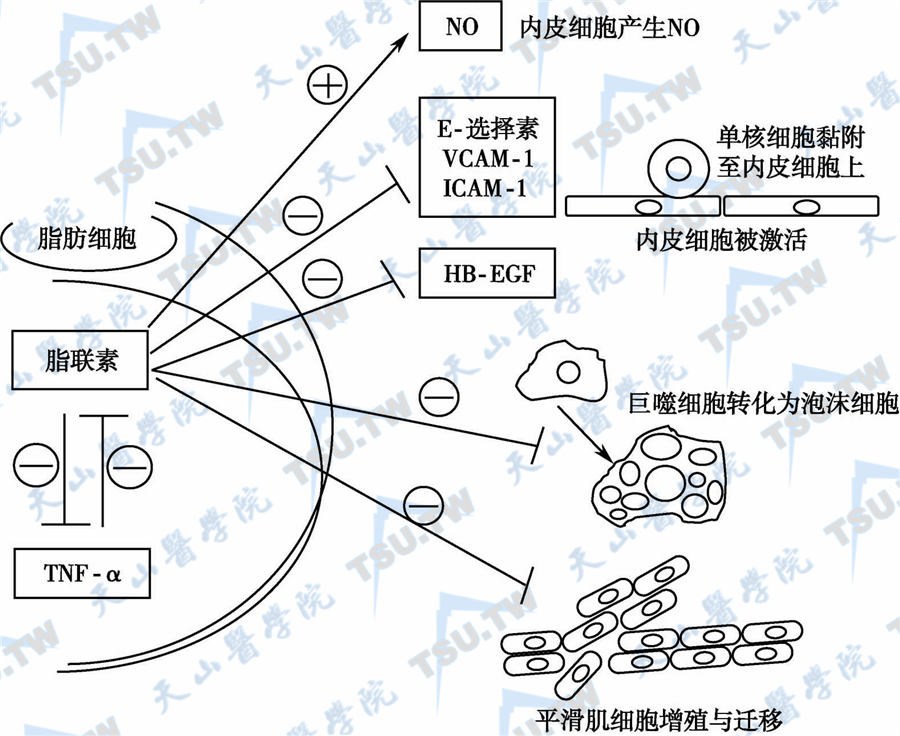
脂联素抗动脉硬化的机制
注:○+:激活;○-:抑制;NO:一氧化氮;TNF-α:肿瘤坏死因子-α;E-selection:E-选择素;VCAM-1:血管细胞黏附分子-1;ICAM-1:细胞间黏附分子-1;HB-EGF:肝素结合表皮生长因子样生长因子。
其他危险因子
其他的传统危险因子有高龄和吸烟等。
非传统危险因素引起动脉粥样硬化和心血管病
大动脉病变可能以动脉粥样硬化为主,因为血管的管腔大,除了引起血压升高、局部性血管狭窄和血栓栓塞事件外,一般不会导致血管完全闭塞。但在小动脉,高血糖、高血压和血脂紊乱可导致小动脉粥样硬化、血管壁钙化与高凝状态,这些病变可能是糖尿病冠脉病变的早期特征型表现,而代谢紊乱使内皮细胞介导的冠状小动脉扩张障碍可能是小动脉病变的启动步骤(下图)。除了上述因素外,下列病理生理改变也是引起小动脉病变的重要因素。
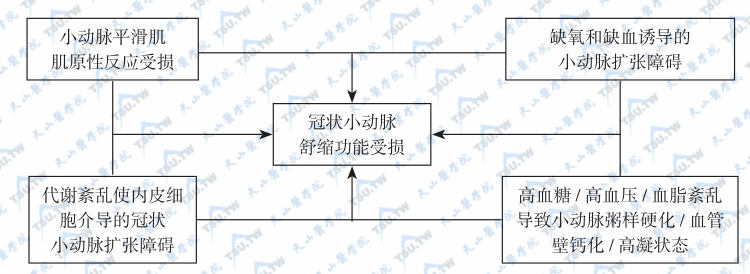
冠状小动脉病变的发病机制
注:在引起冠状小动脉病变的四条途径中,高血糖、高血压和血脂紊乱导致小动脉粥样硬化、血管壁钙化与高凝状态可能是糖尿病冠脉病变的早期特征,而代谢紊乱使内皮细胞介导的冠状小动脉扩张障碍是发病的启动步骤。
高胰岛素血症和胰岛素抵抗
高胰岛素血症使血压升高的作用机制是:①增加肾脏对钠及水的重吸收;②增加对食盐摄入的血压敏感性(盐敏感型高血压);③加强AT-2的升压作用和对醛固酮的反应性;④降低Na+/K+-ATP酶的活性,增加Na+/H+泵的活性;⑤增加细胞内Ca2+潴留;⑥刺激血管平滑肌移行,胰岛素及IGF-1促进血管病变的发展。
体脂分布较体重指数(BMI)能更好地预测胰岛素抵抗(IR)及心血管危险性。研究发现,腰围是预测IR的独立指标,可解释50%以上的IR变异。高胰岛素血症促进动脉壁脂质合成与摄取,阻止胆固醇清除,促进动脉壁平滑肌细胞增殖,形成高脂血症和高脂蛋白血症,诱发和加剧动脉粥样硬化。IR及其伴随的高胰岛素血症是冠心病的独立危险因子,但胰岛素本身对心血管疾病的作用不明。一方面,胰岛素有舒张血管和抗炎作用,可延缓动脉粥样硬化的形成。另一方面,胰岛素能刺激血管细胞生长及合成细胞外基质。胰岛素信号通路在糖代谢失调时,可反应性地增加NO的生成,而当细胞外通路失调时,即丧失其抗动脉粥样硬化作用。
醛固酮与激肽
心肌局部的醛固酮参与了动脉粥样硬化的发病过程,主要与心肌重构(cardiac muscular remodeling)有关,而螺内酯具有某种保护作用。糖尿病容易导致弥漫性、迅速进展性动脉粥样硬化,这种病变更易诱发血管重建(vascular remodeling)。激肽释放酶-激肽系统(kallikrein-kinin system,KKS)是一种血管活性肽系统,激肽通过其受体B1R和B2R参与心肌与血管重建。其中B2R有保护心肌的作用,而B1R有诱发和促进心肌病变的效应。
内皮细胞功能受损
血管内皮(vascular endothelium)对动脉粥样硬化的发生起了“第一道防线”的防御作用。研究表明,血管内皮细胞(vascular endothelial cells,EC)功能异常在糖尿病前期就已存在,随着血糖升高,血管EC功能受损逐渐加重,高血糖、高FFA血症、IR、氧化应激及慢性炎症等多种因素相互影响与累加,使动脉粥样硬化的病理改变不断进展和恶化,最终导致心血管事件的发生。
纤溶凝血机制异常
纤维蛋白溶解系统(fibrinolytic system)稳定代表着纤溶酶原激活物与其抑制物(PAI-1)间的正常平衡。过度的抑制纤溶将导致凝血和血栓形成(心血管事件)。糖尿病患者存在着纤溶和凝血机制异常,其中最重要的改变是组织型纤溶酶原激活物(tissue-type plasminogen activator,t-PA)与PAI-1间的平衡。胰岛素、胰岛素原、VLDL-C及各种细胞因子均可调节PAI-1的合成和释放。当存在高胰岛素血症、高血糖、IR及FFA升高时,肝脏合成PAI-1增加,导致纤溶抑制,促进糖尿病患者高凝、低纤溶活性和高血黏度的发生和发展,增加心血管事件的危险性。糖尿病患者的凝血异常还包括血浆纤维蛋白原、Ⅴ因子、Ⅱ因子和Ⅶ因子的改变,以及升高的D-二聚体、血管性血友病因子抗原(vWF抗原)、抗血纤维蛋白溶素和降低的抗凝血酶Ⅲ。
慢性炎症状态
许多炎症因子与糖尿病及其并发症关联。糖尿病动脉粥样硬化其实也是一种慢性炎症性病变。在糖尿病状态下,许多炎症因子(如C反应蛋白、TNF-α 和IL-6等)增高。动脉粥样硬化的形成包括一系列病理性序贯过程,即内皮损伤及功能不良→黏附分子表达增加→趋化因子释放→单核细胞募集→白细胞黏附与迁移→巨噬细胞摄取ox-LDL→泡沫细胞形成→活化型单核细胞释放细胞因子→平滑肌细胞增殖与迁移→动脉粥样斑块形成。而在T2DM患者中,IR和慢性高血糖均参与并加速这一炎症过程。CRP与动脉粥样硬化的发生、发展及预后密切相关。血CRP水平在肥胖、IR、糖耐量减低及糖尿病患者群中升高。作为独立于其他危险因素的炎症标志物,CRP与糖尿病的发生直接相关,并随病情进展而逐步升高。
其他危险因子
其他危险因子还包括微量蛋白尿、高同型半胱氨酸血症和血管壁异常等。
