精子形态学的检查是评估精子质量的一个重要方面,在严格使用精子形态学某些标准的情况下,已经证实正常形态精子百分率与不同的生育力评价的终点指标(妊娠等待时间、体内与体外妊娠率)存在联系。由于人精子形态的多样性,造成精子形态评估困难,因此,标准化的操作程序和有效的质量控制方法显得尤为重要。
精液涂片的制备
正常精液标本的涂片制备
- 载玻片的准备:新的载玻片可用流水冲洗10min,70%乙醇浸泡过夜,自然干燥备用。也可在使用前用不掉屑的纸巾,用力擦干净磨砂载玻片的两面。
- 用HB或2B铅笔在载玻片的磨砂处标记上精液样本的编号、日期等。
- 根据精子浓度,取5~10μl的精液滴在载玻片的一端。用另一张载玻片沿第一张载玻片的表面“拖拉”(不是“推”)精液滴,如下图a所示。同法制备第二张重复涂片。
- 涂片经空气干燥后进行固定及染色。
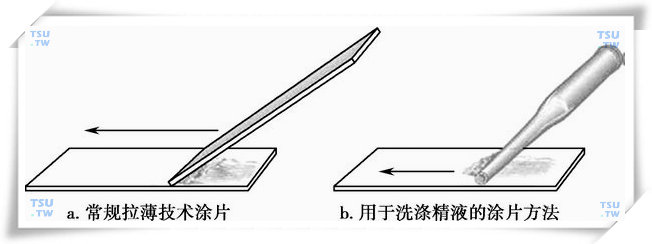
用于精子形态学分析的涂片方法
低浓度精液标本的涂片制备
如果精子浓度低于2×106/ml,直接制片很难得到满意的涂片。这时需要浓缩精液标本:将标本600g离心10min后,除去大部分上清液,用移液器轻轻吹打,使精子团重新悬于剩余的上清液中,再按正常精液标本制备涂片。浓缩后的精子以不超过约50×106/ml为宜。
洗涤精液后制备涂片
对于碎片多或黏稠的精液标本,以及为计算机辅助评估精子形态学而减少背景,可以洗涤精液。
- 在室温下,将少量精液(0.2~0.5ml,取决于精子浓度),加入到10ml生理盐水中稀释。
- 800g离心10min后,吸出大部分上清液。
- 用移液器轻轻吹打,使精子团重新悬于剩余的上清液中(20~40μl)。
- 用巴斯德吸管将5~10μl的精子混悬液均匀地涂在载玻片上(上图b)。
- 用相差显微镜在400倍镜下检查涂片,确认精子分布均匀、没有聚集成团或相互重叠,空气干燥后染色。
对于高黏稠度的精液标本,除了洗涤精液外,也可采用液化不良标本的处理方法后直接制备涂片。这些处理液化不良的方法以及离心、洗涤等操作可能影响精子形态,都必须进行记录。
精液涂片的染色
精液涂片空气干燥后(至少4h,但不超过1周),应立即固定并染色,以便清晰、详细地观察精子。WHO推荐的染色方法有巴氏染色法、Shorr染色法或Diff-Quik染色法。用上述染色法,在光学显微镜亮视野下,精子头部的顶体区染成淡蓝色,顶体后区呈深蓝色,中段可能略呈红色,尾部染成蓝色或淡红色。通常位于头部下部或围绕中段的过量残留胞质染成粉红色、红色(巴氏染色)或者橘红色(Shorr染色)。
巴氏染色法的程序
95%乙醇中至少固定15min。随后步骤如下:
- 80%乙醇 30s
- 50%乙醇 30s
- 纯水 30s
- Harris苏木精 4min
- 纯水 30s
- 酸性乙醇 浸4~8次*
- 冷流水冲洗 5min
- 50%乙醇 30s
- 80%乙醇 30s
- 95%乙醇 至少15min
- 橙黄G6 1min
- 95%乙醇 30s
- 95%乙醇 30s
- 95%乙醇 30s
- EA-50 1min
- 95%乙醇 30s
- 95%乙醇 30s
- 100%乙醇 15s
- 100%乙醇 15s
*浸1次约1s
Shorr染色法的程序
将涂片浸入酸性乙醇或75%乙醇中固定1h。随后步骤如下:
- 流动自来水 浸12~15次*
- 苏木精 1~2min
- 流动自来水 浸12~15次*
- 乙醇胺 浸10次
- 流水 浸12~15次*
- 50%乙醇 5min
- Shorr溶液 3~5min
- 50%乙醇 5min
- 75%乙醇 5min
- 95%乙醇 5min
*浸1次约1s
快速染色法(Diff-Quik)的程序
三芳基甲烷固定液15s或95%甲醇溶液固定1h。随后步骤如下:
- 快速染液1 10s
- 快速染液2 5s
- 流水 浸10~15次
精液涂片的封片
精液涂片封片或不封片均可评估精子形态,但封片后的涂片有利于长期保存,并可用于精子形态学质量控制。
对于溶于乙醇的封片剂,可在涂片上的乙醇未干时,直接使用。对于不溶于乙醇的封片剂,在染色最后一步乙醇结束后,将涂片浸入二甲苯与乙醇的混合溶液(1+1混合)1min,再浸入100%二甲苯溶液1min,将涂片取出滴干1~2s后即可封片。
精子形态学评估
正常精子形态学的分类
精子包括头、颈、中段、主段和末段。由于通过光学显微镜很难观察到精子末段,因此可以认为精子是由头(和颈)和尾(中段和主段)组成。只有头和尾部都正常的精子才认为是正常的(下图)。所有处于临界形态的精子应该认为是异常的。

人精子正常形态示意图
异常精子形态学的分类
人类精液标本中含有各种各样畸形的精子。精子的异常发生和一些附睾的病理改变常常与畸形精子百分率升高有关联。主要的精子缺陷类型有:
- 头部缺陷:大头、小头、锥形头、梨形头、圆头、不定形头、有空泡的头(超过2个空泡,或空泡区域占头部20%以上)、顶体后区有空泡、顶体区过小(小于头部的40%)、顶体区过大(大于头部的70%)、双头,或上述缺陷的任何组合。
- 颈部和中段的缺陷:中段非对称地接在头部、粗的或不规则、锐角弯曲、异常细的中段,或上述缺陷的任何组合。
- 主段缺陷:短尾、多尾、断尾、发卡形平滑弯曲、锐角弯曲、宽度不规则、卷曲,或上述缺陷的任何组合。
- 过量残留胞质(ERC):胞质的大小超过精子头部的三分之一,通常伴有中段缺陷(下图)。
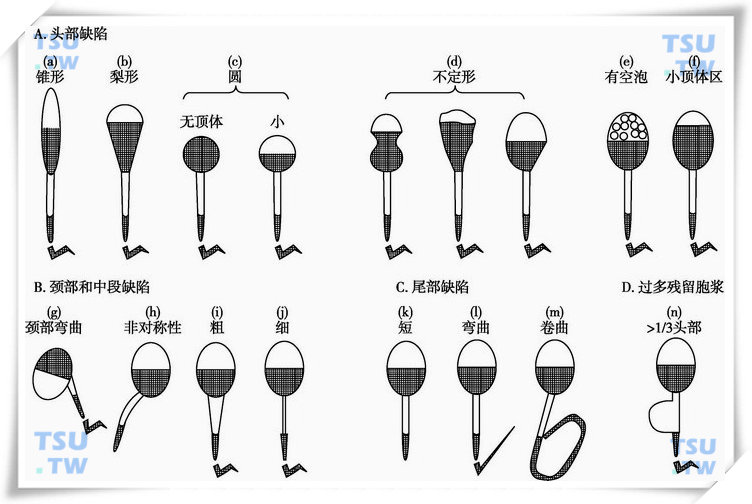
人精子一些异常形态的示意图
精子形态学评估程序
确定形态正常精子的比例十分重要,但对所有异常形态精子进行分类,得出精子头部、中段、主段缺陷或过量残留胞质的百分率,可能对诊断或研究工作是有益的。应该尽可能采用这种多重缺陷的评估方法。
- 用亮视野在1000倍油镜下观察涂片,有顺序地选择观察区域,对每个可评估的精子(具有头部和尾部的完整精子)进行形态分析。
- 每张重复涂片至少评估200个精子,借助实验室计数器,记录正常和各种异常精子的数目。
- 计算两张重复玻片的正常形态精子百分率的平均值和差异值,根据表28-3确定差异的可接受性(每个值显示两次百分率之间的最大差异,此差异为预期在95%样本中仅由取样误差造成的)。
- 如果差异在可接受范围内,以最接近的整数报告正常和各类异常精子的平均百分率。如果差异太大,则重复评估相同的涂片。
精液中,形态正常精子的总数更具有生物学意义。可将精液中精子总数乘以正常形态精子百分率得出正常形态精子的总数。
精子巴氏染色形态学图片
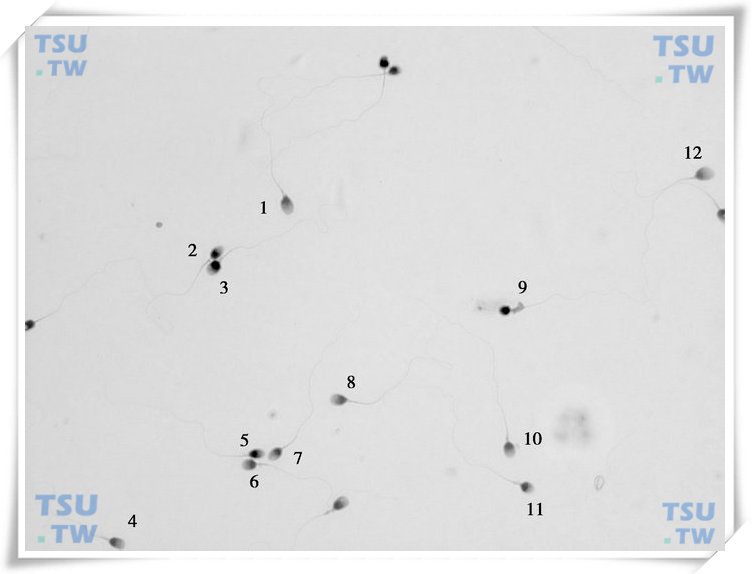
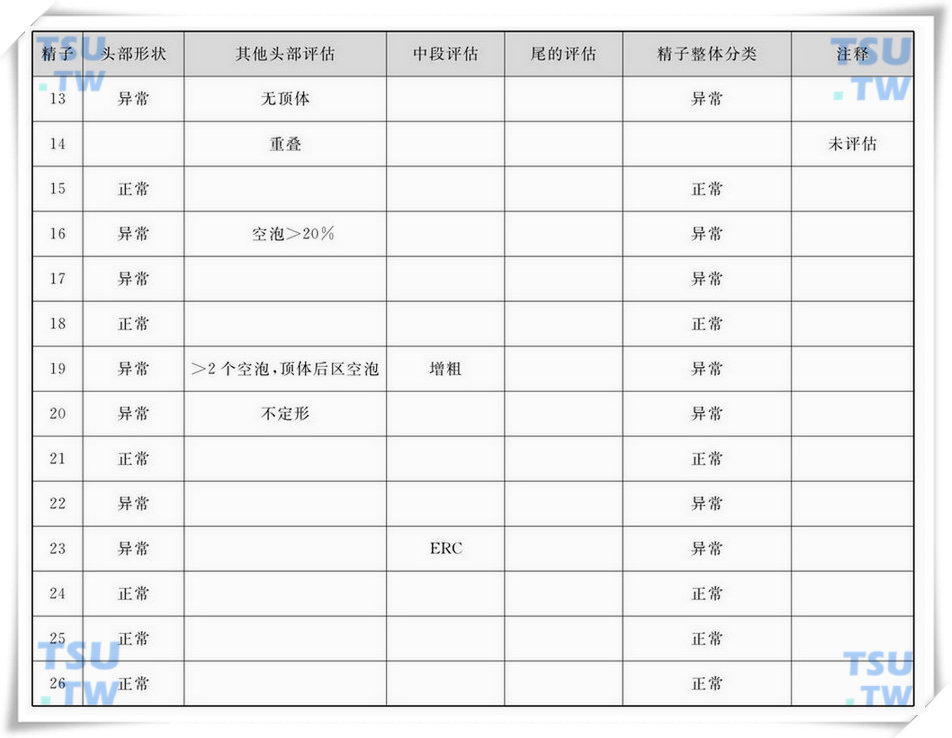
精子巴氏染色形态学图1
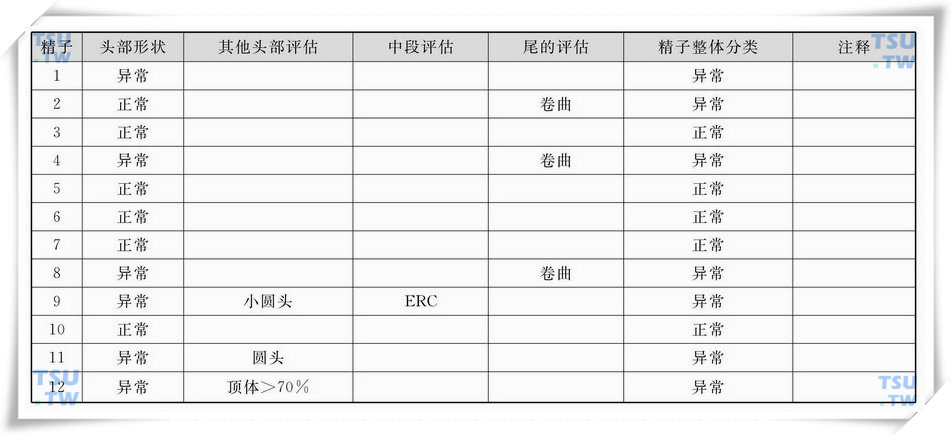
中的精子形态学评估

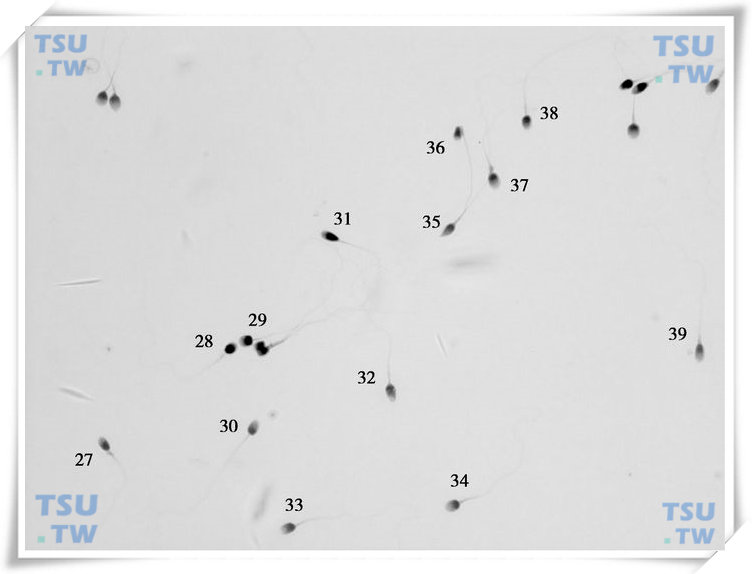
精子巴氏染色形态学图2
中的精子形态学评估
精子巴氏染色形态学图3
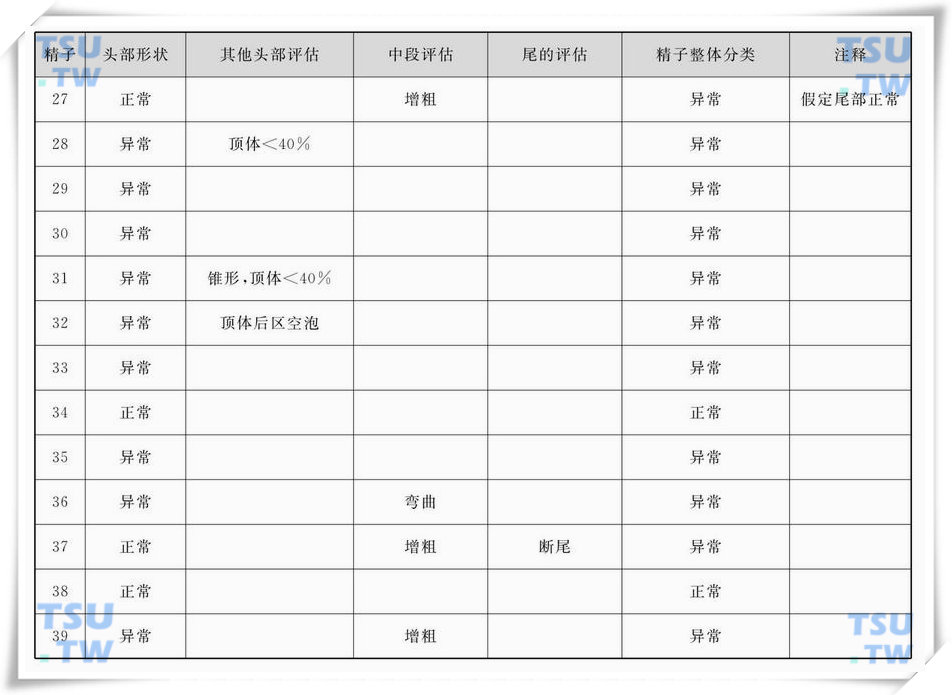
中的精子形态学评估

精子巴氏染色形态学图4
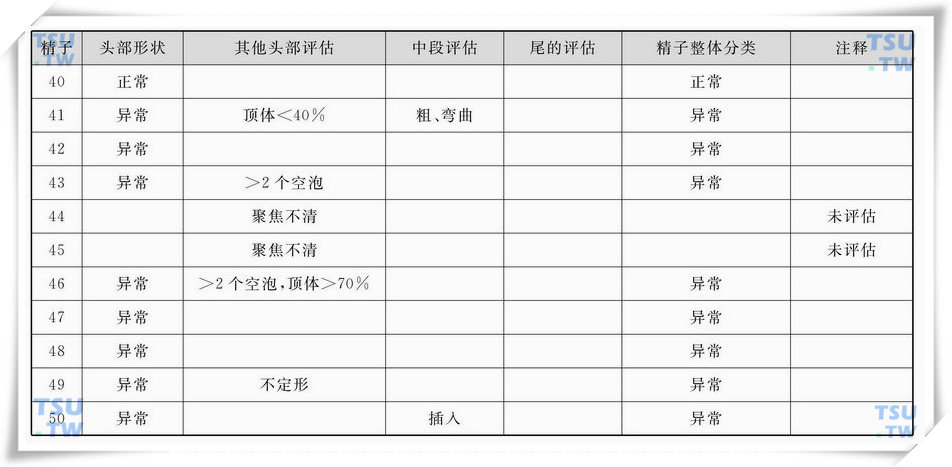
中的精子形态学评估
多重精子缺陷指数
形态学异常的精子通常有多种缺陷(头部缺陷、中段或主段缺陷,或这些缺陷的组合)。各种形态学异常发生率的详细检测可能比单一评估正常形态精子百分率更有用,尤其在研究人类精子发生损伤程度方面。采用WHO第五版《人类精液检查与处理实验室手册》给出的形态学标准,用多重异常记录系统记录精子头部、中段和主段的每种缺陷,可以得出两个指数:
一、畸形精子指数(TZI):每个异常精子缺陷的平均数(缺陷总数/缺陷精子数),由于将头部、中段和主段缺陷各计数为1,过量残留胞质也计数为1,TZI的数值范围在1~4之间。
二、精子畸形指数(SDI):缺陷总数/精子总数(包括正常和异常精子)。SDI将几种头部缺陷合并计数为1,中段和主段缺陷各计数为1(将过量残留胞质考虑为中段缺陷),因此其数值范围在1~3之间。
相关研究显示,TZI与体内生育力有关,SDI与体外受精有关,这些指数对评估某些暴露或病理状况也是有用的。
