皮肤内含有两类树突状细胞:表皮朗格汉斯细胞(Langerhans cell,LC)与真皮树突状细胞(dermal dendritic cell,DDC)。它们是皮肤内的专职的抗原提呈细胞(professional APC)。在某些病理情况下,皮肤还可以出现第三类树突状细胞:浆细胞样树突状细胞(plasmacytoid DC,PDC)。PDC分泌大量IFN-α,在病毒性疾病以及自身免疫性疾病中起重要作用。已发现红斑性狼疮、接触性皮炎、特应性皮炎、扁平苔藓及银屑病的皮损中存在PDC。
在树突状细胞家族中.LC是研究最早、最多,了解比较透彻的一群。我国对LC的研究始于上世纪80年代初。值得一提的是近年来,我国学者在LC研究领域里取得了一些国际瞩目的重要成果。例如陈洪铎通过动物实验显示表皮LC影响皮肤移植物的存活,王秉鹤发现人类LC表达高亲和力IgE FC受体(FcεRI),汤爱民证明E-钙黏素介导LC粘连于角质形成细胞,康克非显示LC分泌白介素-12(IL-12)。
表型与标志
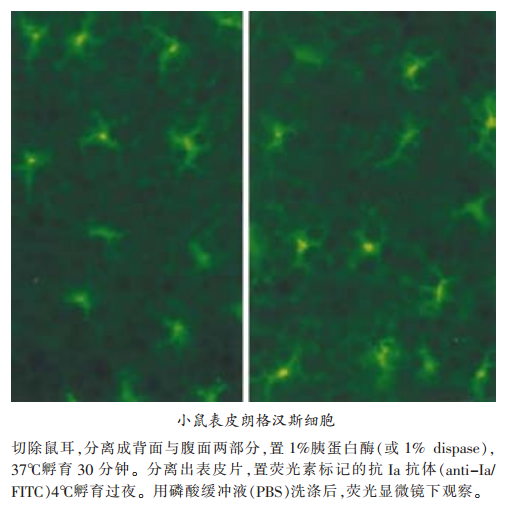
在常规HE染色的石蜡切片中无法辨认LC.但可以通过三磷酸腺苷酶( ATPase)组织化学染色以及免疫标记来清楚地显示LC的树突状形态。ATPase染色是显示人类与豚鼠LC的一种很好的组化方法,而对于鼠类LC,二磷酸腺苷酶(ADPase)染色则效果更佳。在垂直切片上,LC主要见于基底层上方。将表皮与真皮分离,用表皮片进行染色,则能更好地观察LC的形态、分布及密度。

LC的膜表面表达一些抗原分子,如MHC Ⅰ类抗原、Ⅱ类抗原以及CD1a、CD45等(上表)。某些分子可用以作为辨别LC的特异性“标志”。对于人类LC,CD1a免疫标记是最可靠的方法,而对鼠类LC.则以抗MHC Ⅱ类抗原(Ia抗原)免疫标记为首选方法(下图)。
在电子显微镜下,LC的特征性标志是伯贝克颗粒(Birbeck granule)。这种具有5层结构的细胞器呈棒状或网球拍状。伯贝克颗粒的来源及功能尚不清楚,目前有两种不同学说。“分泌学说”认为伯贝克颗粒起源于高尔基器,向细胞外周移行,附着于细胞膜,将其内容物释放至细胞外间隙。反之,“内吞学说”则认为伯贝克颗粒起源于细胞膜,由细胞膜内折而形成,然后向细胞内部移行,让LC能从细胞外摄取物质。
电子显微镜下,有些细胞形态酷似LC,但不含有伯贝克颗粒。这些细胞称为未定型细胞(indeterminate cells)。
组织分布与起源
LC主要分布于哺乳动物皮肤及黏膜的复层鳞状上皮。在表皮内,LC密度随不同的部位而异。人类的头、颈、面部、躯干及四肢约有400~1 000 LC/mm2。掌跖、生殖器、骶尾部皮肤的LC密度较低。随着年龄的老化,LC密度减少。暴露部位慢性光化性损害的皮肤中LC密度比非暴露部位低。小鼠表皮LC密度因株系、性别、年龄及部位而异。鼠尾皮肤的LC稀少,角膜中央区几乎不含LC。
LC起源于骨髓,主要证据有两方面:LC表达白细胞共同抗原CD45;同种异体骨髓嵌合小鼠及骨髓移植病人的皮肤内存在供体来源的LC。至于LC的前体细胞如何由血循环而进驻表皮,是当前研究的一个热门。真皮的成纤维细胞以及表皮的角质形成细胞分泌的趋化性因子,引导血液中LC前体细胞贴附于真皮小静脉的内皮细胞,穿过内皮进入真皮与表皮。内皮细胞与LC前体细胞表面表达的粘连分子及相应受体在这一过程中也起着重要作用。LC前体细胞通过基质金属蛋白酶(MMP)降解基底膜蛋白,穿过表一真皮连接处基底膜而进入表皮。
体外培养
长期以来,由于表皮LC数量有限以及分离手续繁琐,LC有关研究受到很大妨碍。近年来,研究取得一项重大突破:通过体外培养血液CD34+造血前体细胞而产生大量LC。Caux等首先采用粒细胞恒噬细胞克隆刺激因子( GM-CSF)及肿瘤坏死因子α(TNF-α)刺激新生儿脐带血中的CD34+造血前体细胞,产生出含有伯贝克颗粒的CD1a+ LC。接着,Stingl等从成人外周血CD34+细胞培养LC获得成功。
LC迁移与成熟
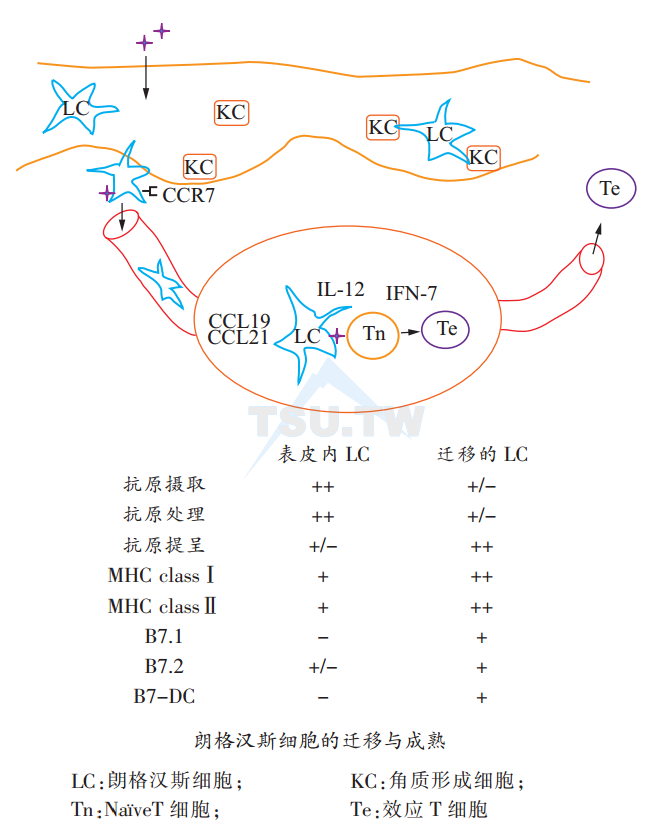
居住于表皮内的LC属于不成熟的树突状细胞,其具有很强的摄取抗原及处理抗原的能力,但刺激T细胞的功能则很弱。抗原进入表皮后诱导表皮细胞分泌多种细胞因子,其中白介素-1β(IL-1β)与肿瘤坏死因子α(TNF-α)刺激LC迁移至真皮。在真皮内,淋巴管内皮细胞分泌趋化性因子CCL21,通过LC表面的趋化性因子受体CCR7而吸引LC进入淋巴管,接着流人淋巴结。继而,淋巴结细胞分泌的趋化性因子CCL21和CCL19通过LC表面的CCR7引导LC进入T细胞区。在这里,LC将抗原提呈给抗原特异性T细胞。
在迁移过程中,LC变成为成熟的树突状细胞。特征为摄取与处理抗原的能力减弱,而细胞表面的MHC分子与协同刺激分子如B7-1、B7 -2及CD40等表达增加。结果,LC的抗原提呈功能明显增强(下图)。
功能特征
LC是1868年柏林医学院学生Paul Langerhans在用氯化金染色研究皮肤神经时发现的,最初认为其属于神经系统。在随后的一个世纪中,对这种细胞的性质一直未能明了,曾推测其可能属于衰变的黑素细胞。直至二十多年前,才开始逐步阐明LC具有抗原提呈功能,是一群独特的树突状的白细胞。
体外研究
1978年.Stingl等通过实验显示LC具有抗原提呈功能。经可溶性蛋白抗原或半抗原处理的表皮细胞悬液(含LC)可刺激已致敏的同基因T细胞发生体外增殖反应。未经抗原或半抗原处理的表皮细胞悬液(含LC)与异体淋巴细胞进行混合培养,亦可刺激淋巴细胞发生增殖(表皮细胞一淋巴细胞混合反应,MELR)。然而,当从表皮细胞悬液中去除LC后,则不发生上述的淋巴细胞增殖反应。这些实验证明LC是强力的抗原提呈细胞。
近来,研究表明在表皮细胞体外培养过程中,LC的表型与功能都发生明显的变化。新分离的LC在表型与功能上类似于巨噬细胞,能有效地摄取与处理抗原,但免疫刺激能力(抗原提呈)很弱。然而,培养的LC(即细胞因子激活的LC)则在表型及功能上类似于淋巴样树突状细胞,具有强的免疫刺激能力。
体内研究
LC的主要生物学功能是在机体针对各种类型抗原(包括接触性变应原、同种异体抗原、肿瘤抗原以及微生物抗原)而发生的皮肤免疫反应中提供致敏信号。
- 接触性超敏反应(contact hypersensitivity,CHS)小鼠对接触致敏物如二硝基氟苯(DNFB)、三硝基氯苯(TNCB)等所发生的超敏反应取决于表皮LC密度。当将接触致敏物涂布于小鼠的含有正常密度表皮LC的部位(如躯干、四肢等),可诱发接触性超敏反应。然而,若将接触致敏物涂于天然缺乏LC的部位(鼠尾)或人为去除LC的局部皮肤(紫外线照射或皮质类固醇外用),则不能引起致敏。这些实验表明LC在接触性超敏反应的诱导期中起着至关重要的作用。当皮肤接触抗原时,表皮LC,摄取并处理抗原,离开表皮通过真皮淋巴管进入局部引流淋巴结,将处理过的抗原提呈给CD4+T细胞,引起抗原特异性的T细胞激活。
- 同种异体皮肤移植:LC具有很强的同种异体免疫原性。天然缺乏LC的角膜进行同种异体移植时不会引起致敏而导致移植物排斥反应。若用毒性刺激诱导LC由角膜缘与结膜移行至角膜中央上皮,角膜移植则会诱导剧烈的排斥反应。用胶带黏剥法去除鼠类皮肤的表皮LC,可以延长皮肤移植物的存活时间。在皮肤移植后几小时内,表皮LC的MHCⅡ类抗原增加,LC离开表皮进入真皮淋巴管,形成条索,接着LC进一步移行至局部引流淋巴结。这些迁移的LC在表型与功能上都对应于体外培养中细胞因子激活的LC。
- 肿瘤免疫表皮LC能够摄取并处理表皮细胞新表达的肿瘤抗原,迁移至引流淋巴结,将肿瘤抗原提呈至T细胞,诱发T细胞介导的抗肿瘤免疫。
最新进展
虽然LC在启动皮肤T细胞免疫反应中的关键作用已被普遍接受,但是最近一些研究结果对这一观念提出了挑战。Bennett等通过白喉毒素受体/白喉毒素(DTIVDT)系统诱导,完全消除小鼠表皮LC,但不影响真皮树突状细胞。这些缺乏LC的小鼠的CHS虽然减弱,但并不完全丧失,提示必要时真皮树突状细胞可以介导CHS。Kissenpfennig等也显示在皮肤致敏后,真皮树突状细胞超先表皮LC迁移至淋巴结。更有甚者,Kaplan等报道缺乏表皮LC的突变鼠非但CHS不丧失,反而明显增强,提示LC不仅不是启动CHS所必须的,而且可能对CHS起阴性调节作用。
理化因子对LC的作用
- 中波紫外线(UVB):UVB具有许多有害的生物学作用,最严重的是诱发皮肤癌。最初认为UVB诱发皮肤癌只是由于其对宿主细胞基因组的直接转化作用,后来才知道UVB可诱发宿主免疫缺陷状态。例如,经UVB照射的小鼠不能产生对肿瘤的保护性免疫反应。小剂量至中等剂量的UVB可明显影响LC的表型,如导致ATP酶活性明显降低。电子显微镜超微结构研究显示LC本身未必减少。UVB照射鼠表皮细胞可导致LC抗原提呈功能的抑制。
- 长波紫外线(UVA:UVA照射可导致表皮LC减少。在功能方面.UVA照射可明显消除LC的免疫刺激能力。PUVA疗法可引起表皮LC暂时性减少与功能损害。
- 糖皮质激素:局部性及系统性应用糖皮质激素可导致表皮LC数目减少及功能损害。糖皮质激素的预处理能干扰诱导接触性超敏反应,可能与此有关。
- 其他:X线、致癌原如DMBA、环孢素A、维A酸等亦可影响表皮LC的数目与功能。
