根据T细胞受体(TCR)组成上的不同,T细胞可分为αβ T细胞与γδ T细胞二大类。通常所讲的T细胞多指αβ T细胞,如CD4+Th细胞及CD8+Tc细胞等。γδ T细胞仅占总淋巴细胞的很小比例,主要分布于黏膜的上皮组织如肠道、肺及生殖道,称为上皮内淋巴细胞(intraepithelial lymphocytes,IEL)。
在鼠类,γδ T细胞亦分布于表皮内。它们呈树突状外观,单从外形上无法与LC相区别。这群细胞约占总表皮细胞的1%~3%,它们表达Thy-1抗原但缺乏MHC Ⅱ类抗原,因而起初被称为Thy-1+突状表皮细胞(Thy-1+ dendritic epidermal cell,Thy-1+DEC)。在人类表皮内不存在类似的细胞。
进一步的研究发现Thy-1+DEC携带CD3相关联的TCR,因此这些细胞被重新命名为树突状表皮T细胞(dendritic epidermal T cell,DETC)。DETC所携带的TCR是TCRγδ,所以有时亦将DETC称为表皮内γδ T细胞。
表型特征
DETC表面表达Thy-1、CD3、CD45等抗原以及T细胞抗原受体γδ(TCRγδ)。与大多数T细胞(即TCRαβ携带细胞,简称αβ T细胞)不同,DETC不表达CD4或CD8抗原。DETC亦不同于LC.其不表达MHC Ⅱ类抗原(la抗原)。
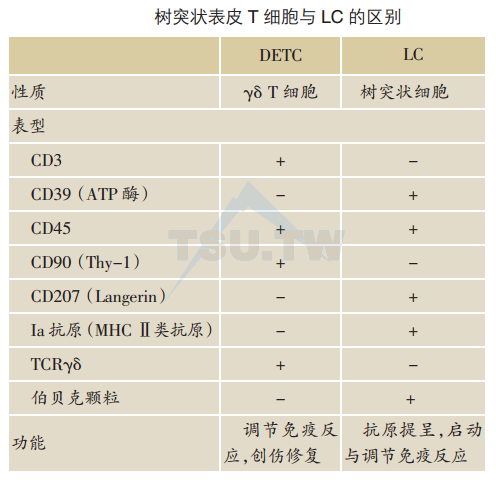
电子显微镜下,DETC的超微结构完全不同于其他类型表皮细胞。DETC不含角蛋白微丝、桥粒(角质形成细胞标志)、伯贝克颗粒(LC标志)、黑素小体(黑素细胞标志)或梅克尔细胞颗粒(梅克尔细胞标志)。树突状表皮T细胞与LC的主要区别简述于下表。
起源
DETC表达白细胞共同抗原CD45,提示其可能起源于骨髓。进一步的骨髓嵌合实验研究证明骨髓是DETC的发源地。然而,最近亦有人提出DETC可能起源于胚胎肝脏的干细胞,然后在胚胎胸腺中发育成熟。DETC的表型与早期胚胎胸腺细胞(14~15天)的表型完全一致。胚胎胸腺中TCRVγ3+细胞的消失刚好发生在表皮内出现TCRVγ3+细胞之前。这些现象提示在胚胎期,TCRVγ3+胸腺细胞离开胸腺,迁移至表皮而成为DETC。胸腺在DETC发育中所起的关键作用进一步由对裸鼠进行的研究中获得证实。无胸腺裸鼠的表皮内缺乏Vγ3+ DETC。然而,若将正常小鼠14天胚胎胸腺小叶移植于无胸腺裸鼠,则可导致其表皮内出现Vγ3+DETC。
发育
白介素-7(IL-7)与IL-15在γδ T细胞的发育中起重要作用。它们的受体IL-7R与IL-15R传递γδ T细胞的增殖或(和)生存信号。基因敲除IL-7或IL-15导致小鼠皮肤缺乏DETC。基因敲除IL-7R的α链或公共γ链也导致DETC缺失。
虽然CD45对αβ T细胞的发育至关重要,但是基因敲除CD45并不影响γδ T细胞包括DETC的发育。
功能
自1983年发现DETC以来,这群位于小鼠表皮内的γδ T细胞的功能一直是皮肤免疫学中备受关注的课题。许多研究表明DETC可以识别应激的、受感染的或转型的角质形成细胞所表达的抗原,能够调节皮肤炎症反应、对抗紫外线诱导的皮肤肿瘤及参与创伤修复,对于维持皮肤自身稳定有十分重要的作用(下表)。
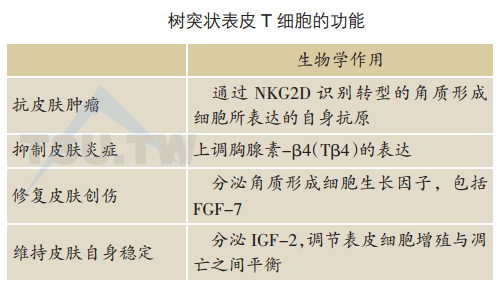
1996年,Havran的实验室显示DETC细胞系能被诱导分泌多种趋化性因子,包括CCL3、CCL4、CCL5及XCL1等,提示DETC可能通过分泌特异性趋化性因子而吸引炎细胞迁移至受损伤的表皮。
该实验室后来又发现DETC能产生生长因子,包括FGF-7(成纤维细胞生长因子-7)和IGF-1(胰岛素样生长因子-1)。FGF-7是一种重要的角质形成细胞生长因子,提示DETC可能对创伤修复起作用。缺乏γδ T细胞的小鼠显示创口愈合延缓。IGF-1维持表皮细胞的增殖与凋亡之间的平衡。缺乏DETC的小鼠呈现明显增加的表皮细胞凋亡及创口部位IGF-1受体活化减弱,提示DETC分泌的IGF-1在维持皮肤自身稳定与修复中的关键作用。
2002年,Tigellar的实验室发现缺乏DETC的小鼠(基因敲除TCRδ)发生自发性慢性皮炎,而且接触性皮炎反应增强,表明DETC对皮肤炎症有负性调节作用。
最近有研究证明DETC表达NKG2D。NKG2D是一种激发性受体,能识别应激的、受感染的或转染的细胞所表达的自身抗原。阻断NKG2D可以抑制DETC介导的针对靶细胞的细胞毒作用。NKG2D在DETC表面交联可诱导丙种干扰素(IFN-γ)的产生。这些结果表明NKG2D对DETC的细胞毒作用及对细胞因子分泌起重要作用。
