接触性超敏反应(CHS)
CHS是针对半抗原发生的T细胞介导的皮肤免疫反应。临床上,CHS表现为变态反应性接触性皮炎。长久以来,CHS被视为迟发型超敏反应(DTH)的原型,然而,最近研究表明CHS无论在发病机制上还是在临床表现上都与DTH有所不同。
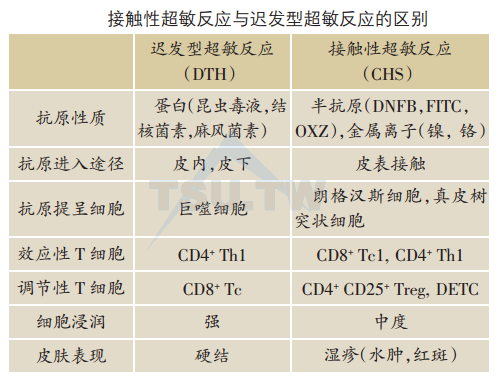
一般认为CHS是LC依赖性的Th1细胞因子介导的免疫反应,但是介导CHS的分子机制十分复杂。随着分子生物学的飞速发展,基因敲除(gene knockout,KO)鼠已广泛应用于CHS的研究中。这些研究革新了一些有关CHS的传统观念。研究证明LC并不是CHS反应所绝对必须的,真皮树突状细胞也可在皮肤抗原提呈中发挥重要作用。CD4+Th细胞并不是CHS反应惟一的效应细胞.CD8+Tc细胞也可发挥重要的效应作用。不但Th1细胞因子,有时Th2细胞因子也可介导CHS反应。
基因敲除鼠(KO鼠)
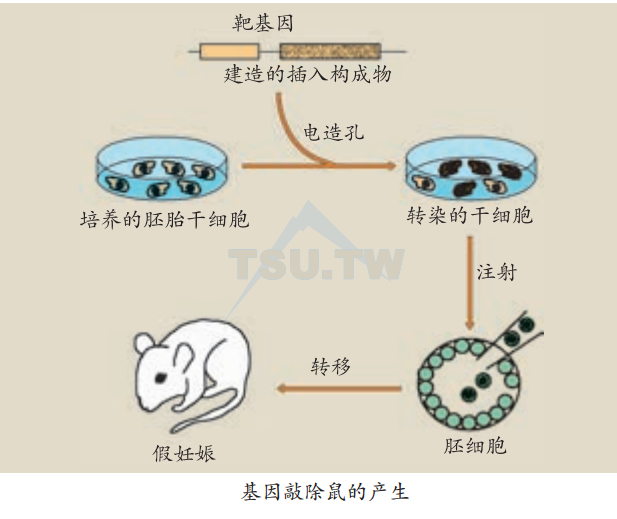
遗传密码突变对于了解基因的功能极有帮助。通过基因突变而阻断或改变基因的最终产物,可以直接阐明基因的性质与功能。在小鼠繁殖过程中可能会随机发生基因突变,称为自发性突变。许多自发性突变小鼠已被应用于生物学研究中。但是,在多数情况下,对其特异的遗传缺陷并不十分清楚。
近年来,生物学技术上有了两项重大突破:①由小鼠胚胎培养多能干细胞;②通过同源DNA重组引导细胞发生基因突变(诱发性突变)。这些技术可以使小鼠的某种基因发生失效突变(null mutation)而产生KO鼠。这种突变鼠缺乏某种基因以及相应的最终基因产物。自1989年第一例KO鼠产生以来,至今已有上千种KO鼠面世。在这一研究领域,华裔加拿大科学家麦德华(Tak W Mak)是世界最著名的学者之一。笔者有幸与他进行了多年合作,将多种KO鼠应用于CHS研究。
基因敲除致使CHS消失
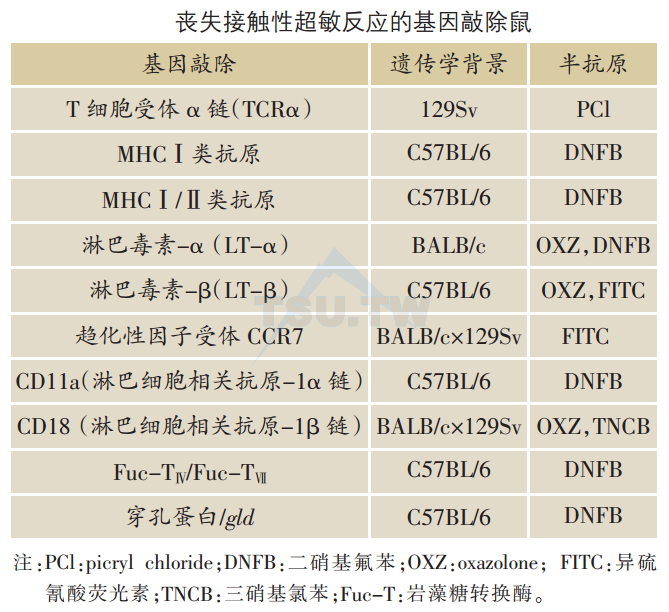
CHS是研究体内LC抗原提呈的最佳模型。当皮肤接触变应原时,LC摄取抗原并迁移至淋巴结,将抗原性多肽提呈至T细胞。T细胞激活需要两个信号。TCR的αβ二聚体与MHC-多肽复合体相互作用释放第一信号。TCRα链KO鼠与MHC Ⅰ类抗原KO鼠不能引发CHS。
淋巴结是LC提呈抗原的场所。淋巴毒素(LT)-αKO鼠完全缺乏淋巴结,不能发生CHS。LT-βKO鼠仅25%完全缺乏淋巴结,不发生CHS。而75%则保存黏膜相关的淋巴结,则可发生CHS。
趋化性因子CCL21(SLC)及其受体CCR7对LC从皮肤迁移至淋巴结起指导作用。居住于表皮的LC不表达CCR7,但在迁移时开始表达。淋巴管内皮细胞分泌CCL21,吸引LC进入淋巴管。CCR7对LC最后定位于淋巴结T细胞区也十分重要,因为T细胞区的高内皮小静脉(high endothelial venules,HEV)和基质细胞表达CCL21。CCR7 KO鼠完全丧失CHS。
粘连分子控制细胞一细胞间的附着以及细胞穿透内皮迁移。淋巴细胞功能相关抗原-1(LFA-1)属β2整合素,对CHS反应至关重要。CD11a KO鼠缺乏LFA-1α链,而CD18 KO鼠缺乏LFA-1β链,它们均不发生CHS。选择素也与CHS有关。岩藻糖转换酶(α-1、3-fucosyItransferase,Fuc-Ts)调节选择素受体的表达。Fuc-TⅣ/Fuc-TⅤⅡ双重KO鼠丧失CHS。
细胞毒性T细胞(CTL)通过两条通路杀伤靶细胞:穿孔蛋白( perforin)通路和Fas/FasL通路。穿孔蛋白KO鼠呈现正常的CHS。缺乏FasL的自发性突变鼠(gld鼠)的CHS也正常。然而,穿孔蛋白Ko/gld鼠(双重缺乏穿孔蛋白和FasL)丧失CHS,提示CHS需要同时激活这两条通路。
基因敲除致使CHS减弱
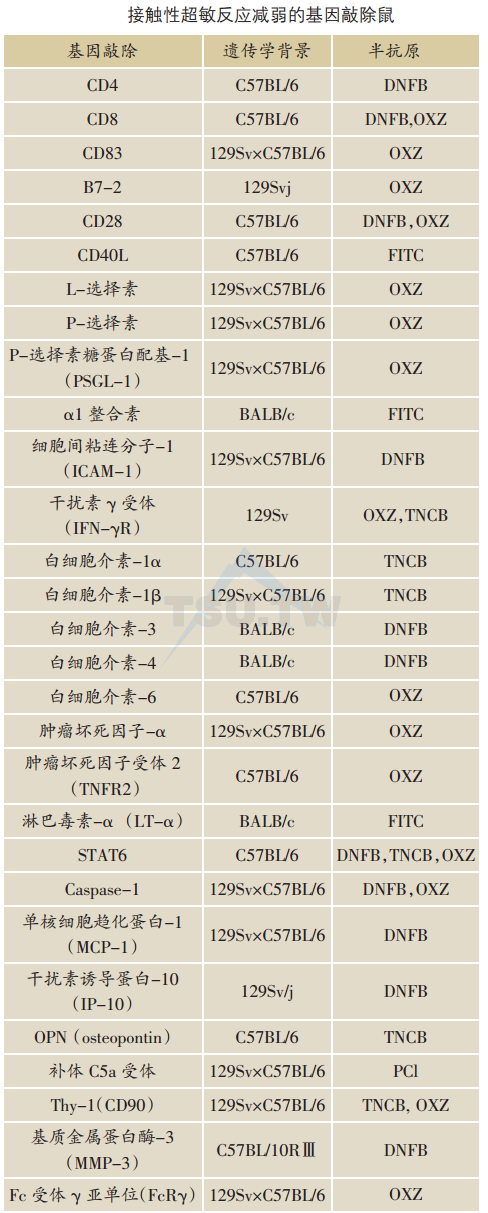
CD4+T细胞与CD8+T细胞分别识别MHC Ⅱ类和Ⅰ类分子结合的多肽。传统上认为CD4+T是CHS的效应细胞,而CD8+T细胞起负性调节作用。CD4 KO鼠及CD83 KO鼠的研究支持这一观念。CD4 KO鼠完全缺乏CD4+T细胞,而CD83 KO鼠的CD4+T细胞仅为正常的10%-25%,它们的CHS均减弱。然而另一些研究则提示CD8+T细胞在CHS起效应作用。MHCⅠ类基因敲除导致CHS丧失,而MHC Ⅱ类基因敲除反而使CHS增强。另外,CD8 KO鼠亦显示CHS减弱。这些看似矛盾的结果可能提示CD4+Th1与CD8+Tc1细胞均可介导CHS。
协同刺激分子与其受体作用而释放第二信号,对CHS也很重要。B7-2 KO、CD28 KO以及CD40L KO鼠都呈现CHS减弱。
粘连分子介导白细胞附着于内皮细胞。L-选择素KO、P-选择素KO以及PSGL-1(P-选择素糖蛋白配体-1)KO鼠显示CHS减弱。
一般认为Th1细胞因子在CHS起效应作用,而Th2细胞因子起负性调节作用。已发现IFN-γ受体KO鼠的CHS减弱,而IL-10 KO鼠CHS增强。然而,另一些研究提示Th2细胞因子也可起效应作用。IL-4 KO鼠的CHS非但不增强,反而减弱。STAT6对IL-4及IL-13的信号通路起关键作用,STAT6 KO鼠也呈现CHS减弱。
IL-1、IL-6、IL-18和TNF-α是前炎症性(proinflammatory)细胞因子。IL-1αKO、IL-1βKO、IL-6 KO、TNF-αKO以及TNF受体-2 KO小鼠都显示CHS减弱。caspase-1 KO鼠的CHS也减弱,可能由于缺乏成熟的IL-1β及IL-18。
基因敲除某些趋化性因子如单核细胞趋化蛋白-1( MCP-1/CCL2)、干扰素诱导蛋白-10(IP-10/CXC10)或osteopontin(OPN)可使CHS受损。
另外,KO研究显示其他一些分子如补体C5a、Thy-1、基质金属蛋白酶(MMP)、Fc受体γ亚单位(FcRγ)以及CD39等也参与CHS反应。
基因敲除致使CHS增强
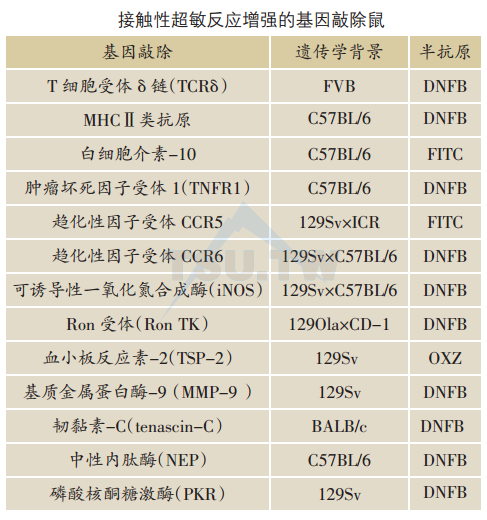
敲除某些基因可以使CHS增强,表明这些基因的最终产物对CHS反应可能起负性调节作用。与αβ T细胞的效应细胞功能不同,γδ T细胞是CHS的调节细胞。TCRδKO鼠缺乏γδ T细胞,其CHS反应明显增强。
IL-10是重要的调节性细胞因子。基因敲除IL-10致使小鼠CHS反应增强。趋化性细胞因子受体CCR5及CCR6表达于未成熟的树突状细胞以及T细胞,CCR5 KO鼠和CCR6 KO鼠呈现增强的CHS反应,提示CCR5和CCR6可能通过目前尚未明了的机制而调节T细胞免疫反应。
Ron受体属于酪氨酸激酶(TK)受体家族,参与免疫反应的许多方面,包括抗原提呈、巨噬细胞激活及一氧化氮(NO)调节。RonTK KO鼠的CHS增强,提示Ron介导的胞质内信号发送为局限、抑制炎症反应所需要。
血管生成和微血管通透性增强是各种炎症性疾病的特点。血小板反应素-2(TSP-2)是一种内源性血管生成抑制物,其在患有炎症的皮肤表达增强。TSP-2敲除鼠的CHS反应明显增强,可能与TSP-2限制水肿形成以及抑制炎细胞浸润有关。
韧黏素-C (tanascin-C)是一种细胞外间质(ECM)糖蛋白。基因敲除韧黏素-C的小鼠呈现增强的CHS反应,提示韧黏素-C对皮肤炎症的负性调节作用。感觉神经源性神经肽如:P物质也见于细胞外间质,具有多种促炎症性(proinflammatory)生物活性。中性内肽酶(NEP)属细胞表面金属蛋白酶,能降解P物质。NEP KO鼠的CHS反应明显增强,显示皮肤神经肽在CHS反应中起一定作用。
磷酸核酮糖激酶(PRK)参与干扰素调节的抗病毒、抗增殖反应。PRK KO鼠的CHS反应增强,表明这种激酶对免疫反应有抑制作用。
角质形成细胞和朗格汉斯细胞都能合成一氧化氮(NO)。这一过程由一氧化氮合成酶介导,包括可诱导性一氧化氮合成酶(iNOS)。很清楚,NO涉及皮肤免疫反应。然而,出乎预料的是iNOS KO鼠的CHS非但不减弱反而增强,其原因尚不明了。
基因敲除未改变CHS
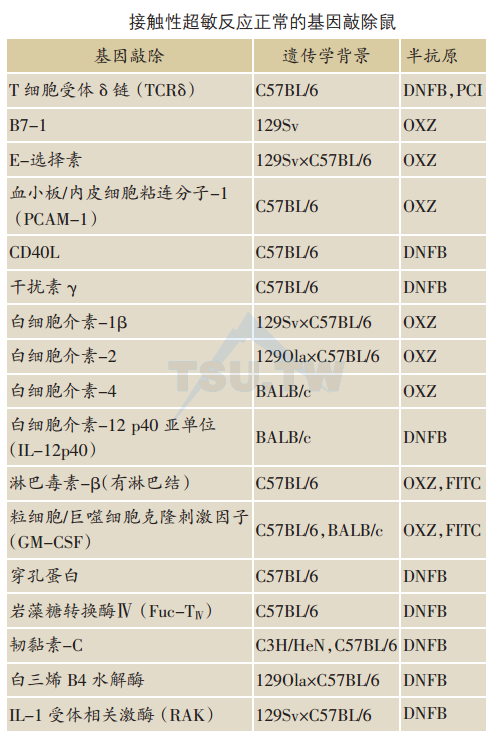
虽然许多基因敲除鼠的研究与预期的相符合,但是有些研究却产生出未能预料的结果。某些分子被公认为对CHS反应是关键性的,然而基因敲除并未明显影响小鼠的CHS反应。
IFN-γ、IL-2和IL-12是重要的Th1细胞因子,在皮肤免疫炎症反应中起重要的效应作用。然而,IFN-γKO、IL-2 KO和IL-12P40 KO鼠却显示CHS正常。大概当某种细胞因子缺乏时,另一种或几种具有类似功能的细胞因子可替代其在CHS的作用。
当基因敲除某些重要的皮肤炎症介质时,也未明显影响小鼠的CHS反应。白三烯B4(LTB4)是一种强炎症介质,在急性皮肤炎症反应中起重要作用。然而,出乎预料地LTB4水解酶KO鼠(缺乏LTB4)却呈现正常的CHS。IL-1受体相关激酶(IRAK)参与IL-1和IL-18的信号传导,而IL-1和IL-18对CHS反应十分重要。意外地,IRAK KO鼠的CHS反应正常,提示可能另外存在IRAK非依赖通路。
基因敲除某些协同刺激因子和粘连分子也不明显影响小鼠的CHS。B7-1 KO、E-选择素KO、血小板、内皮细胞粘连分子-1(PECAM-1)KO鼠具有正常的CHS反应。
虽然前面提及的TCRδ KO鼠(FVB背景)呈现增强的CHS,但C57 BL/6背景的TCRδKO鼠的CHS正常,表明小鼠的遗传学背景影响小鼠的CHS。类似地,韧黏素-C KO鼠(BALB/c背景)呈现增强的CHS,但是C3H/NeH或C57BL/6背景KO鼠的CHS却正常。
IL-1β KO鼠对半抗原OXZ的CHS反应正常,但对TNCB的反应减弱,提示半抗原的类型也影响CHS。十分类似地,IL-4 KO鼠对OXZ的CHS正常,但对DNFB的反应减弱.CD40L KO鼠对DNFB呈正常的CHS反应,而对FITC的反应减弱。
结语
基因敲除鼠的应用给CHS研究带来一场革命。KO研究产生出许多无法预料的结果,对以往的一些传统观念提出了挑战。KO技术对CHS研究的强大冲击不仅由于它们帮助回答了一些重要问题,而且也因为它们提出了很多新问题。例如,INF-γ KO鼠的CHS正常,使人们对作为主要效应性细胞因子INF-γ在CHS的关键作用提出了质疑。再如,IL-3 KO鼠的CHS明显受损,然而作为造血细胞生长因子的IL-3又是如何影响CHS反应的?通过进一步研究来回答这些新问题,将有助于进一步阐明介导CHS的复杂分子生物学机制。
