丝聚合蛋白的意思为微丝凝聚蛋白(filament aggregating protein)。丝聚合蛋白的功能主要是与角蛋白中间丝相互作用,协助角蛋白聚集形成致密的角蛋白纤维束。丝聚合蛋白最初以功能上无活性的丝聚合蛋白原( profilaggrin,pFG)前体形式聚集在颗粒细胞的角质透明颗粒(keratohylin granules,KHG)中,在角质形成细胞由颗粒层向角质层分化过程中,在一些特异性磷酸酶及蛋白酶的作用下,经过去磷酸化以及蛋白水解处理过程,从丝聚合蛋白原转化为有活性的丝聚合蛋白。
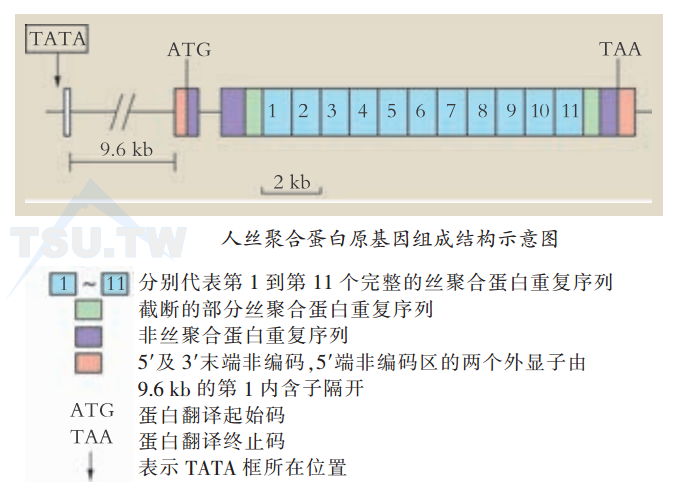
丝聚合蛋白原基因及蛋白结构特征
丝聚合蛋白原是一组富含组氨酸的多聚蛋白,人的丝聚合蛋白原由10-12个重复的丝聚合蛋白单位组成,每个丝聚合蛋白单位由一个丝聚合蛋白序列加上19个氨基酸“连接”序列组成。丝聚合蛋白原这种少见的重复结构来源于它本身的基因结构。丝聚合蛋白原基因编码区中间部分为10-12个重复的972碱基对长的丝聚合蛋白单位序列,两端为部分丝聚合蛋白序列及不同于丝聚合蛋白序列的头、尾序列。丝聚合蛋白原基因编码区丝聚合蛋白单位重复序列中不含有内含子,各重复的丝聚合蛋白单位序列相似,但限制性内切酶消化带型提示这些重复单位间亦有相异性。
丝聚合蛋白原的表达与降解
形态学上丝聚合蛋白原的出现与角质透明颗粒的形成一致,合成的丝聚合蛋白原需经一系列的处理过程,紧接着丝聚合蛋白原的翻译合成,新生的丝聚合蛋白原每一丝聚合蛋白及连接肽多处丝氨酸被磷酸化。多个蛋白激酶在此中间起作用,包括酪蛋白激酶(CK Ⅱ)。磷酸化的丝聚合蛋白原不溶于水,聚集于高磷酸化并富含组氨酸、且形态不规则的角质透明颗粒中,而不在富含半胱氨酸的“致密颗粒”型角质透明颗粒中。在正常人表皮,角质透明颗粒最初出现在颗粒层下部细胞中,呈小而不规则状。在颗粒层上部,这些颗粒已成为大的星状团块。在角质层底部3-4层,免疫标记显示丝聚合蛋白均匀致密地分布于所有的细胞中。到角质层中部,免疫标记减弱。随着丝聚合蛋白降解为单个氨基酸,免疫标记最终消失在近表面处。角质透明颗粒的溶解与丝聚合蛋白原的去磷酸化及蛋白水解过程有关。蛋白水解分为两阶段,首先由胰凝乳蛋白酶使其产生由几个重复丝聚合蛋白序列组成的中间产物,然后再进一步降解成单个氨基酸;第二阶段需要有一定的细胞外钙离子浓度,可被钙离子通道阻滞剂所抑制,提示钙离子的流人可能激活这一过程。
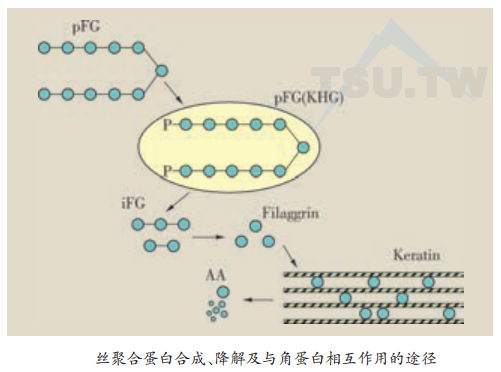
- pFG(丝聚合蛋白原):新生的丝聚合蛋白原;
- pFG(KHG):新生的丝聚合蛋白原被磷酸化并储存在角质透明颗粒(KHC)中;
- iFG:经去磷酸化及蛋白水解作用从角质透明颗粒中释放出来并成为中间产物;
- Filaggrin(丝聚合蛋白):iFG经进一步水解成为单个丝聚合蛋白;
- Keratin(角蛋白):丝聚合蛋白与角蛋白中间丝相互作用,协助角蛋白聚集成柬 AA:丝聚合蛋白经修饰后从角蛋白束中解脱出来,并由蛋白酶水解降解成自由氨基酸
丝聚合蛋白原的处理过程与其功能有关。磷酸化的丝聚合蛋白原无活性,滞留于角质透明颗粒中。去磷酸化及蛋白水解将丝聚合蛋白原转化为功能性丝聚合蛋白,协助角蛋白丝聚集成束。丝聚合蛋白与角蛋白丝的结合限于角质层下部,可能作为暂时陛支架,为角蛋白丝定向直到它们被双硫键(SS)交叉连接在一起。在角质层上部,丝聚合蛋白的精氨酸基团在精氨酸脱氨酶作用下转为瓜氨酸。这种转化可能促使丝聚合蛋白从角蛋白纤维中解离出来,并进一步降解成自由氨基酸。这些自由氨基酸为亲水性,通过结合水而有维持皮肤水分的作用。
丝聚合蛋白原基因的调控
丝聚合蛋白原的表达仅发生在有分化特异性角蛋白K1及K10表达后,并且在角化过程增强的情况下其表达也增加。细胞内Ca2+及维A酸参与了表达的调节。丝聚合蛋白原基因结构特征可能是其调控机制的基础。
- 5’末端非编码区(5'noncoding region)人丝聚合蛋白原基因的5’末端非编码区由两个外显子组成,共有75碱基对(bp),中间被一段9.6 kb的内含子隔开。在mRNA转录起始位点前27 bp处有一个TATA框。这个TATA框上游距转录起始位点210bp内有几个调节成分,包括一个AP1位点,几个GC框及CAAT框。此外,位于两个外显子之间的内含子中间也有一个AP1位点,并有维A酸应答序列成分(RARE)。这些位点或成分可能是组织特异性或分化特异性丝聚合蛋白原基因表达的基础。Phorberester TPA通过增强c-Fos和c-Jun结合能力可以激活含有AP1位点的基因,在一定条件下可以诱导丝聚合蛋白原的表达。与之相反,维A酸则抑制丝聚合蛋白原的表达,其作用机制可能是直接作用于RARE样成分或间接通过拮抗AP1激活转录的机制。
- N末端“EF”手功能区丝聚合蛋白原翻译起始码后是一段由两个功能区组成的前导肽。其特征为有两个钙离子结合区,称为“EF手”。一个“EF手”通常为12个氨基酸组成的钙结合环,两头各-α螺旋。根据“EF手”的数量及内含子在基因上的位置,丝聚合蛋白原被认为属于S100钙结合蛋白家族。和其他S100类基因一样,丝聚合蛋白原有两个“EF手”及两个内含子。这两个内含子一个位于5’端的非编码区,另一个位于两个“EF手”之间,与其他S100类基因中内含子的位置一致。这种钙结合区的存在提示钙调节的结构基础及功能意义。人培养角质形成细胞在低钙浓度培养液中不分层仅保持单层,也不表达分化标志。但在高浓度钙情况下,角质形成细胞分层化,并表达分化标志如K1及K10,同时也表达丝聚合蛋白原。丝聚合蛋白原的降解也需要钙参与。
