内披蛋白的命名来自拉丁语involucrun,意思为包膜(envelope)。内披蛋白占培养角质形成细胞可溶性蛋白的5%~10%,等电点为4.5。内披蛋白很易被加热增浓。当加热人角蛋白粗提液到95℃时,多数蛋白质沉淀,而内披蛋白仍然保持在溶液中,可达可溶性蛋白含量的90%。内披蛋白的分子量为680 kDa。其氨基酸组成接近于培养的人角质形成细胞的角质包膜蛋白,富含谷氨酸俗氨酰胺以及较高含量的赖氨酸及脯氨酸。内披蛋白在角质形成细胞分化过程中出现较早,最初见于棘层上半部,位于细胞质内。在角质层则聚集于细胞的周缘。
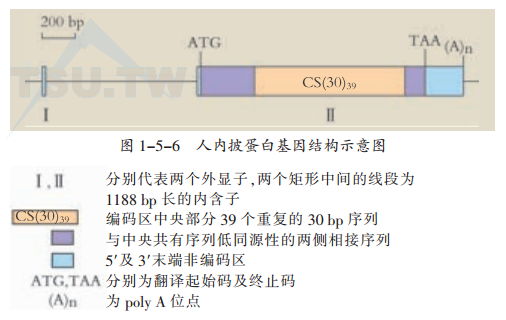
- 人内披蛋白基因结构:人的内披蛋白基因有两个外显子及一个内含子(上图)。5’端的外显子很小,仅43 bp。而3’端的外显子为2107 bp。两个外显子间由一1188 bp长的内含子隔开。编码区位于3’端外显子内。编码区的中央部分为39个头尾相接、串联重复序列,两边为与中央共有序列同源性较低的序列,整个氨基酸序列为585个氨基酸。中央的重复共有序列由30 bp组成,由其产生的10个氨基酸共有序列为EQQEGQLKHL,其中3个谷氨酰胺(Q)及2个谷氨酸(E)的位置恒定。实验显示,由转谷氨酰胺酶催化的交叉连接90%首先发生在第35个重复序列中第2个谷氨酰胺上(第496位点),10%首先发生在邻近的第1个谷氨酰胺上(第495位点)。由于内披蛋白的长度以及其富含用于转谷氨酰胺酶介导的交叉连接用的谷氨酰胺,故内披蛋白被认为很可能作为不同蛋白之间交叉连接的支架。
- 内披蛋白基因的调控:实验表明,人内披蛋白基因调控成分位于5’端非编码区约2.5 kb序列中。除邻近转录起始位点(+1)的TATA框外,还有好几个调节因子结合位点及三个功能性转录调控区:近端启动子僧强子(enhancer)(nt-159~-1),远端Ca2+依赖性增强子(nt-2456~-1272)以及一可能的转录抑制区(nt-650~-160)。远、近端转录启动子/增强子中有好几个AP1位点,而转录抑制区内则同时有一AP1位点及2个可能的YY1位点。
AP1位点的存在可能是TPA诱导角质包膜形成的结构基础。其机制可能是通过蛋白激酶C(PKC)作用于转录因子AP1,激活或增强内披蛋白的转录。并且AP1对内披蛋白转录的调节作用有细胞类型特异性,即仅在正常表达内披蛋白的细胞中起作用。
YY1位点存在于很多基因中。内披蛋白基因转录抑制区的2个可能的YY1位点序列为5'TTTCCATTTCA3’和5'TCATTTTGAA3’。YY1是一种特殊的转录调节因子,其对基因转录起始的作用可以是激活亦可以是抑制,依基因的不同而异。尽管YY1在角质形成细胞中的作用还不清楚,但YY1对内披蛋白的转录有很强的抑制作用。
实验表明,远端增强子序列的激活性依赖于Ca2+诱导的角质形成细胞分化。而近端的启动子储强子以及含AP1序列的可能的抑制区则不受Ca2+诱导的细胞分化影响。这种现象可能提示在角质形成细胞中存在着两种不同的内披蛋白基因转录的调控机制:一是Ca2+依赖性,另一种则仅在于AP1的激活。转基因鼠实验表明,内披蛋白2.5 kb 5’端非编码区还含有指导内披蛋白复层鳞状上皮组织特异性及分化特异性表达的调控信息。
POU转录因子在表皮有表达,被认为是角质形成细胞基因表达的—个重要调节因子。一项转录实验表明,POU因子抑制内披蛋白的转录,机制可能是通过间接作用于TATA框附近的其他蛋白因子。此外,POU因子还拮抗TPA对内披蛋白启动子活性的诱导作用。这表明内披蛋白属于一组很少的几个基因——POU因子对它们的调控不依赖POU八碱基基元结合位点。
