形成角质包膜是正常人表皮角质形成细胞终末分化的最后阶段。角质包膜的不溶性可能来自表皮内转谷氨酰胺酶(transglutaminase,TG)的作用,即在组成角质包膜的蛋白之间形成一种ε(γ谷氨酰)赖氨酸交叉连接。这种交叉连接十分稳定,可以抵抗蛋白酶的水解作用。近年来还发现,在人的表皮内还存在一种1谷氨酰多胺交叉连接。用于这种连接的多胺一般为亚精胺。根据这两种交叉连接,据估计,正常人表皮角质包膜中平均每20 kDa分子量肽链就有—个交叉连接。
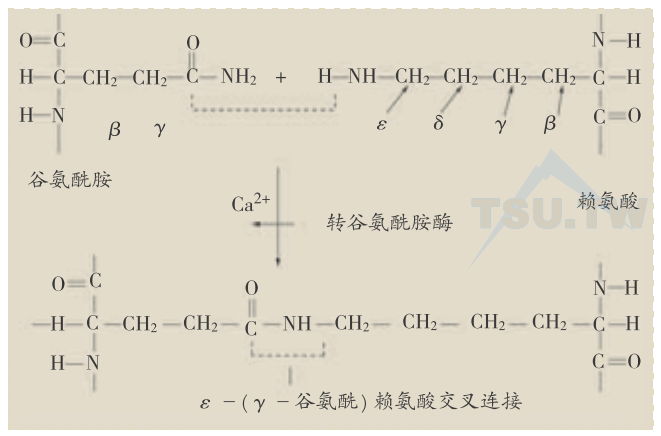
TGs是一组Ca2+结合及Ca2+赖性酶。目前已发现有八种TGs在人类表达,其中有四种TG存在于表皮及其附属器以及其他鳞状复层上皮组织:TG1(或角质形成细胞TG,TGK)、TG2(或组织TG,TGC)、TG3(或表皮TG,TGE)和TG5(或TGX)。分子克隆显示这些TGs是一些相关的、但各不相同的蛋白,在活性中心有很高的同源性。TG1、TG3和TG5在表皮表达,介导角质包膜组成蛋白之间的交叉连接而参与角质包膜的形成。TG2在表皮真皮均有表达,介导胶原纤维及其他细胞外基质的形成。
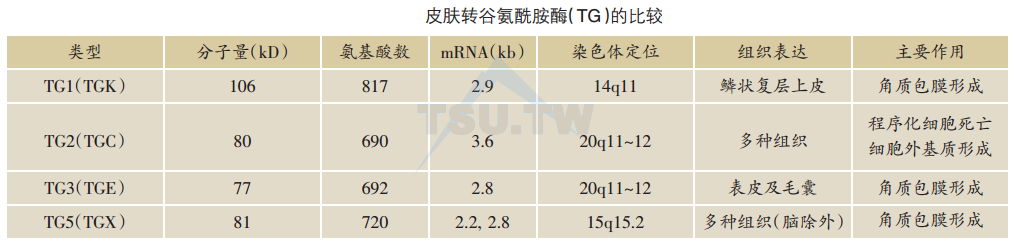
人的TG1表达在多种复层上皮。在正常人表皮,TG1的表达起始于棘层中部直至角质层的起始,但酶活性仅限于颗粒层与角质层交界处1-2层细胞。这种酶活性的局限性可能是由于细胞间Ca2+浓度的关系。TG1原酶活性很低,经蛋白水解分成由非共价键连接10、33、67kD复合体,活性大大增强。TG1的表达还受维A酸的调节。TG2存在于很多不同的组织,它表达在表皮角质形成细胞,同时还见于真皮。据认为它的主要功能是参与细胞凋亡(apoptosis)。TG2交叉连接细胞外基质,增强其稳固性,对损伤愈合中胶原纤维及其他细胞外基质的合成很重要。TG3又称为表皮或毛囊TG,是一种蛋白原酶,分子量为77kD。通过蛋白水解分离成有高度活性的5kD及27kD片断。人的TG3表达在表皮及毛囊分化的角质形成细胞中,其表达也受Ca2+水平的调控。TG5在表皮主要表达在颗粒层以及培养的角质形成细胞。和TG1及TG3相似,Ca2+及佛波醇酯(phorbol ester,TPA)使TG5表达增高。TG1和TG3需经酶水解而活化,TG5无需酶水解激活。
