细胞外基质及组织的重塑在皮肤的正常生理及病理过程都起着重要作用,比如在组织发展、损伤修复、血管新生以及肿瘤浸润及转移过程。组织重塑涉及突破组织学上的屏障如基底膜带以及间质或细胞外基质的降解。胶原和其他细胞外基质的降解有赖于炎细胞、角质形成细胞及成纤维细胞分泌的一组酶。其中最重要的是基质金属蛋白酶(Matrix metalloproteinases,MMPs)。
基质金属蛋白酶(MMPs)是一组含有活性Zn2+的蛋白水解酶,所以称为金属蛋白酶,依据催化区结构的不同可分为许多组。MMPs最初被认为是作用于细胞外基质的一组蛋白酶,然而之后的许多体内实验发现它同样会作用于许多非细胞外基质蛋白。由于作用底物的多样性,MMPs参与了许多与自身稳定相关的功能,例如组织修复、免疫及病理过程,包括肿瘤、纤维化和感染。
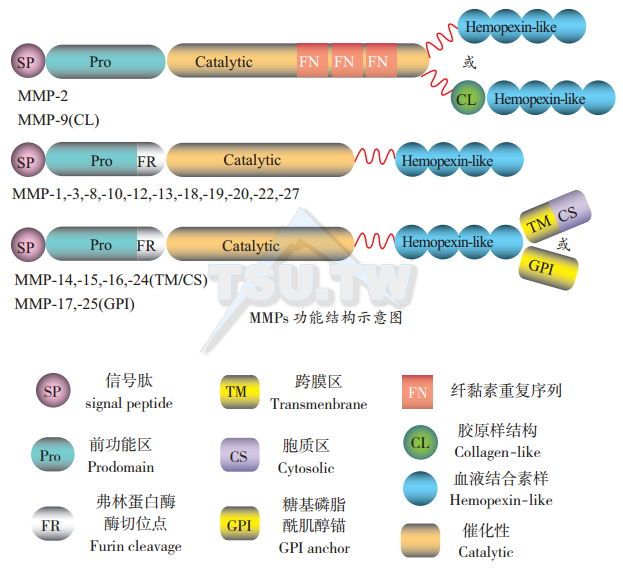
MMPs的基本功能结构由氨基端的分泌信号肽、前功能域(prodomain)和催化亚基三部分组成。MMPs是由无活性的酶原(zymogens,proMMPs)转变而来,先是信号肽激活分泌小囊,然后MMPs从细胞表面分泌出来。在催化亚基中含有组氨酸,与活性Zn2+相连。在prodomain中半胱氨酸的巯基残端与Zn2+结合使proMMPs处于无活性状态,形成所谓的半胱氨酸开关。
根据结构特征,MMPs可分为:
- 胶原酶(collagenases),包括MMP-1、MMP-8、MMP-13,底物有Ⅰ、Ⅱ、Ⅲ、V、Ⅸ型胶原,nidogen,腱生蛋白(tenascin)和纤维粘连蛋白;
- 明胶酶(gelatinases),包括MMP-2和MMP-9,降解Ⅳ、V、Ⅶ、X、Ⅺ及XⅣ型胶原,明胶、弹力蛋白、蛋白多糖以及纤维粘连蛋白;
- 基质溶解素( stromelysins),包括MMP-3、MMP-10和MMP-11,底物有Ⅲ、Ⅳ、V、Ⅶ、Ⅸ及X型胶原,弹力蛋白、纤维粘连蛋白以及rudogen;
- 间质溶素(matrilysins),包括MMP-7和MMP-26,是最小的MMPs,底物有Ⅳ型胶原、弹力蛋白、纤维粘连蛋白和腱生蛋白;
- 模型MMPs(MT-MMPs),不同于其他MMPs。模型MMPs有跨膜功能区,表达在细胞膜表面(尾端在胞质内)。成员包括MMP-14、MMP-15、MMP -16、MMP-17、MMP-24和MMP-25,底物不一。
最具代表性的是胶原酶,它可以分解Ⅰ、Ⅱ、Ⅲ型胶原纤维的三股螺旋结构。所以细胞外基质(包括胶原Ⅰ、Ⅲ)更新的快慢取决于这些酶类的活性。经过这个降解过程,胶原变为明胶,最后被明胶酶降解。MMPs也受一些因素的抑制,如金属蛋白酶组织抑制因子(TIMP1~4)的控制,TIMP与MMPs可以特异性结合,是天然的MMP抑制剂。
新近的一些体内外研究表明,MMPs的功能并小局限于蛋白水解。从MMPs的命名上容易将其联想到细胞外基质的转变和降解,这的确是MMPs家族的一部分作用。然而细胞外基质降解并不是MMPs的主要功能。许多研究表明,很多MMPs作用于非基质蛋白,如细胞因子、趋化因子、受体、抗微生物肽等。所以MMPs不应被看作单一的细胞外基质蛋白水解酶类,而应被视为涉及细胞与细胞、细胞与基质间传递信号的酶,一种具有潜在信号放大作用的蛋白。
MMPs催化活性的调节主要有四种机制:基因表达,区室化(compartmentalization,细胞外周酶的蓄积),酶原激活及酶失活。之后还会受到底物的可用性和亲和力的控制。目前促进MMPs活性的途径主要有:半胱氨酸开关(cysteine-switch),变构激活,前蛋白(proprotein)转化酶激活,MMPs活化(由MMPs激活proMMPs),纤溶酶和丝氨酸蛋白酶活化,氧化激活作用(氧化激活proMMPs)。抑制MMPs活性的机制主要有:MMP的特异性组织抑制因子TIMPs,其他天然蛋白抑制因子(如2-macroglobulin,RECK CT-PCPE),氧化灭活作用,细胞吞饮作用。
通常MMPs在正常健康组织中并不表达或很低,相反在所有的组织修复再生、疾病或炎性组织、生长的培养细胞会有不同水平的表达或增高。虽然MMPs在不同组织、疾病、肿瘤、炎症状况下表达的质与量有所不同,但是无论是在组织还是在培养皿中,生长的活性细胞均有表达。MMPs可以降解基底膜和细胞外基质,与肿瘤的生长、发展密切相关,涉及肿瘤浸润、转移、血管生成。现已在多种人类肿瘤中检测到MMPs的存在,如早期肝癌和甲状腺癌中存在MMP-I的表达,在人类结肠癌中MMP-2、MMP-7和MMP-9均过量表达,在乳腺癌中,已检测到MMP-8、MMP-9和MMP-11。据报道,MMP-9的表达与乳腺癌肿瘤的早期浸润和转移相关。而MMP-2和MMP-9与黑素瘤的浸润和转移也有高度的相关性。近年来,许多MMPs已成为肿瘤研究的焦点,有望成为治疗肿瘤的重要途径。
