表皮角质形成细胞通过细胞膜上的两种特殊结构为角蛋白纤维网提供附着点。桥粒便角质形成细胞之间相互连接,半桥粒则将基底细胞固定在基底膜带上,也是表皮与真皮之间的连接。桥粒与半桥粒的名称来自它们超微结构形态上的相似性,都具有膜相关性盘状致密斑(plaque),而桥粒具有一对这样的结构。近几年来,应用分子生物学对这两种结构分子组成的研究发现,桥粒与半桥粒是两种并不相同的结构。
桥粒的结构组成成分根据其基因来源及功能主要有三组,即斑素蛋白(plakin)、annadillo及钙黏素(cadherin)。斑素蛋白家族包括桥斑蛋白(desmoplakin,DP)、角质层斑蛋白(envoplakin)、periplakin、epiplakin、plectin、大疱性类天疱疮抗原(BPAC1)、微管肌动蛋白交叉连接因子(nucrotubule actin crosslinking factor,MACF)1以及comeodesmosin( CDSN)。armadillo家族包括桥斑珠蛋白(plakoglobin,PG)、斑菲素蛋白(plakophilins,PKPs)1~3及p0071。钙黏素(cadherin)家族包括桥粒芯糖蛋白( desmoglein,Dsg)1~4和桥黏素( desrnocallin,Dsc)1~3。依据其在桥粒的位置,桥粒的结构组成成分大致分为两大类:位于细胞膜内侧的桥粒胞质蛋白(又称桥粒斑块蛋白),包括斑素蛋白家族和armadillo家族蛋白,以及桥粒跨膜蛋白(桥粒糖蛋白)钙黏素家族(下图)。钙黏素家族跨膜蛋白Dsg和Dsc形成细胞黏附交界面,Dsc胞质内末端为位于细胞膜内侧的annadillo蛋白提供连接,而plakin家族蛋白则将细胞内细胞角蛋白连接到桥粒上。很明显,这些蛋白结构的正常表达以及相互之间的功能协调是保证表皮结构完整及功能所必须。
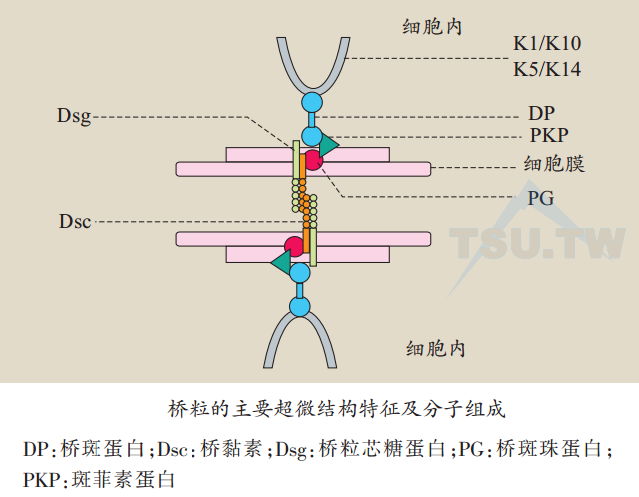
桥粒胞质蛋白
桥粒胞质蛋白位于桥粒的细胞膜内侧,由于篇幅所限这里仅就斑素蛋白家族的桥斑蛋白(desmoplakin,DP)以及armadillo家族的桥斑珠蛋白( plakoglobin,PG)作一简单介绍。
桥斑蛋白(DP)
分为DPⅠ与DPⅡ,是主要的桥粒胞质斑块蛋白,是桥粒斑块中最多的成分。DPⅠ/Ⅱ位于桥粒致密斑的最内面,是内斑块(inner plaque)的主要组成成分。它们仅存在于桥粒斑块,因此亦是桥粒的特征性标志。DPs在表皮全层均有表达。DP与半桥粒中一种主要胞质成分大疱性类天疱疮抗原(BPAG1)以及一种中间丝相关蛋白plectin属于同一组中间丝组编相关蛋白(intermediate filament organizing proteins)。这些蛋白结构上有很高的同源性。它们的C末端有高甘氨酸重复序列,这个区域可能是与中间丝相互作用的功能区。
人DP基因位于染色体6p上。DPⅠ和DPⅡ的mRNA分别为9.5 kb与7.5 kb。DP ⅡmRNA与较大的DP ⅠmRNA来自同一基因转录前体RNA,可能是由于在mRNA成熟过程中不同的切割所致。cDNA序列分析显示,DPⅠ与DPⅡ的编码序列分别为8031 bp及6 234 bp,肽链长分别为2 677个氨基酸及2078个氨基酸,分子量分别为250 kD和215 kD。免疫学及蛋白图谱分析表明两个蛋白结构相似。DP蛋白为哑铃状同种二聚体。两末端为球状,中间部分为α螺旋组成的棒状结构。DPⅠN末端的基本特征为每7个氨基酸一组的重复序列(abcdefg)n,其中a与d位置上通常为一个非极性基团。中央棒状结构也含有许多7个一组的重复氨基酸序列,整个棒状结构的特征是平均10.4个基团有周期性分布的极性基团,这种结构往往提示可以形成2条α螺旋。C末端的基本特征主要是三组每38个氨基酸为单位的重复序列,每个重复单位中央共有序列为LLEAQAATG,每组的重复单位分别为4、4、5个。缺失转染实验证实,DP的C末端是与角蛋白中间丝成分相互作用的部位。实验显示,DPⅠ的C末端“尾部”直接与Ⅱ型角蛋白N末端“头部”相结合。而DP的N末端则是使其定位于桥粒斑块所必需,并且可能与桥粒糖蛋白的胞质部分相结合,从而将角蛋白中间丝与桥粒斑块连接起来。Ca2+浓度及TPA均可诱导桥粒的形成。它们的诱导作用主要是通过蛋白激酶C促使胞质内DP移位参与桥粒的形成。
桥斑珠蛋白(PG)
PG基因定位于染色体17q21,其mRNA有3.4 kb及3.7 kb两种形式。这种差异来自其3'末端非编码区一段297 bp片断,是mRNA成熟过程中不同切割所致,具有细胞特异性。角质形成细胞中同时存在这两种形式,在表皮全层均有表达。
根据cDNA序列所得的人桥斑珠蛋白的蛋白肽链全长744个氨基酸,分子量为820 KDa。桥斑珠蛋白位于桥粒胞膜内面致密斑( plaque),不同于桥斑蛋白。桥斑珠蛋白不仅存在于桥粒,而且还广泛存在于其他多种细胞间黏附结构,如极性上皮的粘连带(zonulae adherens)。桥斑珠蛋白与桥粒跨膜糖蛋白、桥粒芯糖蛋白(desmoglein)及桥黏素Ⅰ(desmocoIlin Ⅰ)相联系。
人的桥斑珠蛋白与非洲蟾蜍E钙黏素( E-cadherin)相关蛋白βcatenin以及果蝇体节极性基因(segment polarity gene)产物armadillo在氨基酸序列上有很大的同源性。plakoglobin/βcatenin/armadillo蛋白家族参与脊椎动物形态发生中信号传递。因此,桥斑珠蛋白参与桥粒的组成则提示,除了作为细胞之间机械固定连接结构外,桥粒还有信号传递的功能。
桥粒跨膜糖蛋白
桥粒芯糖蛋白(desrnoglein,Dsg)和桥黏素(desmocollin,Dsc)是桥粒中两种主要跨膜糖蛋白。它们都是N糖苷化的Ⅰ型跨膜蛋白(即N端处于细胞外,C端位于细胞内),并同属于Ca2+依赖性细胞黏附因子钙黏素家族,因此桥粒芯糖蛋白和桥黏素又称为桥粒钙黏素。
桥粒跨膜糖蛋白基因及表达
至今已发现有四种不同基因型的桥粒芯糖蛋白(Dsg 1~4)以及桥黏素(Dsc 1~3)。所有桥粒跨膜糖蛋白基因均定位于第18染色体,簇集于18q12位点,呈cen-DSC3-DSC2-DSC1-DSG1-DSC4-DSG3-DSG2-tel 顺序排列。
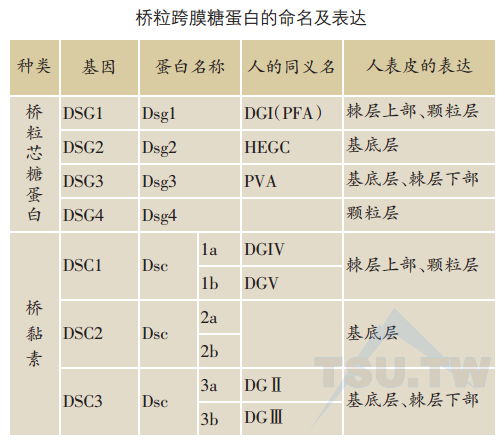
桥粒芯糖蛋白和桥黏素是桥粒特异性成分,仅表达在桥粒斑块中。桥粒芯糖蛋白2的表达广泛,存在于所有具有桥粒的组织中,而其他几种桥粒糖蛋白的表达则主要局限于鳞状复层上皮组织。不同于桥斑蛋白和桥斑珠蛋白(这两种桥粒胞质内结构蛋白在表皮全层均有),人的桥粒跨膜糖蛋白在表皮的表达表现为分化特异性。Dsg 1和Dsc 1是表皮表达最多的主要桥粒结构糖蛋白,主要在棘层上部及颗粒层。Dsg 2与Dsg 3主要分别表达在基底层及棘层下部,Dsg4仅见于颗粒层及角质层。而Dsc 2及Dsc 3则主要表达在棘层下部与基底层。
桥粒跨膜糖蛋白的结构特征
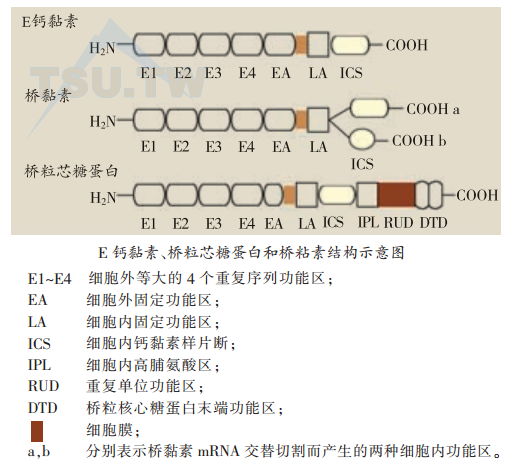
桥粒跨膜糖蛋白与经典的钙黏素蛋白结构组成相似。细胞外功能区由5个部分组成,4个氨基端部分(上图,E1-E4)含有经典的钙黏素分子间相互作用的内部重复序列结构。经典钙黏素分子中,细胞内功能区同源性很高。与之形成明显的对比,桥粒钙黏素中细胞内功能区显现出许多独有的特征,与其他钙黏素仅存在有限的同源性。与经典的钙黏素相比,桥粒芯糖蛋白结构特点是:有一个大的细胞内功能区,其C末端延长片断为桥粒芯糖蛋白所特有。RUD序列是桥粒芯糖蛋白细胞内功能区中的重复序列成分,每29个氨基酸为一重复单位。这种重复序列成分在Dsg 1、2、3和4中的数目分别为5、6、2和2。桥粒芯糖蛋白C末端为46个氨基酸组成,含有较高含量的羟基氨基酸以及5个高甘氨酸序列(XGGG)。这两种桥粒芯糖蛋白特有结构的功能意义目前还不清楚。已发现有两种桥粒芯糖蛋白是人自身免疫性大疱病的抗原成分。Dsg 1可被落叶性天疱疮自身抗体识别,因此Dsg 1又被称为落叶性天疱疮抗原(PFA)。Dsg 3则是寻常性天疱疮自身抗原( PVA)。PVA与其他桥粒芯糖蛋白的不同处在于:和桥黏素及经典的钙黏素一样,有一个完整的、大的细胞外固定区。而其他桥粒芯糖蛋白的细胞外固定区很小。另外,其细胞内片断较短,仅有2个重复序列成分。Dsg 1(PFA)和Dsg 3(PVA)在表皮不同层次的表达,也许可以解释临床水疱裂隙的位置。在落叶性天疱疮水疱出现在表皮上部,寻常性天疱疮的裂隙则在紧邻基底细胞层的棘细胞层。桥黏素细胞内功能区长度与其他钙黏素相似,并有与其他钙黏素同源的C末端。每一种桥黏素均表现为两种大小不同的形式(a和b)。cDNA序列分析表明,这种大小的差异来源于同一mRNA的不同切割所致。b型中被切的C末端在功能上可能很重要。有实验表明其可能参与功能性桥粒斑块的组装。
