半桥粒(hemidesmosome)将基底细胞固定在基底膜带上,从而将表皮与真皮连接为一体。半桥粒的主要组成蛋白至少有四种:分子量230kD的大疱性类天疱疮抗原BPAG1,位于基底细胞内的半桥粒内斑块(inner plaque)或称内致密斑(inner dense plaque)。分子量180kD的大疱性类天疱疮抗原BPAG2是一种跨膜糖蛋白,从细胞内延伸到细胞外。与这两种半桥粒蛋白相联系的是一种基底细胞特异性整合素α6β4。α6β4将基底细胞与其下方的基底膜带连接起来。网蛋白(plectin)是半桥粒组成成分中分子量最大的一种,约500kD,和BPAG1同处于半桥粒的细胞内侧,位于半桥粒内斑块的细胞最内缘,比BPAG1位置略高。网蛋白对多种蛋白有很强的亲和力,包括角蛋白K5和K14、整合素β4、板层素以及Ⅳ型胶原纤维,因此推测其可将不同的蛋白纤维网相互连接起来。以往应用分离出的半桥粒(HD)蛋白成分,生物化学研究鉴别出5种主要的HD成分,分别命名为HD1~5。目前已知HD1即为网蛋白,HD2和HD4分别是BPAG1和BPAG2,HD3和HD5则分别为β4和α6整合素。
皮肤基底膜带(basement membrane zone,BMZ):一般指位于表一真皮交界处的基底膜带,是一种高度组织化的带状结构,与身体其他部位的基底膜带相似,但也有着其特异性。与表皮相似,皮肤基底膜带始终处于动态的自我更新状态,为皮肤的正常发展以及维持皮肤的自身稳定提供信息传导。皮肤基底膜带有多方面的功能,在结构上它为皮肤提供稳固的真一表皮连接,保证皮肤的机械完整性,同时调控并作为配体信号传递介质与细胞受体如整合素结合,从而影响细胞的增生、迁移及分化,并以同样的方式影响表皮基底层角质形成细胞的极性向上迁移分化过程。表皮无血管,营养物质及代谢产物通过BMZ进入表皮,BMZ限制分子量大于40 kD的大分子通过。当BMZ损伤时,炎细胞和肿瘤细胞以及大分子可通过其进出表皮。如果BMZ结构异常,可导致真皮与表皮分离,形成水疱或大疱。
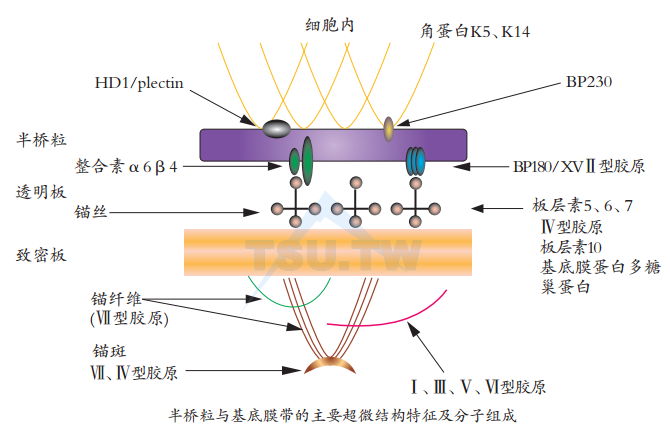
皮肤基底膜带主要由胶原网及板层素网构成,由糖蛋白、蛋白多糖及氨基葡聚糖(GAG)连接。用PAS染色时光学显微镜下为0.5-1.0 nm的紫红色均质带。电子显微镜下,BMZ可分为四个不同结构区域:胞膜层、透明板、致密板和致密板下层。胞膜层约8 nm厚,为基底层角质形成细胞真皮侧的细胞膜;透明板(lamina lucida)厚35~40 nm.电子密度较低,其主要成分是板层素,组成了细胞外基质和锚丝(anchoring filament),锚丝穿越基底膜带透明板连接半桥粒上的α6β4整合素与基底膜带致密板。构成锚丝的主要成分是板层素(laminin)5和6。致密板(lamina densa)厚约35~45 nm,主要成分是Ⅳ型胶原及板层素10,Ⅳ型胶原分子通过自体间的相互交联,形成连续的三维网格,是稳定BMZ的重要支持结构。致密板下层(sublamina densa.也称网板reticular lamina)中有锚纤维(anchoring fibril)通过,把致密层和真皮连接在一起。Ⅶ型胶原是构成锚纤维的主要成分,从基底膜带致密板出发插入真皮乳头内基底膜样结构的锚斑内,最终将基底细胞固定在真皮上,维持表皮与真皮之间的联系。
α6β4整合素
整合素是一组异种二聚体蛋白,各由一个α和一个β亚单位组成,参与细胞与细胞之间、细胞与基质之间的连接。α2β1、α3β1和α6β4是人表皮基底细胞主要的整合素。前两者位于基底细胞侧方,提示与细胞之间的黏附作用有关。而α6β4则位于半桥粒中,提示其在基底细胞与基底膜连接中的作用。
人的α6基因位于第2染色体上.mRNA长6kb。α6的氨基酸序列与其他整合素仅亚单位的序列有同源性。与整合素α5及叫相似,其细胞外近细胞膜处有一蛋白酶切位点。成熟的α6多肽由1055个氨基酸组成,细胞外部分长993个氨基酸,跨膜区长26个氨基酸。α6细胞内部分很短,仅由36个氨基酸组成。由于蛋白酶切作用,细胞外部分分成一条长的细胞外肽链及一条短的膜固定肽链。两条肽链由一双硫键连接。α6细胞外功能区近氨基末端有7个同源的氨基酸重复序列,并有4个钙离子结合部位。这些部位的氨基酸序列类似于其他Ca2+结合蛋白上的共有序列DXD/NXD/NGXXD。
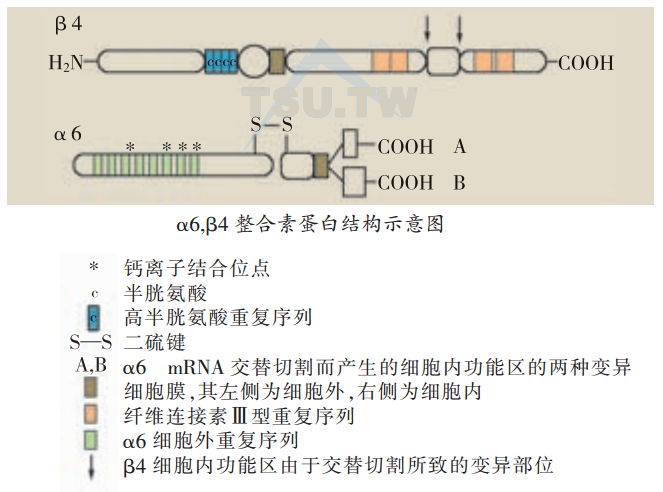
人的β4基因位于染色体17q11上。成熟的β4亚单位细胞外功能区长683个氨基酸。与其他整合素的β亚单位相似,含有4个高半胱氨酸重复序列。与其他整合素β亚单位大不相同的是,β4有一个很大的、长1072个氨基酸的细胞内功能区(其他β亚单位细胞内功能区仅约50个氨基酸长),含有4个纤维连接素(fibronectin)Ⅲ型重复单位。这种结构可能直接参与组成半桥粒结构蛋白之间的相互作用。β4和α6两个亚单位由于mRNA的交替切割,细胞内功能区都有变异的形式。可能与其不同的配体亲和力、与细胞骨架纤维之间的相互作用或信号传递有关。α6细胞内部有A和B两种变异,B较A长18个氨基酸,皮肤仅表达α6A。β4主要表达的mRNA为6 kb,另外还有两种表达较低,分别为7.5 kb及5 kb的mRNA存在。β4细胞内功能区近C末端有两处分别可以有插入序列210 bp或159 bp。此外,β4细胞内、外功能区均易受组织特异性蛋白酶水解作用,因此,又为基底细胞与基底膜之间的相互作用提供了多种途径。
在复层鳞状上皮,α6β4整合素与BPAG1和BPAG2 一起组成半桥粒,β4细胞内功能区介导半桥粒的组装。并且,α6β4通过细胞内功能区与角蛋白网相联系,通过细胞外功能区与板层素5锚丝相联系,从而将基底细胞与基底膜连接起来。通过与之相联系的酪氨酸激酶,α6β4还参与了信号传递。
大疱性类天疱疮抗原BPAG1
大疱性类天疱疮抗原BPAG1和BPAG2又称为BP230和BP180抗原,是组成半桥粒的另外两种主要成分。这两种半桥粒组成蛋白可被大疱性类天疱疮患者自身抗体识别。BPAG1基因定位于人第6染色体短臂6P11~12位点。基因全长约20kb.有22个外显子,外显子长78~2810 bp。由cDNA推导出的单一编码区长7947 bp,产生的蛋白肽链长2649个氨基酸。BPAG1与桥斑蛋白结构十分相似,也为哑铃状,中央为α螺旋组成的棒状结构,两端为球状结构。和桥斑蛋白相似,中央棒状结构也由大量7个一组的重复氨基酸序列组成,并有周期性线状分布的极性基因。C末端主要为以38个氨基酸基因为单位的重复序列组成的两个亚功能区,与桥斑蛋白C末端后两个亚功能区序列有很高的同源性。重复序列上亦有规则的周期性分布的电荷,这一点与角蛋白棒状结构区1B上的相似,提示这里可能是桥斑蛋白与角蛋白之间相互作用的部位。
前面已经谈到,BPAG1与桥斑蛋白Ⅰ/Ⅱ是半桥粒与桥粒之间目前所知的惟一联系。两个基因均位于染色体6P11~12区,两个蛋白氨基酸序列结构相似并且功能相关。与角蛋白丝相互作用参与角蛋白纤维网的组织与形成,并与另一种分布较广泛的中间丝相关蛋白plectin一起组成了一组中间丝组编相关蛋白。
大疱性类天疱疮抗原BPAG2
BPAG2分子量180 kD的BPAG2最初发现是大疱性类天疱疮的一种自身抗原。目前已知BPAG2自身抗原也见于妊娠疱疹及良性黏膜类天疱疮患者。这三种获得性自身免疫性水疱性疾病的特征是患者血清中有循环IgG自身抗体,可以识别BPAG2抗原决定簇。
不同于BPAG1,BPAG2是半桥粒的一种跨膜蛋白,由于其细胞外肽链主要为由多个GlyXY重复序列组成的胶原样节段,故又称为X Ⅶ型胶原。BPAG2基因固定位于人第10染色体长臂的10q23.4位点,其mRNA约长6kb。cDNA序列分析表明,BPAG2有一单一的编码区长4596 bp,肽链全长为1532个氨基酸。BPAG2蛋白是一种少见的Ⅱ型跨膜蛋白,即其N末端位于细胞内,而C末端位于细胞外,N末端即细胞内段肽链由501个氨基酸组成,其中部含有4个由24~26个氨基酸组成的串联重复序列,这种重复序列的意义目前还不明确。BPAG2跨膜区由23个氨基酸组成。被大疱性类天疱疮及妊娠疱疹或良性黏膜类天疱疮患者自身抗体所识别的BPAG2主要抗原位点被定位于细胞外段近膜处非胶原样区14个氨基酸片断。BPAG2蛋白最明显的结构特征是氨基端(N-端)较短,位于细胞内;羧基端(C-端)为较长的细胞外肽链,与皮肤基底膜透明板的锚纤维连接。细胞外肽链约1000个氨基酸长,其C末端916个氨基酸由15个胶原体功能区组成(即由GlyXY重复序列组成,脯氨酸含量占1/3以上)。每个胶原样功能区长约15~242个氨基酸,相互间被短的非胶原样片断隔开。BPAG2这种细胞外胶原样区域可能是其与细胞外基质成分相互作用从而稳定表皮与真皮联系的结构部位。
网蛋白
网蛋白属于plakin家族,人plectin基因(PLECI)定位于染色体8q24,mRNA为14.8 kb.基因结构与桥斑蛋白(DP)及BPAG1有相似性。网蛋白序列分析显示有与p-spectrin,a-actinin,utrophin和dystrophin等相似的肌动蛋白(actin)连接功能区。网蛋白的表达分布广泛,除存在于有典型半桥粒的组织如表皮外,还存在于没有半桥粒的内皮细胞以及神经胶质细胞中。网蛋白对多种蛋白有很强的亲和力,包括肌动蛋白、角蛋白K5和K14、整合素β4、板层素以及Ⅳ型胶原纤维,很明显在连接细胞、半桥粒及基底膜带中起有重要作用。
板层素(laminin)
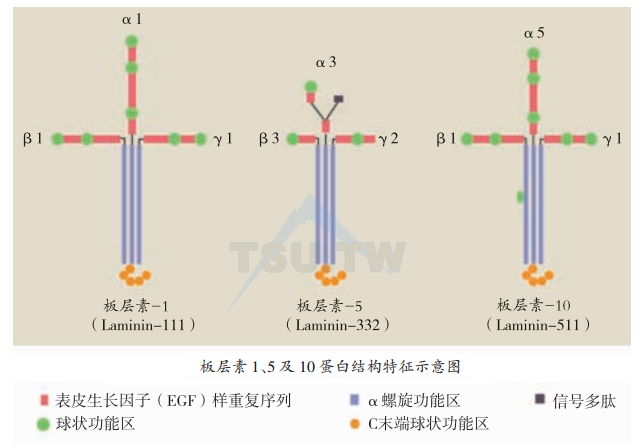
板层素是细胞外基质中主要的非胶原性糖蛋白,广泛存在于基底膜带。所有板层素都是大分子的细胞外异源三聚体糖蛋白,由α、β和γ链组成。三条链C末端结合在—起形成的长臂与来自三条链N末端的三条短臂,形成不对称的“十”字架构型(上图)。迄今为止,已鉴定出5个α链(α1~α5)、3个β链(β1~β3)和3个γ链(γ1~γ3),均由不同基因表达合成,目前共发现15种板层素(下)。三种不同链不同的组合是板层素功能的组织特异性的基础。板层素链的氨基端与基底膜其他细胞外基质发生相互作用,为其下方的真皮提供附着点。它的羧基端(在长臂仪链的特殊球形G区)含有细胞接合位点,可以和细胞表面受体相互作用,参与许多重要的细胞与基质之间的相互作用。板层素蛋白的结构特点包括参与聚合的小球状功能区、表皮生长因子(EGF)重复序列(与nidogen结合,从而与Ⅳ型胶原网结合)以及仅链羧基端与整合素结合的位点。整合素α1β1,α2β1,α3β1,α6β1,α7β1,α6β4,αvβ3和αvβ5是板层素的主要受体。近期研究显示,板层素是通过影响细胞的增生、迁移和分化而影响组织的形态和功能。
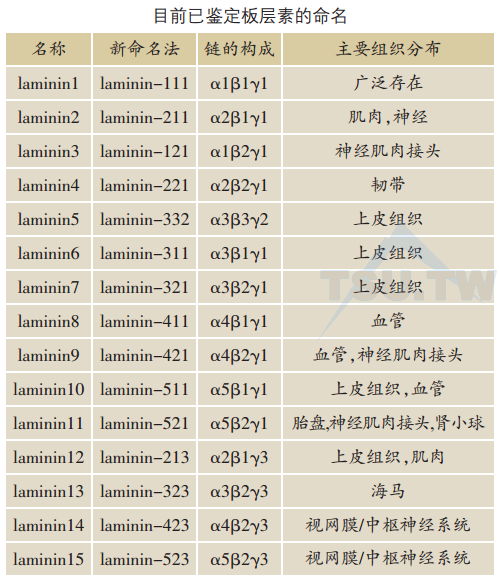
好几种板层素被报道存在于真-表皮交接处的基底膜带。板层素1是第一个被报道存在于表皮基底膜致密板。三种包含α3链的板层素5(α3β3γ2,BM600)、板层素6 (α3β1γ1以往称为k-laminin)、板层素7(α3β2γ1)在基底膜透明板中发现,板层素5分别与板层素6及7呈共价结合在一起。研究发现板层素5与皮肤创伤愈合有关,它们存在于浅层过度生长的角质形成细胞中,引导角质形成细胞迁移和蔓延。近年来板层素10(α5β1γ1)被发现是表皮基底膜带致密板表达的主要板层素,同时也是真皮微血管的主要板层素,具有很强的促进角质形成细胞黏附的作用。新近研究发现板层素8(α4β1γ1)和10(α5β1γ1)是真皮微血管表达的板层素,在皮肤血管形成中起重要作用。
许多板层素突变所致疾病使我们认识到板层素的重要性。例如,板层素5的缺陷可以导致人类严重的甚至致命的疾病—一交界性大疱性表皮松解症(JEB),而板层素10缺损小鼠皮肤则显示毛发发育障碍。板层素5以往又称为epiligrin,kalinin或nicein,是连接半桥粒与基底膜带致密板的锚丝的主要组成成分。
组成板层素5的α3、β3及γ2链各为LamA3、LamB3及LamC2基因的蛋白产物。三个基因分别位于染色体18q11.2,1q25~31及1q32区域。由于板层素1是板层素家族的经典代表,而板层素5与板层素1有很大相似性,这里我们主要通过与板层素1的比较来说明板层素5的结构特征。
板层素1由α1、β1及γ1三条链组成,三条短臂上共有42个表皮生长因子(EGF)样重复序列(在α1、β1及γ1分别为18、13及11个)。每个EGF样重复序列约有60个氨基酸基因,其中含有8个位置恒定的半胱氨酸基因。这些EGF重复序列中间夹有7个球状结构,每个约由200个氨基酸基因组成。在三条链交接中央,三条链相互之间各由二硫键相连。板层素1长臂由三条肽链的α螺旋结构功能区Ⅰ和Ⅱ约600个氨基酸组成,含有特征性的7个氨基酸-组的重复序列(a,b,c,d,e,f,g)n,其中a和d为疏水基因,e和g为极性基因。前面已经谈到,这种结构是形成α螺旋螺线状结构蛋白的特征,并被认为是板层素亚单位相互作用、相互稳定形成异种三聚体所必需。β1及γ1链终止于功能区Ⅰ,并由一个二硫键相连,而α1链则继续延伸约1 000个氨基酸基因,这些氨基酸基因折叠成5个同源性基因,每个有150~180个氨基酸,共同组成G功能区(上图左)。
与板层素1相比,板层素5主要的不同处在三条短臂上,其上有许多缺失部分,而长臂的功能区结构特征则保留了下来(上图中)。板层素5的α3链由1713个氨基酸组成,分子量为165kD。α3短臂上没有α1 N末端的Ⅲb至Ⅵ功能区,仅有见于α1的Ⅲa功能区,其中含有2个完整的富含半胱氨酸的EGF样重复序列以及一个部分的EGF样重复序列。α3与α1的Ⅲa功能区氨基酸序列同源性为46%。α1肽链N末端有两种形式,在Ⅲa功能区前可以是一段信号多肽(SP),或是一段相当于α1上的Ⅳ功能区序列。这两种不同的N末端可能来自mRNA交替切割过程。与之相应的是α3 mRNA也有两种形式,分别为6 kb及5 kb。LamB3基因全长29 kb,mRNA约4 kb,成熟的β3肽链长1153个氨基酸,分子量为140 kD。板层素5β3链与板层素1β1链整个结构十分相似。β3短臂由相当于β1上的Ⅵ功能区以及部分V和部分Ⅲ功能区组成,含有多个EGF样重复序列,但缺乏β1上的Ⅵ球状功能区以及其两旁的部分Ⅲ、V功能区氨基酸序列。所有的半胱氨酸基团以及它们的位置在β1及β3中均一致。
两个肽链短臂功能区Ⅵ、Ⅴ、Ⅲa的氨基酸序列同源性分别为42%、46%以及54%。Lam C2基因位点紧靠Lam B3基因位点,Lam C2 mRNA有5.2 kb及4.3 kb两种。5.2 kb cDNA有一短的5’末端非编码区及一长的3’末端非编码区,分别为117 bp及1504 bp,编码区长3579 bp,合成21个氨基酸的信号多肽以及1172个氨基酸的γ2链。4.3 kb mRNA与5.2 kb mRNA不同处主要在3’端,从第3446 bp起,编码区终止在第3451 bp,其后的3’非编码区长866 bp。合成的肽链为1090个氨基酸长。γ2链上有6个可能的糖苷化位点,如果都用上的话,由两种mRNA形成的肽链分子量则分别为140 kD与130 kD。板层素5γ2链与板层素1γ1链整个蛋白结构相似。不同处在于短臂上没有γ1上的Ⅵ功能区,Ⅲ、Ⅳ及V功能区亦较短。γ2的V功能区为3个半EGF样重复序列,Ⅳ功能区为与γ1Ⅳ功能区相似的球状结构,Ⅲ功能区由4个半EGF样重复序列组成。由4.3 kb mRNA合成的γ2肽链长臂Ⅰ/Ⅱ功能区C’末端还短少82个氨基酸片断。γ2与γ1链氨基酸序列的相同率很高,在V、Ⅳ、Ⅲ和Ⅰ/Ⅱ功能区分别为55%、52%、55%及34%。γ2链被分泌后经过蛋白水解酶的作用,进一步失掉Ⅳ及V功能区,成为分子量为105 kD的肽链。这种蛋白水解的过程及产生的肽链片段调节板层素5占细胞表面受体以及细胞外基质的相互作用,从而对其功能也起调控作用。
Ⅳ型及Ⅶ型胶原纤维
胶原家族是一组以GlyXY重复序列组成的三螺旋结构为特征的蛋白。组成胶原纤维的三个亚单位各自形成左手螺旋,然后相互缠绕形成右手螺旋索状结构——称为三螺旋结构。Ⅳ、Ⅶ和X Ⅶ型胶原是基底膜带的主要胶原成分(本文图1),其中Ⅳ型胶原最为丰富。Ⅳ型胶原在表皮-真皮交界处基底膜带致密板形成了三维网络状结构。另外,它还是真皮血管基底膜带的主要胶原成分。Ⅶ型胶原也叫锚纤维,穿过致密板聚集在真皮乳头上部与Ⅳ型胶原一道组成锚斑。锚纤维的迂回部分也和以Ⅰ、Ⅲ型胶原为主的间质胶原相结合。X Ⅷ型胶原是已知的大疱性天疱疮抗原(BPAG-2或BP180).属于半桥粒的跨膜蛋白(已在前面半桥粒部分谈到,此处不再多叙)。
Ⅳ型胶原纤维是基底膜带的主要胶原成分。Ⅳ型胶原纤维形成一种复杂的网状结构支架,对基底膜带的组装起着关键的作用。已发现有六种Ⅳ型胶原纤维α链,α1~6,组合成α1α1α2(广泛分布)、α3α4α5和α5α5α6(见于皮肤)。皮肤肿瘤浸润、转移首先需要突破基底膜带,因此估计皮肤肿瘤有不正常的Ⅳ型胶原沉积。结节型基底细胞癌与Ⅳ型胶原α5链表达降低及异常分布有相关性,浸润性更强的基底细胞癌类型则显示α1链的异常分布。Ⅳ期黑素瘤也见Ⅳ型胶原血清浓度增高。
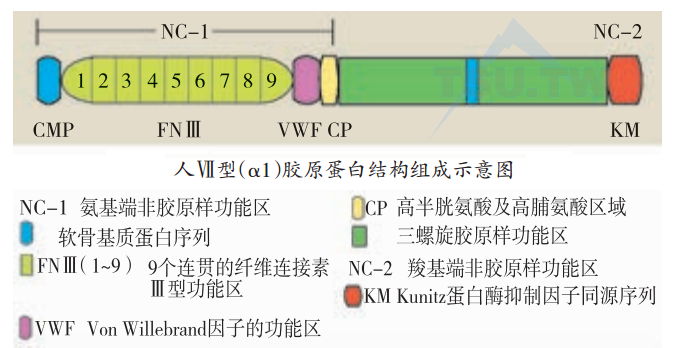
Ⅶ型胶原是表皮-真皮基底膜带附着结构锚纤维的主要成分(也许是惟一成分)。它将基底膜与真皮内由Ⅳ型胶原参与的锚斑连接起来,从而将表皮固定在真皮上。人的Ⅶ型胶原基因COL7A1位于第3染色体3p21位点,其上游约3~4 kb处是合成细胞色素bc1核心Ⅰ蛋白(core Ⅰ protein of the cytochrome bc1 complex)基因。COL 7A1基因全长约31 kb,含有118个外显子,是目前已知基因中含外显子最多的基因。Ⅶ型胶原的mRNA约9.2 kb.其表达主要局限于复层鳞状上皮,包括皮肤与黏膜。Ⅶ型胶原cDNA序列分析显示有一个长113 bp的5’以及342 bp的3’末端未编码区,以及一个长8 833 bp的编码序列,可以合成2 944个氨基酸长的α1原多肽链。Ⅶ型胶原由三条α1多肽链组成。α1原多肽链中央部分由胶原样节段组成,两端为—个大的N末端(NC1)及一个小的C末端(NC2)非胶原样功能区。
DNA序列分析发现,在COL 7A1 5’端至第1内含子序列片断上有好几个可能的转录因子结合位点,如NF1、AP1、AP2以及SP1结合位点,但没有经典的CAAT框。并且与其他角质形成细胞特异性表达基因不同,也没有明显的TATA框。
NC1球状非胶原样功能区由1 253个氨基酸组成,由27个外显子编码合成。NCI功能区含有好几个与黏附蛋白同源的亚功能区,可能是Ⅶ型胶原纤维与基底膜带致密板及真皮锚斑附着的部位。首先是—个由第2~5外显子编码产生的与软骨基质蛋白同源的亚功能节段(CMP),接着为9个Ⅲ型纤维连接素(fibronectin)样重复序列亚功能区(FNⅢ),每个重复序列由2个外显子编码合成。其后为一个VWF样基元,由第24~26外显子编码产生。NC1的最后两个外显子编码产生一个富脯氨酸和半胱氨酸的功能区(CP)。这个功能区与已知的蛋白序列没有同源性。中央的三螺旋编码区由84个外显子组成,合成的胶原样功能区长1 530个氨基酸,由特征性的GlyXY胶原重复序列组成,其间夹有19个不完全胶原样序列或一般3~10个氨基酸长的非胶原样插入序列。最长的—个非胶原样插入序列长39个氨基酸,位于胶原样功能区中央。第112个外显子是一个交界外显子,它的3’末端部分与另外6个外显子(第113~118)编码合成长161个氨基酸的球状非胶原NC2功能区,最后—个外显子(第118)还包括长333 bp的3’末端未编码区。NC2功能区含有一个与Kunitz型蛋白酶阻抑蛋白同源的片断(KM)。NC2区还含有8个半胱氨酸基团。这些基团被认为参与二硫键的形成,从而稳固两个Ⅶ型胶原分子在细胞外的组装。Ⅶ型胶原al肽链合成后被分泌到细胞外,两个α1分子反向相接在球状C末端重叠。球状C末端在二聚体组装过程中被切掉。二聚体由二硫键固定,二聚体然后再相互并排聚合成三螺旋锚纤维结构。
NCI末端与基底膜带多种细胞外基质结合,如纤维粘连蛋白、板层素5、Ⅰ型及Ⅳ型胶原。因此Ⅶ型胶原的异常引起基底膜带组织损伤,从而致真-表皮分裂,导致临床上营养不良性大疱性表皮松解症。
