肿瘤细胞中的代谢改变受到癌基因和抑癌基因网络调节系统的影响,其中很多抑癌基因都是miRNA的靶点,例如:miRNA-320、miR-123a、miR-422、miR-506和miR-136以磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)为作用靶点,PI3K能够调节细胞质膜上的磷酸磷脂酰肌醇,在肿瘤细胞代谢中发挥重要作用。
研究表明细胞代谢过程中几个关键酶都是miRNA的靶点,提示miRNA参与细胞代谢。Tibiche等系统分析了人类细胞代谢调节网络中miRNA作用的靶基因,结果发现79个多基因节点可作为miRNA的靶点,加上单基因节点,共有238个基因节点是miRNA的靶点。miRNA与代谢之间的关系揭示了miRNA主要调节代谢途径:氨基酸的生物学合成、糖和脂肪代谢,具体见图2-11-2。
miRNA通过很复杂的机制调节细胞代谢,包括直接作用于代谢过程中的关键分子如转运载体或酶/激酶,并调节多个致癌信号通路。miRNA在转录因子翻译,致癌基因和抑癌基因,包括p53、c-Myc、腺苷蛋白激酶(adenosine monophosphate activated protein kinase,ATP activated protein kinase,AMPK)、Akt信号途径中发挥作用,具体可见图2-11-3。
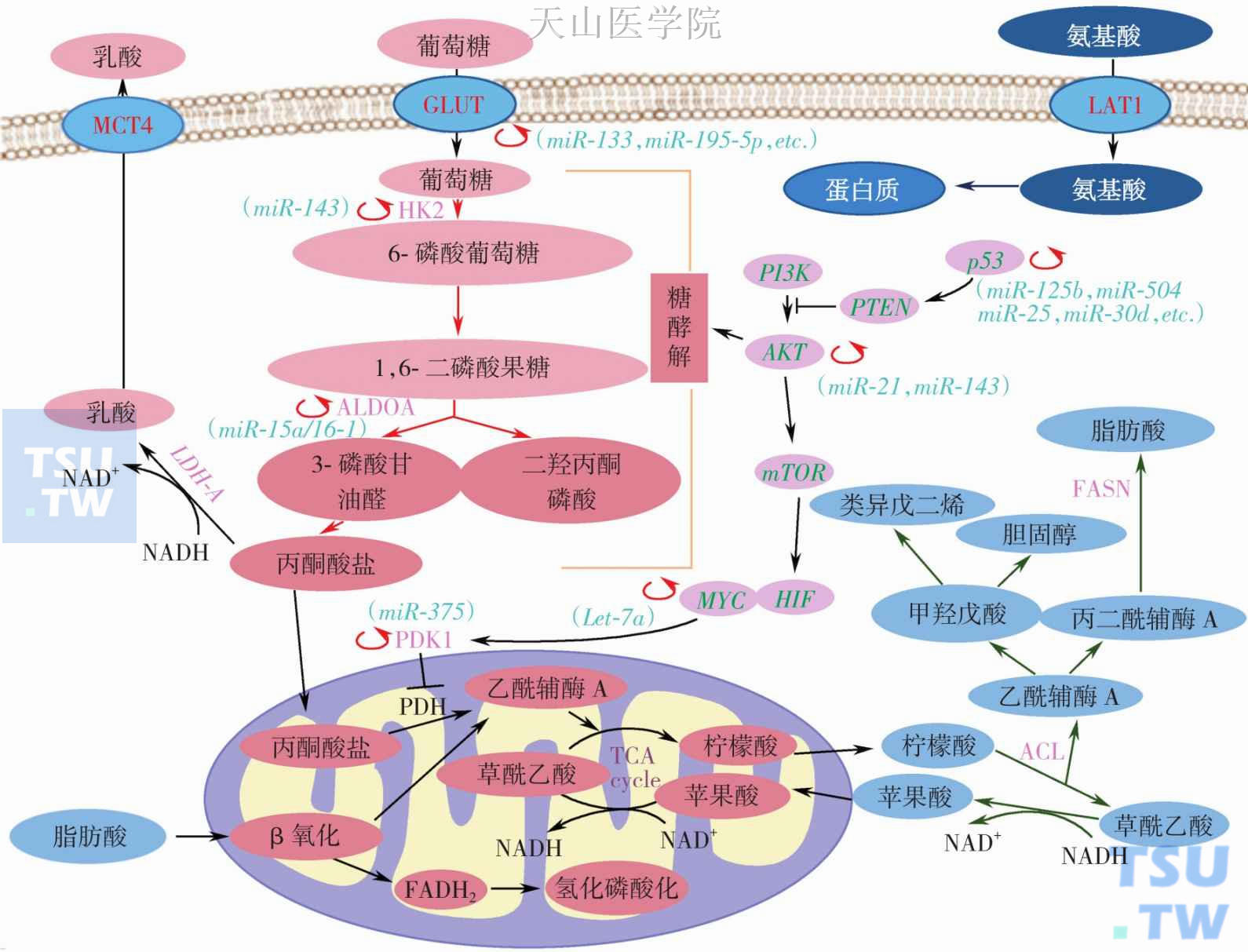
图2-11-2 miRNAs与癌细胞代谢
miRNAS通过作用于关键的代谢酶和多个癌症信号通路调节细胞代谢。箭头表示促进或激活或转运或转化等作用,黑色J形线表示抑制或阻断作用,红色环形箭头表示调控。miRNA能够通过调节代谢转运体如GLUT或代谢酶(HK2、ALDOA和PDK1),并能够与p53、c-Myc和AKT/mTOR 信号通路相互作用。图中能够被miRNAs调节的代谢步骤标记为红色环形箭头,相关的miRNAs在括弧内记录。FASN,fatty acid synthase,脂肪酸合酶;GLUT,glucose transporter,葡萄糖转运体;HIF,hypoxia-inducible factor,缺氧诱导因子;LAT1,L-type amino acid transporter 1,左旋氨基酸转运蛋白1;LDH-A,lactate dehydrogenase isoform A,乳酸脱氢酶激酶同工酶;MCT,monocarboxylate transporter,单羧酸转运蛋白;PDH,pyruvate dehydrogenase,丙酮酸脱氢酶;PDK,pyruvate dehydrogenase kinase,丙酮酸脱氢酶激酶;PI3K,phosphatidylinositol 3-kinase,磷脂酰肌醇3-激酶
miRNA调节糖代谢
miRNA影响糖摄取
糖代谢从氧化磷酸化向有氧酵解转变是一个重要的肿瘤细胞生化特点,称之为Warburg效应。Warburg效应能够维持肿瘤细胞在低氧环境下通过增加糖酵解来维持其生长,同时也生成大量乳酸。葡萄糖转运体(glucose transporters,GLUTs)是很多哺乳动物细胞膜上广泛存在的一种膜蛋白,能够促进葡萄糖通过细胞膜,至今已经确定有14种GLUTs。GLUT1、GLUT2和GLUT3转录总量在很多肿瘤组织中明显提高。肿瘤细胞中GLUTs水平增高与代谢加速,葡萄糖需要量和摄取量增高有关。多个因素影响GULTs的表达,包括激素如:卵巢激素尤其是雌激素;缺氧;代谢应激诱发的信号通路,如腺苷蛋白激酶(AMPK)等都可以上调肿瘤细胞中GULTs的表达。
在葡萄糖代谢的最初步骤中,葡萄糖需要通过GLUT3或GLUT4穿过细胞膜转运到细胞质中,而GLUT3或GLUT4均是miRNA133和miR-195-5p的靶点。因此,miRNA可以通过调节GLUTs的表达直接调节细胞内葡萄糖水平。miRNA-133通过作用于KLF15来调节GLUT4的表达。研究表明在肾癌细胞中下调miR-199a、miR-138、miR-150 和miR-532-5p能够增加GLUT-1的表达,而增加miR-130b、miR-19a、miR-19b和miR-301a能够下调GLUT-1的表达。在膀胱癌T24细胞株中miR-195-5p通过作用于GLUT3的3′UTR直接调节GLUT3的表达。
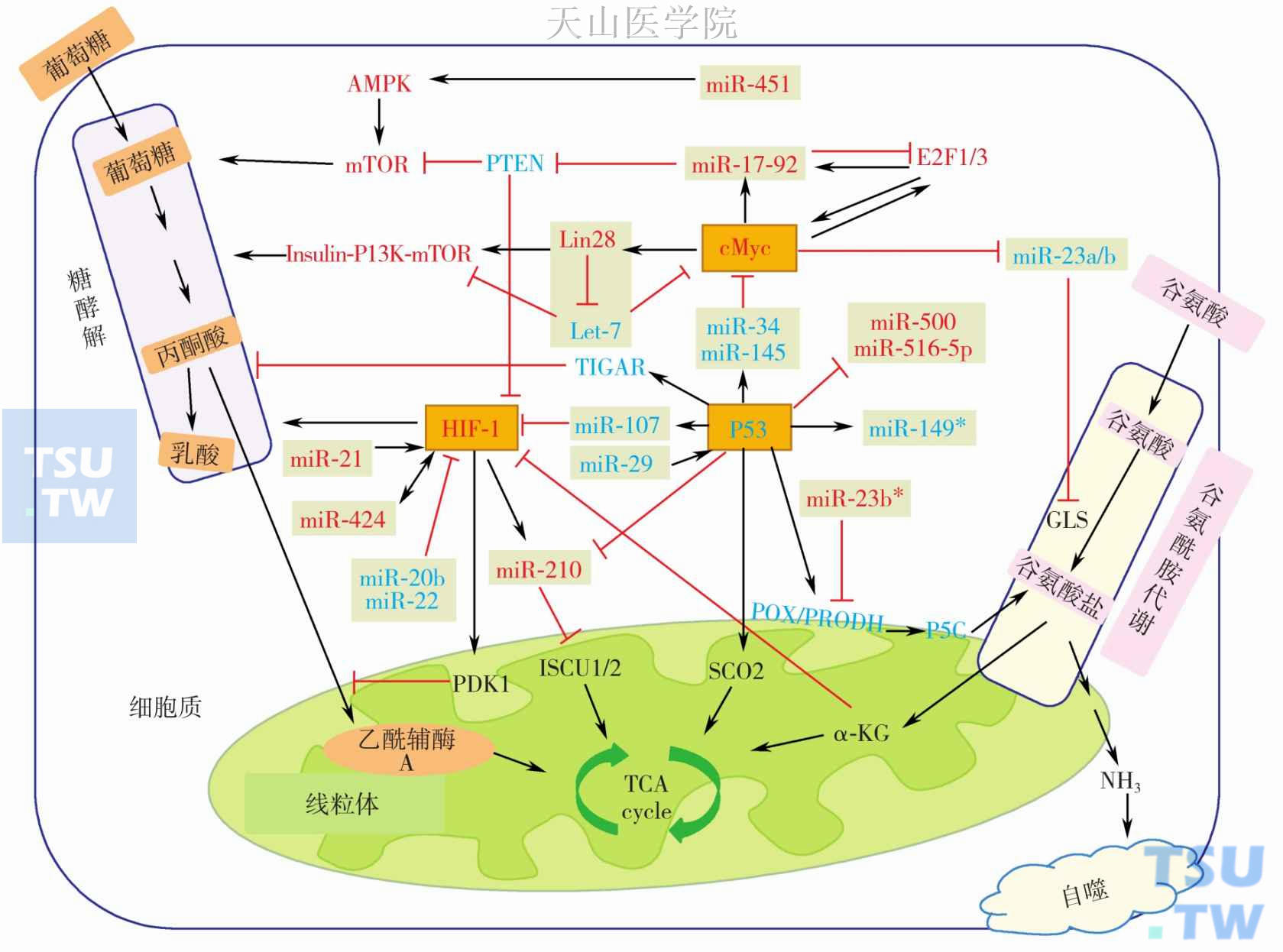
图2-11-3 miRNAs与致癌基因/抑癌基因网络调控系统和它们在肿瘤代谢中的作用
黑色箭头表示激活、促进、转运或转化作用,红色J形箭头表示抑制或阻断作用。例如关键的致癌基因:图中红色标记的cMyc、HIF-1、miR-17-92 和miR-210;例如关键的抑癌基因:图中蓝色标记的 P53、PTEN、Let-7和miR-23a/b 。灰色方框里标记的是miRNAs。AMPK,adenosine monophosphate-activated protein kinase,腺苷蛋白激酶;PTEN,phosphatase and tensin homolog,与张力蛋白同源的第10号染色体上丢失的磷酸酶基因;E2Fs(E2F transcription factors),E2F转录因子;PI3K,phosphoinositide 3-kinase,磷脂酰肌醇3-激酶;GLS,glutaminase,谷氨酰胺酶;TIGAR,TP-53 induced glycolysis and apoptosis regulator,P53诱导糖酵解和凋亡调节因子;POX/PRODH,proline oxidase/proline dehydrogenase,脯胺酸氧化酶/脯胺酸脱氢酶;P5C,1-pyrroline-5-carboxylic acid,吡咯烷酮羧酸;PDK1,pyruvate dehydrogenase kinase 1,丙酮酸脱氢酶激酶1;ISCU1/2,iron sulfur scaffold protein,铁硫蛋白1/2;SCO2,cytochrome C oxidase 2,细胞色素C氧化酶2;α-KG,alpha-ketoglutarate,α-酮戊二酸盐
miRNA在糖酵解中的作用
研究表明miRNA调节是糖酵解途径中的不可逆的步骤,尤其是调节关键酶。例如:miR-143是糖酵解过程中的关键调节者,它可以通过作用于HK2靶点来调节糖酵解。最近发现OSBL8(oxysterol-bindingproteinrelated-protein 8)是miR-143的作用靶点。另外,miR-155能够抑制miR-143,从而在转录后水平上调HK2的表达,还激活HK2的转录激活因子即信号传导及转录活化子3(signal transducer and activator of transcription 3,STAT3)。研究还发现miR-143在原发皮肤癌的细胞株和头颈部鳞癌的细胞株中均可以抑制HK2的表达。miR-143在结肠癌细胞中影响糖代谢,同样,在肺癌中也有类似的发现。多项研究都发现miRNA-143作用于HK2靶点调节癌细胞中的糖代谢,因此它可以作为肿瘤治疗的靶点。
miRNAs除了作用于不可逆的限速步骤外,还可以调节糖酵解过程中的其他重要的中间步骤。在糖酵解过程中,果糖1,6二磷酸经由醛缩酶A (Aldo A)中的可逆羟醛反应催化,分解成为3-磷酸甘油醛和磷酸二羟丙酮。在这一过程中,miR-122可作用于醛缩酶A,同时miR-15a/16-1也可以下调醛缩酶A的水平。因此,miR-122和miR-15a/16-1参与了癌细胞的糖酵解过程。
肿瘤细胞中的有氧糖酵解受到多个miRNA参与的致癌信号通路控制。如:Akt受到miR-21的调控,通过直接调节糖酵解的酶和激活下游的哺乳动物雷帕霉素靶向蛋白(mammalian target of rapamycin,mTOR)活性来刺激糖酵解。因此代谢过程中的任何步骤如果出现miRNA失调控都将导致代谢异常和肿瘤发展。
miRNAs在三羧酸循环中的作用
肿瘤细胞中的有氧糖酵解提示葡萄糖转化为丙酮酸并在随后转变为乳酸。乙酰辅酶A(acetyl-CoA)倾向于被引入到截断的三羧酸(tricarboxylic acid,TCA)循环,结果是乙酰辅酶A转运到细胞质中。在截断的TCA循环中,柠檬酸优先输出至细胞质中,并被ATP柠檬酸裂解酶(ATP citrate lyase,ACL)分解,产生草酰乙酸和乙酰辅酶A。草酰乙酸继续分解为苹果酸,然后再次转运到线粒体中,并在线粒体基质中再次转变为草酰乙酸,并与乙酰辅酶A反应完成剩下的代谢循环。
葡萄糖代谢从氧化磷酸化到有氧糖酵解的改变被认为是肿瘤的常见事件,这一途径受到miRNA影响。如miR-103和miR-107提示调节细胞内的乙酰辅酶A和脂肪水平。除此之外,一系列miRNA包括miR-152、miR-148a、miR-148b、miR-299-5p、miR-19b、miR-122a、miR-421、miR-494和miR-19a都可调节TCA循环中最主要的代谢酶即柠檬酸合成酶的基因。除此之外,miR-210由缺氧环境中产生的HIF-1α诱导生成,它可以抑制铁-硫簇装蛋白(iron-sulfurcluster assembly proteins,ISCU1/2)。ISCU1/2能使[4Fe-4S]和[2Fe-2S]铁硫簇聚集,它是TCA循环有关酶的组成成分,如顺乌头酸酶。因此,miR-210在ISCU1/2的效应是导致TCA循环活性较低。此外,miRNA还可以通过作用于转录因子Myc和缺氧诱导因子等间接调节TCA循环。
miRNA调节胰岛素生成
miRNA可调节胰腺细胞的发育,胰岛素生成以及释放。Lynn 等研究表明miR-375在胰腺内分泌前体细胞中表达,敲除miR-375的纯合子小鼠表现为胰腺β细胞总量减少,推测miR-375在胰腺β细胞发育中发挥重要的作用。Poy等进一步研究证实敲除miR-375的小鼠中胰岛α细胞数量增加,空腹和餐后胰高糖素水平增加,糖异生和肝糖输出增加,同时β细胞数量减少,提示miR-375对维持胰腺α、β细胞数量和生理功能起重要作用。另有研究发现miR-124a也在胰岛β细胞中大量存在,在发育的胰腺中低表达,在孕期和生育年龄显著增高,提示miR-124a可能在调节胰腺β细胞发育中起作用。
miRNA通过调节胰岛素分泌,功能和敏感性来影响葡萄糖摄取和产生。胰岛素与胰高血糖素一起维持血糖的平衡。miR-375被确定选择性的在胰腺内分泌细胞中表达。miR-375过度表达可抑制葡萄糖刺激的胰岛素分泌,抑制miR-375的表达可增强胰岛素分泌。此外,肌侵蛋白证实是miR-375的靶点。miR-375对肌侵蛋白的表达和胰岛素释放的调节作用可能是通过转录核因子-κB (nuclear factor-κB,NF-κB)起作用,NF-κB 的激活和葡萄糖刺激的胰岛素释放增加有关,故miR-375可以作为新的肿瘤靶点。
miRNA与脂肪代谢
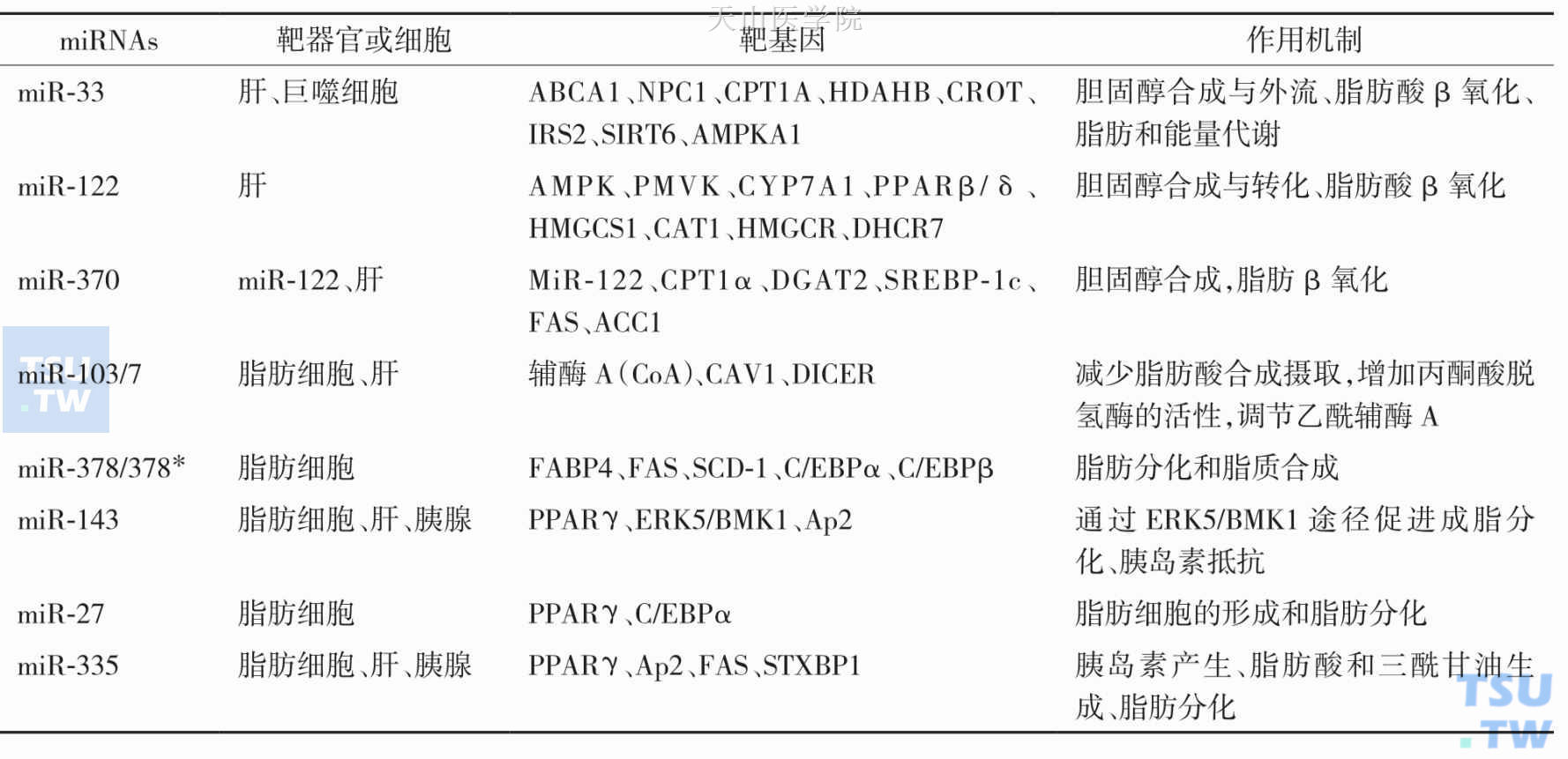
研究发现miRNA与三酰甘油和胆固醇代谢以及脂肪酸氧化等脂质代谢皆有关系,调节着胆固醇相关酶的活性。2003年Xu等研究发现沉默miR-14,可以增加三酰甘油及甘油二酯水平,但增加miR-14表达,血脂水平则恢复正常,表明miR-14在脂肪代谢中起调节作用。此外,研究证据表明miRNA参与脂肪细胞前体的分化与成熟。miR-143、miR-27、miR-335分别位于第19号染色体的19p13.13和7号染色体的7q32.2上,这3个miRNA与脂质代谢也有一定关系,主要通过调控脂肪分化标记物PPARγ、C/EBPα、Ap2以及FAS等参与脂肪分化和脂肪堆积。Takanabe等指出miR-143过表达能够促进脂肪细胞分化,而沉默miR-143则能抑制脂肪细胞分化过程,同时检测到miR-143与分化标志物PPARC和脂肪酸结合蛋白(Ap2)两者的表达密切相关,并发现miR-143可能通过ERK5/BMK1发挥作用。最近研究发现miR-27a通过与PPARγ3′UTR结合参与脂肪细胞的分化作用。在脂肪细胞分化过程中,miR-27被下调,而miR-27过表达,将阻碍脂肪生成过程中的两个主要调节基因PPARγ和C/EBPα的表达,从而抑制脂肪细胞的形成,同时miR-27受肥胖导致的低氧状态所调控。在肥胖患者中发现miR-335表达上调。miR-335表达在肥胖小鼠模型中的肝脏组织和白色脂肪组织中表达上调,且与体重、肝及脂肪组织的重量增加和三酰甘油以及胆固醇的含量升高有关,同时miR-335的水平与脂肪分化标记物如PPARγ、Ap2、FAS和STXBP1有关。miR-378/378*位于过氧化物酶体增殖物激活受体(PPAR)的基因序列中,在脂肪生成过程中高度表达。miR-378/378*通过改变脂肪代谢因子的活性,间接调节脂肪的合成,对脂质代谢的调节起着一定的作用。miR-370通过miR-122使肝内甘油三酯积聚,还可以直接调节SREBP-1c、DGAT2和Cpt1α和其他脂肪代谢基因的表达。
miR-122在成人肝脏中胆固醇和脂肪酸代谢中起重要调节作用。正常小鼠模型中抑制miR-122可以导致血浆中胆固醇水平的下降,增加肝脏脂肪酸氧化,降低肝内脂肪酸和胆固醇合成速度,但血浆胆固醇水平下降可导致肝内脂肪储积明显增加,引起脂肪肝,并且导致数个脂肪生成基因表达下降。故目前认为miR-122是肝内脂肪代谢重要的调节因子。病理生理条件下胰腺β细胞中miRNA表达会发生改变。最近Rayner及Najafi-Shoushtari等研究发现miR-33具有抑制ATP结合盒转运蛋白A型构件1(ATP-binding cassette transporter subfamily A member 1,ABCAl) 和C型1类尼曼-匹克蛋白(Niemann-Pick C1protein,NPC1)的表达,调节胆固醇从细胞内向ApoA1的流出,从而影响血浆中HDL水平。miR-33a/b基因位于在人类SREBF基因内含子中,并广泛表达于不同的细胞和组织中,包括心、肝、脾、肺、脑、小肠、结肠、骨骼肌、巨噬细胞和内皮细胞等,无组织特异性,在脑和肝脏中含量较高。它可控制ABCA1,ABCA1是一种胆固醇流出泵,是高密度脂蛋白合成和周围组织反向转移胆固醇的重要转移载体。miR-33a/b除了调节胆固醇的外流,还直接调节脂肪酸β-氧化基因相关蛋白的表达,包括脂酰肉毒碱转移酶(carnitine O-octanoyltransferase,CROT)、羟酰辅酶A脱氢酶、肉毒碱棕榈酰转移酶-1A(carnitine palmitoyltransferase-1A,CPT1A) 、脂酰辅酶A脱氢酶-β-酮脂酰辅酶A硫解酶-β-烯酰辅酶A水化酶[hydroxyacyl-CoA dehydrogenase-3-ketoacyl-CoA thiolase-enoyl-CoA hydratase (trifunctionalprotein)β-subunit,HADHB],以及能量平衡调节因子AMPK-a1、SIRT6、胰岛素受体底物-2的表达,在脂肪代谢途径中发挥重要作用。
参与脂肪代谢的部分miRNAs见表2-11-3。
表2-11-3 参与脂肪代谢的部分miRNAs
miRNA在氨基酸代谢中的作用
肿瘤恶液质的患者体内蛋白质代谢改变主要表现为蛋白质合成减少和蛋白分解增加、蛋白转化率升高、血浆氨基酸谱异常、低蛋白血症、内脏蛋白消耗、无脂体重下降、骨骼肌萎缩以及机体呈现负氮平衡。骨骼肌约占正常成人体重的40%,是瘦体组织群的主要成分,骨骼肌是蛋白丢失的主要场所,恶性肿瘤患者内源性的氮丢失首先是骨骼肌降解,随后才是内脏蛋白的耗竭。研究发现骨骼肌蛋白分解与ATP-泛素-蛋白酶体途径的激活密切相关,这一途径在恶性肿瘤引起的肌肉分解萎缩中起重要作用。研究表明miRNA参与了对ATP-泛素-蛋白酶体途径的调控,这也证明了miRNA参与调节恶液质患者的蛋白代谢过程。氨基酸代谢与蛋白质、核苷酸、脂肪的合成,氧化还原平衡和能量代谢密切相关。miR-23b调节脯氨酸氧化酶,这是脯氨酸分解代谢的第一个酶,在人类肾脏肿瘤中下调。miR-122下调阳离子氨基酸转运体CAT-1,调节氨基酸代谢。在果蝇的研究中发现miR-277在控制氨基酸分解代谢过程中扮演一个开关作用。此外,miR-29b证实控制α-酮酸脱氢酶复合体支链的组成,并催化支链氨基酸(包括亮氨酸、异亮氨酸和缬氨酸)分解代谢的不可逆的步骤,提示miR-29b在氨基酸代谢中发挥控制作用。
