细胞因子多态性及其意义
最近对多个人的全基因组测定结果表明,人类基因组中有1亿多个基因多态性位点,比预期的多。近年来细胞因子基因多态性与疾病的关系引起关注,如移植物抗宿主病、细胞因子风暴、对罹患肿瘤的敏感性等都与细胞因子基因多态性有关。细胞因子基因中有许多单核苷酸多态性(SNP)和微卫星多态性,这些多态性中的某些位点与启动基因转录有关,影响转录。此外,不少细胞因子转录过程中发生选择性剪接增加了细胞因子的多态性;许多细胞因子蛋白有不同的糖基化位点,糖基化程度也可以有很大不同,即翻译后的修饰也增加细胞因子的多态性,有不同的生理和病理生理作用。如体内存在多种不同修饰蛋白的巨噬细胞集落刺激因子(M-CSF 即CSF-1):可溶性的、膜结合型的、基质蛋白结合的糖蛋白或蛋白糖等,在不同组织、不同部位表达,有不尽相同的功能。
免疫系统的基因多态性明显地影响免疫反应,白细胞抗原(HLA)就是范例,研究已久。趋化因子是免疫系统中最具多态性的细胞因子,它们的多态性增加了免疫反应的变异性。进化过程中趋化因子变异最多,形成了超家族,功能复杂。趋化因子多态性与疾病的关系研究较多。
近十年来的研究表明,细胞因子和天然免疫基因多态性是导致HLA抗原匹配移植发生移植物抗宿主病的原因。其中对炎症细胞因子TNF-α、IL-1、IL-6和IL-10、TGF-β等的多态性研究较多。
细胞因子的多功能性和功能冗余性
经过近半个世纪的研究和临床实践,逐步认识到细胞因子的多功能性是普遍现象。例如,EPO是最早发现研究最深入临床应用最多的造血细胞因子,近年来肯定了EPO的非造血调节功能,包括:在非造血组织中有EPO受体的表达,如脑、心脏;在胚胎心肌中EPO促进心肌细胞增殖;实验表明EPO有促血管新生和血管保护效应;有些实验研究表明EPO影响免疫反应和创伤修复。对EPO心、脑保护作用的研究表明,还有第二个受体成分参与,即IL-3、IL-5、GM-CSF受体共有的亚单位βcR,用剔除βcR基因的小鼠实验证明了βcR的作用。
按照细胞因子的定义,受体是传递信号的跨膜蛋白,但是广泛深入研究表明存在不传递信号的受体,如诱骗受体(decoy receptor)是从果蝇到人类进化过程中保留下来的细胞因子的协调机制,诱骗受体的名称就表明它没有传递信号的功能。趋化因子的功能冗余性(redundancy)也表现在它们有不传递信号的受体,是白细胞迁移的重要机制,即在趋化因子浓度梯度引导下迁移,是体内的天然免疫和获得性免疫机制的基础过程之一。
细胞因子作用的网络性
近十多年的重组造血细胞因子临床应用和实验研究表明,除了补偿性使用造血细胞因子外,细胞因子用于临床的治疗效果不如预期,有时得到相反的效果。这种现象提示细胞因子作用的网络性。最近Hamilton再次强调集落刺激因子体内作用的网络性,再次提出促炎症“CSF网络”:炎症中被刺激的巨噬细胞与相邻细胞间(如内皮细胞、上皮细胞、成纤维细胞、软骨细胞、成骨细胞、角质细胞、星形胶质细胞或T淋巴细胞)间通过集落刺激因子形成CSF网络(下图)。例如巨噬细胞被T-细胞产生的细胞因子、微生物或自身抗原刺激后产生细胞因子如IL-1、TNF,它们再激活附近的组织细胞,结果增加集落刺激因子M-CSF、GM-CSF、G-CSF的产生,局部或全身性地促进巨噬细胞、中性粒细胞及其前体细胞的存活、增殖、分化和活化。在炎症部位巨噬细胞、中性粒细胞增多,IL-1和TNF正反馈增加,导致慢性炎症反应。
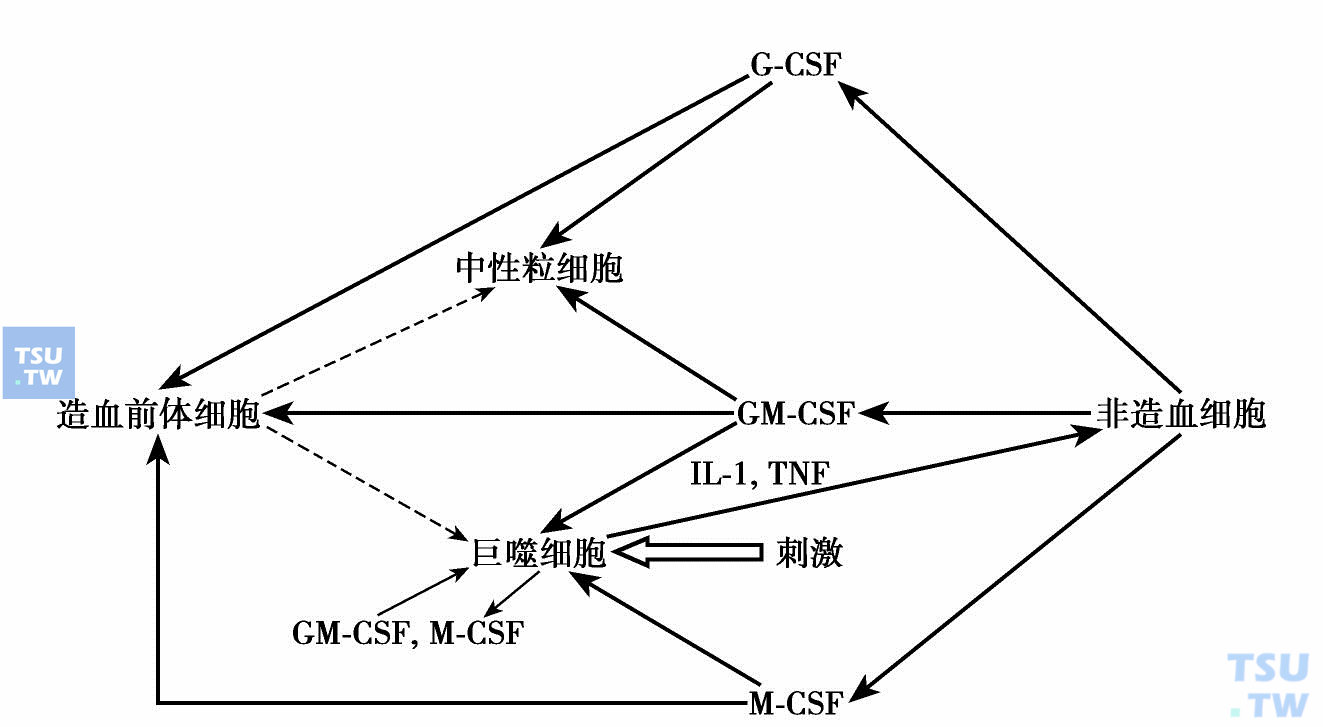
促炎症“CSF-网络”假设(Hamilton 2008)
造血细胞因子的作用及其意义
在感染和炎症或造血系统有毒性损伤时外周循环的成熟血细胞减少或缺乏,出现的病理生理反应是造血干祖细胞的动员和扩增。炎症因子(如TNF、IL-1)不能直接刺激造血,但是它们刺激其他细胞(尤其是内皮、巨噬细胞、基质细胞)产生造血生长因子动员造血干祖细胞,促进它们增殖。细菌毒素也能刺激内皮细胞产生造血生长因子。造血生长因子的水平也受成熟血细胞的负调节。
集落刺激因子(CSF)是造血细胞生长因子,后续研究表明CSF对成熟血细胞的功能有明显的病理生理作用,可能成为治疗某些炎症和自身免疫病的生物制剂,有的已进入临床试验,有的已用于治疗。近年来对巨噬细胞集落刺激因子的应用研究引人注目,本节以此为例讨论其应用前景。
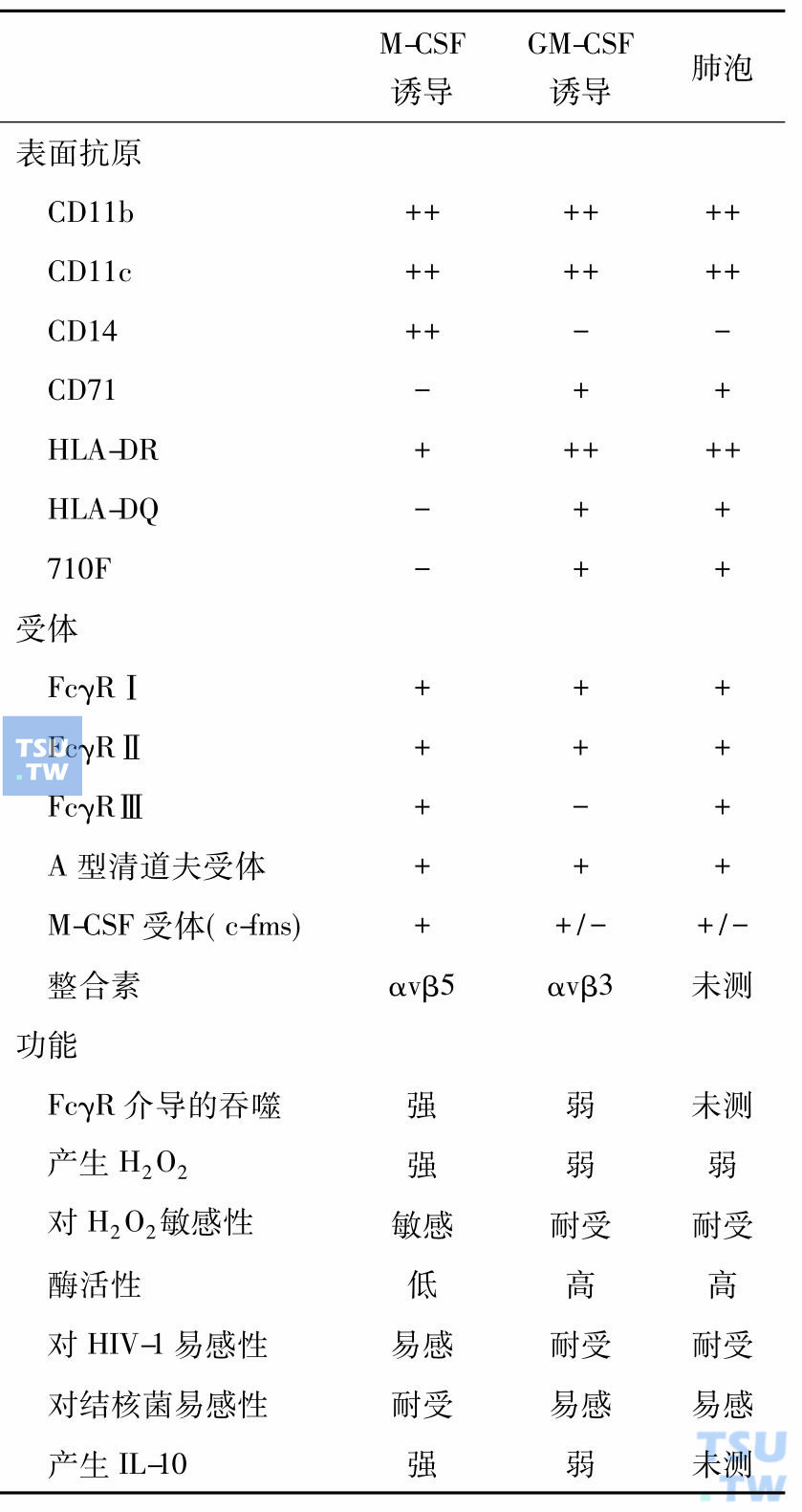
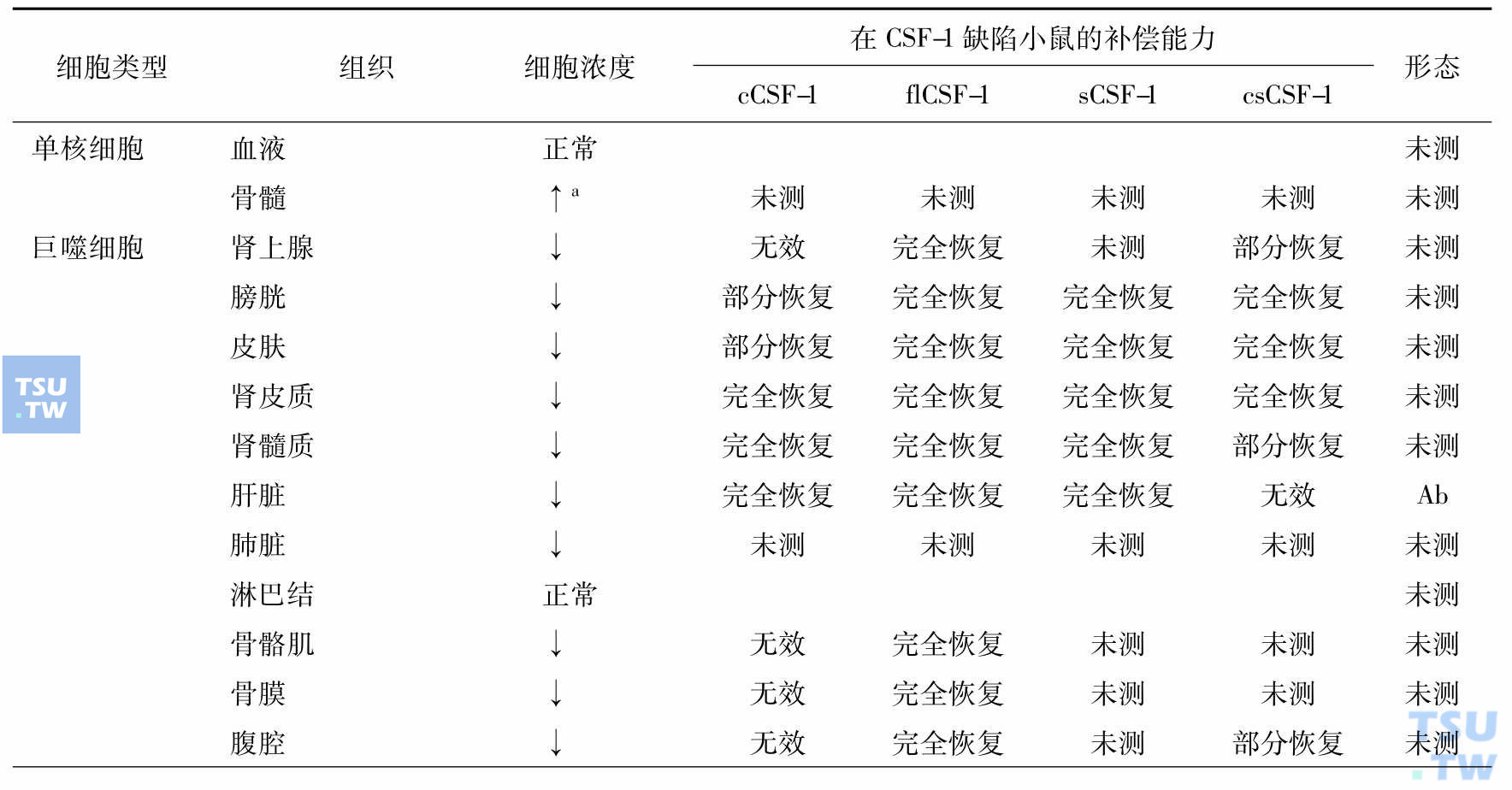
顾名思义巨噬细胞集落刺激因子(M-CSF,又名CSF-1)是巨噬细胞赖以生存的细胞因子,但是它有多种其他功能,所以许多学者称其为CSF-1,近年发现它与肿瘤的发展和转移相关。深入研究证明CSF-1刺激肿瘤的发展和转移是通过调节肿瘤相关的巨噬细胞(TAM),在CSF-1作用下TAM产生肿瘤细胞生长因子、基质金属蛋白酶和血管生长因子。肿瘤细胞通过产生CSF-1,TAM通过产生细胞因子与肿瘤细胞对话。对缺失CSF-1基因小鼠的研究表明,巨噬细胞是异质性的,有的组织单个核吞噬细胞依赖循环血的CSF-1,有的则依赖局部表达的CSF-1,而有的不依赖CSF-1。单个核的吞噬细胞包括血液中的单核细胞、组织中的巨噬细胞、树突细胞、小神经胶质细胞和破骨细胞,维持组织稳定,是防御病原侵犯的前沿。但是,不同组织、不同来源的巨噬细胞性质不尽相同(下表)。
不同来源巨噬细胞的性质(Akagawa 2002)
单个核吞噬细胞和破骨细胞发育和成熟对CSF-1的需求(Akagawa 2002)
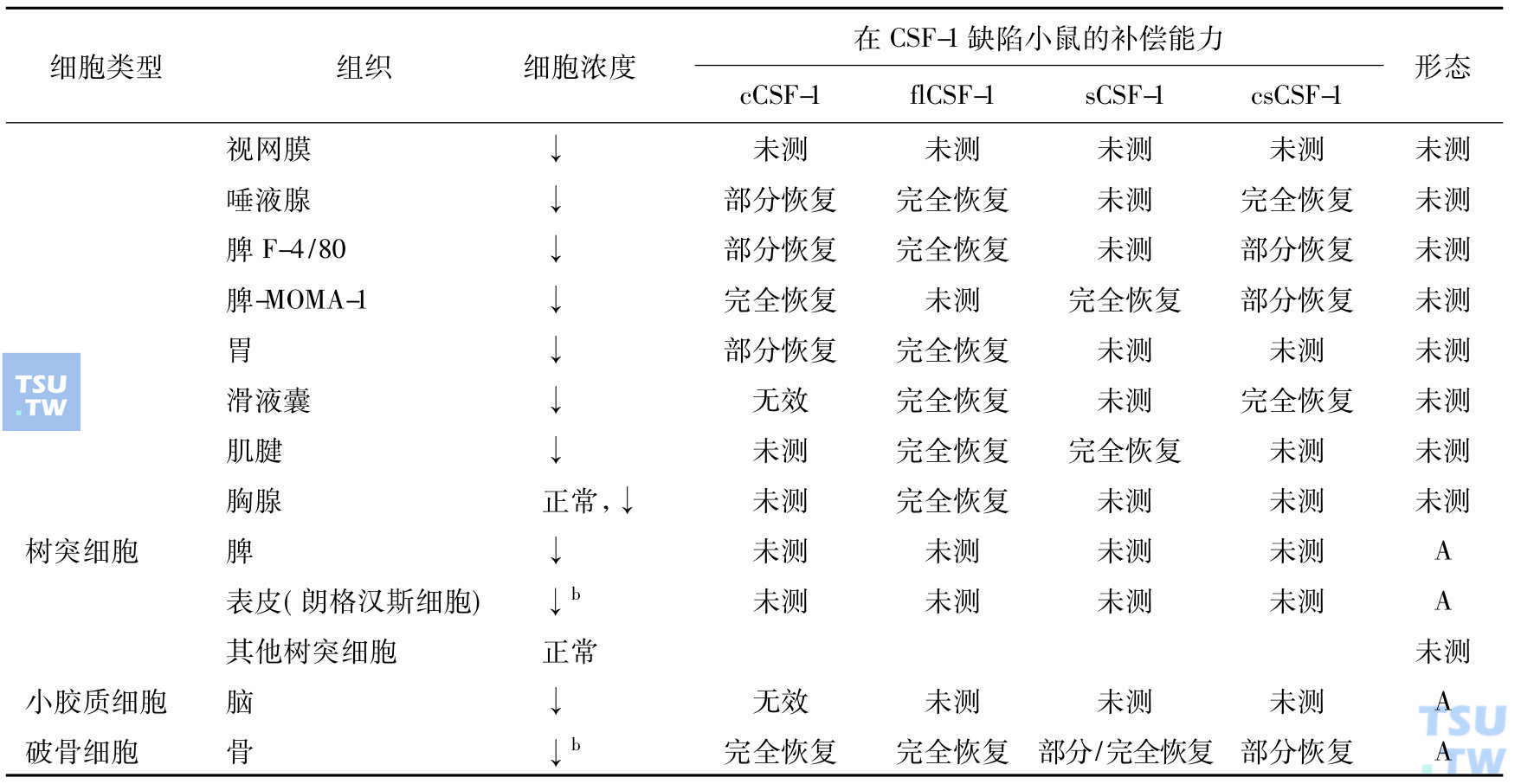
注:cCSF-1:血循环中的CSF-1。出生后每日皮下注射重组的人cCSF-1、flCSF-1 sCSF-1、csCSF-1;flCSF-1:全长CSF-1,产生3种异型的CSF-1;sCSF-1:编码分泌型糖蛋白和蛋白糖形式的CSF-1;csCSF-1:专门编码细胞表面的CSF-1;↑:增加;↓:减少;A:形态变化(细胞变小,胞质、溶酶体、吞噬体、空泡减少);a:两周龄增加,此前有脾脏髓外造血;b:乳鼠期很低,成年后正常。
类风湿关节炎和骨关节炎患者的滑液囊成纤维细胞组成性产生CSF-1,与核因子配体的受体激活因子(receptor activator of nuclear factor kappa B ligand,RANKL)协同诱导滑液中的巨噬细胞分化成破骨细胞,导致骨破坏。患者血浆CSF-1水平升高与浸润组织的CD14+CD16+单核细胞数升高相伴,导致持续炎症状态。CD14+CD16+单核细胞高表达TLR-2并产生炎症细胞因子,CSF-1能增加CD16和TLR-2的表达。CSF-1能促进炎症单核细胞的扩增,加重关节炎的病情。所以,CSF-1可能是关节炎的一个治疗靶点。
近年来的实验研究结果表明巨噬细胞也有极化状态(M1和M2),与M-CSF浓度有关。巨噬细胞通过免疫耐受或免疫活跃驾驭炎症状态:各种组织中存在许多巨噬细胞,正常情况下有足够高的M-CSF水平维持它们在M2极化状态,即免疫活跃状态,能产生促炎症因子。在炎症、自身免疫和感染情况下,巨噬细胞处于高浓度的促炎症因子刺激下(如GM-CSF、IFN-γ和LPS)表达某些促炎症因子(如TNF、IL-23、IL-12mRNA)干扰信号转导,转换巨噬细胞的极性为前炎症状态(M1)。在低浓度M-CSF的情况下M1增多,MCSF浓度增加时M1减少(下图)。
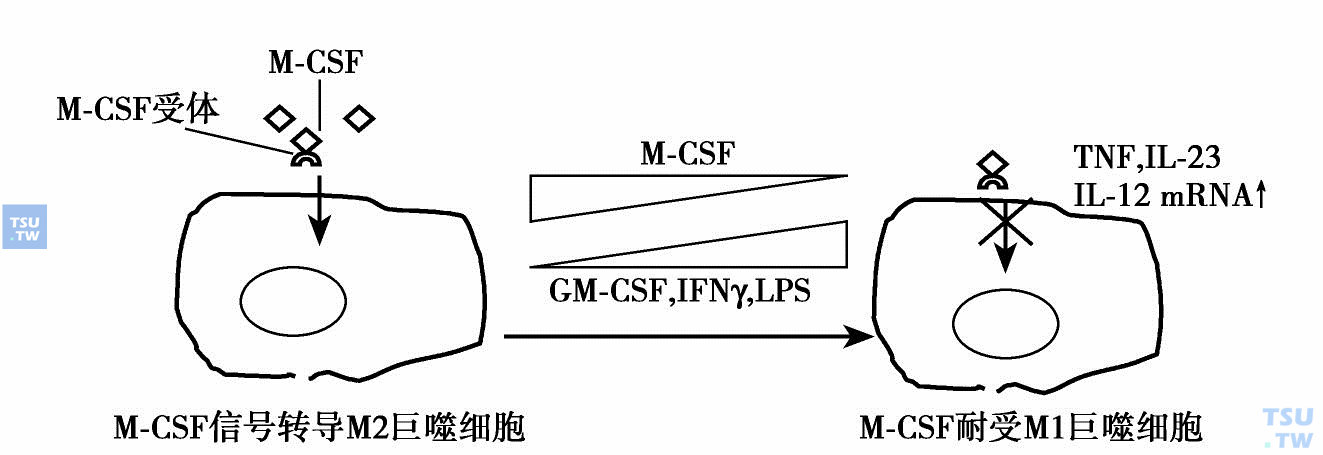
巨噬细胞驾驭炎症状态
近年来的研究表明肥胖是慢性低度炎症状态,积蓄了依赖CSF-1的巨噬细胞(没有别的白细胞)。业已证明白色脂肪组织的多少与CSF-1水平相关。动物实验表明外周血的CSF-1有抗动脉粥样硬化效应,但是膜结合型的CSF-1可能有促动脉粥样硬化效应。CSF-1与动脉粥样硬化的关系是引人关注的重要课题,正在研究中。
CSF-1还有调节树突细胞(DC)分化的功能。树突细胞前体细胞的CSF-1受体启动子是未激活的,在分化过程中活化。与T细胞抗原特异性作用后,树突细胞丧失CSF-1受体表达,亦即丧失对CSF-1的增殖反应以及吞噬和黏附的能力。人类外周血中有两类树突细胞:淋巴细胞样形态和表面标志的CD11-CSF-1R-DC和髓细胞样形态和表面标志的CD11+CSF-1R+DC,只有后者能摄取抗原。朗格汉斯细胞(Langerhans cell,LC)是表皮的树突细胞,高度依赖CSF-1,高表达CSF-1R。小胶质细胞是中枢神经系统的巨噬细胞,活化后可成为树突细胞,CSF-1在此起关键性作用。
CSF-1对单核细胞和巨噬细胞的效应-增强细胞毒性、过氧化物酶的产生、吞噬功能、趋化性和细胞因子的产生,通过Toll-样受体(TLRs)调节、启动一些天然免疫反应,抑制另外的一些反应。CSF-1下调TLR1、TLR2、TLR6、TLR9的表达,但是对TLR4无效;增强另一些脂多糖受体的表达,但是抑制CpGDNA反应;增强P2X7的表达;调节树突细胞和巨噬细胞的炎症反应,包括细胞内杀菌能力和刺激Th2细胞反应产生细胞因子的能力(下表)。
CSF-1调节的细胞因子和表面抗原表达

注:↑:增加;↓:降低;↓↓:明显降低;↓↓↓:大量降低;a:CSF-1与IL-10联合作用;b:CSF-1与LPS联合作用;c:CSF-1与IL-10及LPS联合作用
造血细胞因子的临床应用
一、造血细胞因子用于造血干/祖细胞动员和扩增
经多年的临床实践和实验研究表明G-CSF是最佳的造血干/祖细胞动员剂。在单用G-CSF效果不佳时联合或序贯应用其他造血生长因子,如GMCSF、SCF或EPO等。G-CSF的干细胞动员机制不在于对受体的直接结合效应,而是通过对成熟造血细胞的间接作用,促使它们分泌多种酶(如使成熟粒细胞释放弹性蛋白酶、组织蛋白酶、白明胶酶等)破坏归巢相关的CXCR4/SDF-1的作用,促使造血干/祖细胞离开原有的微环境。
近十多年来积累了一些经验、教训。曾经试用过多种细胞因子进行造血干/祖细胞的体外扩增培养,现在主要用SCF、G-CSF和EPO为造血生长因子进行体外培养,扩增的细胞虽然从细胞标志看尚属造血干/祖细胞,但体内效果的评估仍取决于临床效果。目前文献报道的主要临床资料来自乳腺癌患者的造血干细胞移植效果的临床观察,以能减少中性粒细胞减少和血小板减少时期为指征,显然,情况与白血病有所不同,所以对于造血干/祖细胞体外扩增尚需继续研究。
二、造血细胞因子用于治疗
原先期望重组的集落刺激因子在临床上治疗骨髓衰竭综合征能取得突破性进展,然而大部分临床应用结果令人失望。只有先天性中性粒细胞减少症在长期应用rhG-CSF后中性粒细胞数得以增长,能减少严重的细菌感染。其他血液病应用系列特异性生长因子后仅有短期改善,或因受体变异而无效。临床试用多系造血生长因子(如SCF、c-kit配体)往往因获得相反的结果而终止临床试验。至今尚无证据表明造血生长因子诱发白血病,但是在先天性粒细胞缺乏症和Fanconi贫血患者应用rhG-CSF的结果表明,造血生长因子能诱导已经转化细胞的优先生长,因此长期应用时应该检测造血干/祖细胞有无异常克隆。
在试验过的几乎所有的炎症和自身免疫病的实验模型中,去除集落刺激因子能抑制疾病或损伤,与它们的促炎症功能一致。然而在某些情况下,尤其是创伤时给予CSFs则有利于治疗,可以用GM-CSF 和M-CSF能增强防御功能解释,还能用减少微生物在局部定居解释。如Crohn病用GM-CSF治疗就可能减轻局部炎症。看来给药途径和方法影响CSFs的治疗利弊,局部用CSFs可能就像体外效应那样,增加髓细胞的数量和活性;全身用药则可能从骨髓动员髓系前体细胞。此外剂量应该适当,过大的剂量可能抑制内源性CSFs的生成。
从20世纪80年代末以来重组红细胞生成素(rhEPO)已成功地用于肾衰竭引起的肾性贫血;用于化疗、放疗的肿瘤患者和先天性和获得性骨髓衰竭综合征的贫血和心血管病以外的手术患者可以减少输血,能取得明显的疗效或改善患者的生活质量。由于红细胞生成素对非造血组织作用的研究进展,阐明了一些肿瘤细胞表达EPOR影响疗效,开拓了红细胞生成素及其衍生物的临床应用前景,对一些非肾性贫血和MDS患者进行选择性治疗;如果作为组织保护剂的临床试验获得成功,红细胞生成素的临床应用将有更大的意义和效益(下表)。
红细胞生成素及其衍生物的临床应用(仿Arcasoy 2008)

1994年克隆和纯化人类TPO后,很快研制出重组的rhTPO和聚乙烯乙二醇化的重组人类巨核细胞生长和发育因子(PEG-rHuMGDF),称为第一代血小板生长因子,用于治疗血小板减少症的临床试验。1998年因静脉给药后产生抗体,导致血小板减少而终止临床试验。多年来进行第二代血小板生长因子的研制,针对减少抗原性研制TPO的多肽类似物或非肽类似物,尚无临床试验报道。
(吴克复 马小彤)
