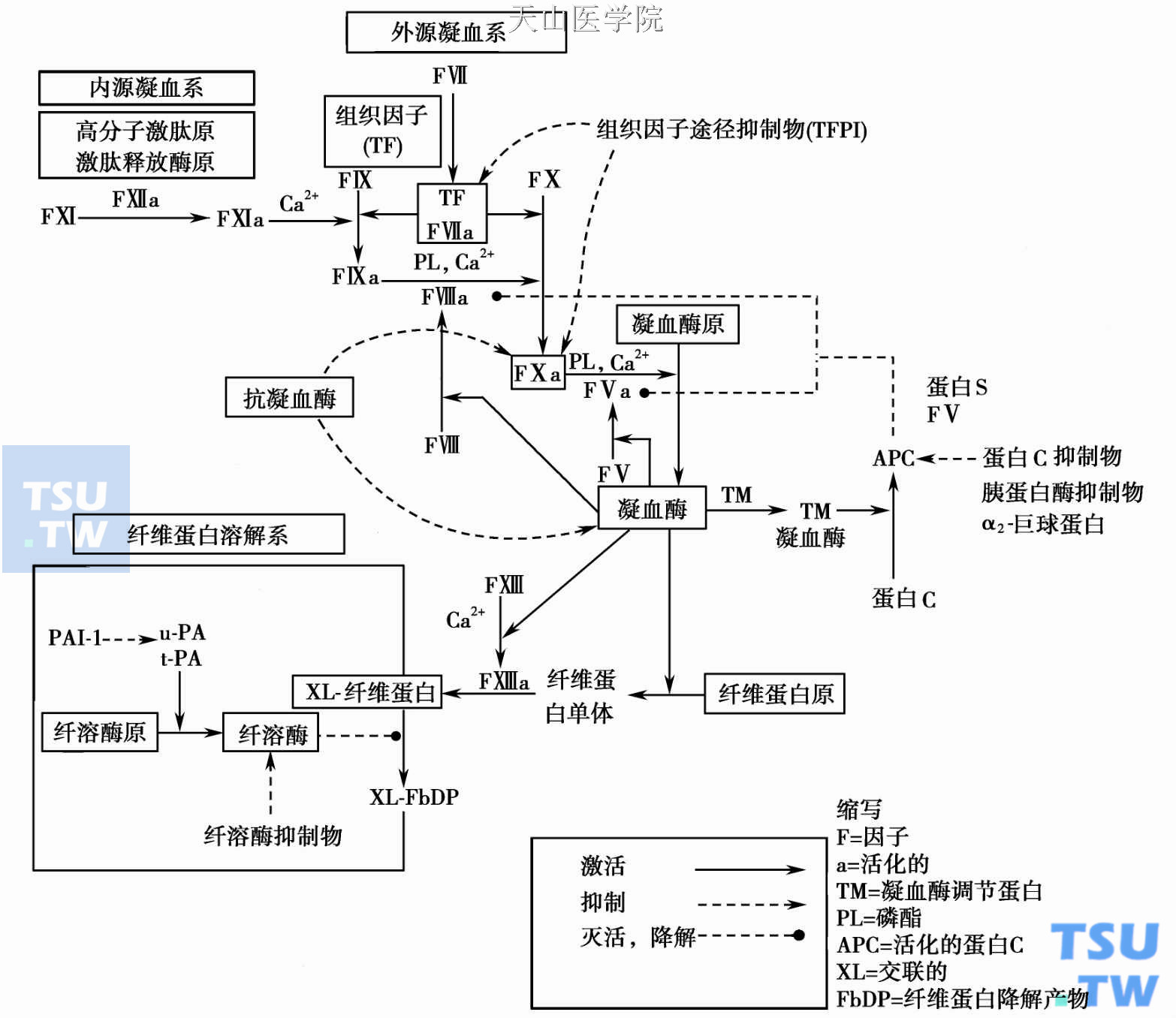
许多血浆蛋白参与抑制凝血、纤维蛋白溶解(简称纤溶)和激肽生成过程中所产生的丝氨酸蛋白酶。这些抑制物结构相似,作用机制(陷阱式)相似(见本章第二节抗凝血酶Ⅲ-肝素的作用机制),同属于丝氨酸蛋白酶抑制物超家族(Serine protease inhibitor总称Serpins),包括ATⅢ(曾用名肝素辅因子- 1)、肝素辅因子Ⅱ(HCⅡ)、α2巨球蛋白、α1抗胰蛋白酶、TFPI、PC抑制物(PCI)、α2抗纤溶酶、纤溶酶原激活抑制物(PAI- 1)和C1抑制物等。其共同点为:反应部位(bait site)含精氨酸、与底物形成1:1化学当量计酶-抑制物复合物、抑制作用完成后复合物分离、被肝清除、与蛋白多糖的戊聚糖(pentasaccharide)组分结合抑制可加速。
生化及先天缺乏者的临床资料分析结果显示:ATⅢ、PC、TFPI、α2抗纤溶酶及PAI- 1为止血功能的主要调控者;α1抗胰蛋白酶和C1抑制物则主要拮抗白细胞衍生介质、补体或激肽生成中的丝氨酸蛋白酶,而对凝血相关的丝氨酸蛋白酶的调控较为不重要。
肝素辅因子Ⅱ(HCⅡ)Mr 65 000,正常血浆浓度90μg/ml。反应部位含蛋氨酸- X键,故其初级氨基酸结构与ATⅢ明显不同。拮抗丝氨酸蛋白酶的特异性在于只能中和凝血酶。HCⅡ结合肝素的亲和力较ATⅢ结合肝素的亲和力为弱,但在肝素饱和浓度(高浓度)下HCⅡ中和凝血酶速率与ATⅢ的中和速率相接近。硫酸皮素是血管壁存在的另一黏多糖,可替代肝素使HCⅡ对凝血酶的中和速率加速1000倍。肝素临床用作抗凝剂时,主要依赖分子中1/3与ATⅢ高亲和力的组分,而HCⅡ仅起微弱的作用。
PAI- 1正常血浆水平极低,生理作用主要是抑制组织型纤溶酶原激活物(tissue plasminogen activator,tPA)和尿激酶(urokinase,UK),因此能阻止纤溶机制活化。其主要生理作用与大多血浆丝氨酸蛋白酶抑制物作用相反,通过抑制纤溶而助长凝血。PAI- 1也能抑制其他凝血系的蛋白酶如纤溶酶、活化蛋白C(activated protein C,APC)和凝血酶。PAI-1的初级结构,尤其在肝素结合区和活化部位,与ATⅢ极相似。玻璃连接蛋白(vitronectin,Vn)和肝素能作为PAI- 1辅因子,抑制凝血酶。
凝血瀑布反应的启动及调节
α2巨球蛋白为血浆二聚体蛋白,由两个Mr 360 000相同半分子组成,以非共价键结合。每半分子由两个相同亚单位Mr 180 000,以二硫键结合。α2巨球蛋白与底物组成1:1或1:2化学当量计酶-抑制物复合物,使陷入的酶失去大部分活性。但该复合物却能保护酶不受能完全灭活酶功能的其他循环抑制物的作用。酶-α2巨球蛋白复合物在15~30分钟内被网状内皮系清除。故α2巨球蛋白虽能抑制许多丝氨酸蛋白酶,包括凝血酶、FⅩa、纤溶酶、激肽释放酶、硬性蛋白酶、胶原酶和组织蛋白酶G,但其抑制速率中度,较其他抑制物为慢。
