1905年Morawitz的实验资料显示去纤维蛋白原血症患者血清中加入的凝血酶会逐渐失去活性,推测血液中存在抗凝血酶。Mclean(1916)从肝脏中提取到肝素之后,发现肝素必须与血浆组分同时存在才有抗凝效果,故认为血浆中存在着肝素辅因子。20世纪50年代的动力学实验表明血浆抗凝血酶Ⅲ(antithrombinⅢ,ATⅢ)活性与血浆肝素辅因子活性直接相关。继Abildgaard(1968)分离到α2巨球蛋白之后,Rosenber和Damus获得大量纯化ATⅢ,并证实分离所得的人ATⅢ和血浆肝素辅因子实为同一分子。
直至1963年1例病人被报道血浆中AT测定值低下,ATⅢ的重要性才进一步清楚。不久,Egebeg(1965)报道一个AT缺乏的家族内许多成员患有静脉血栓。目前已知ATⅢ是一种单链糖蛋白,与凝血酶、因子Ⅹa、纤溶酶等丝氨酸蛋白酶形成复合物而使酶失活。ATⅢ是一种重要的生理抗凝物(下图)。肝素发挥抗凝作用的辅因子除ATⅢ、HCⅡ外,还包括PCI。ATⅢ占肝素依赖性抑制辅因子的80%。
ATⅢ的主要功能区位置示意图
抗凝血酶Ⅲ的结构和作用机制
抗凝血酶Ⅲ基因结构
人类ATⅢ编码基因位于1号染色体长臂(1q23- 25),全长15kb,含7个外显子,在单倍体基因组中为单拷贝。启动子区不具备TATA元件,但5'旁测序列区含8bp的增强子,相似于Jk- Ck鼠或人IgGk链基因。调控元件对ATⅢ和IgGκ轻链的有效合成和组织特异性十分重要。ATⅢ基因转录始于5'上游距ATG翻译起始点72bp处;3'端基因距终末编码49bp处含多A(AATAAA)序列。裂解/polyadenylation位于多A序列下游24bp处。mRNA中96碱基用于编码信号肽,1296碱基编码多肽链,以及3'端含175碱基的非翻译区包含多A序列。第1内含子中含有二个最初转录产物的拼接部位,使产生两种分子:N端带信号肽的ATⅢ分子或是C端删减的多肽分子。后者留于细胞内不被分泌,其功能尚不明确。
抗凝血酶Ⅲ功能区及对维生素K依赖性蛋白酶的抑制作用
人类ATⅢ主要由肝细胞、血管内皮细胞、肺、脾、肠、心等细胞合成,是一种α2球蛋白性抑制物,Mr 58 000。正常血浆AT Ⅲ水平约140μg/ml。
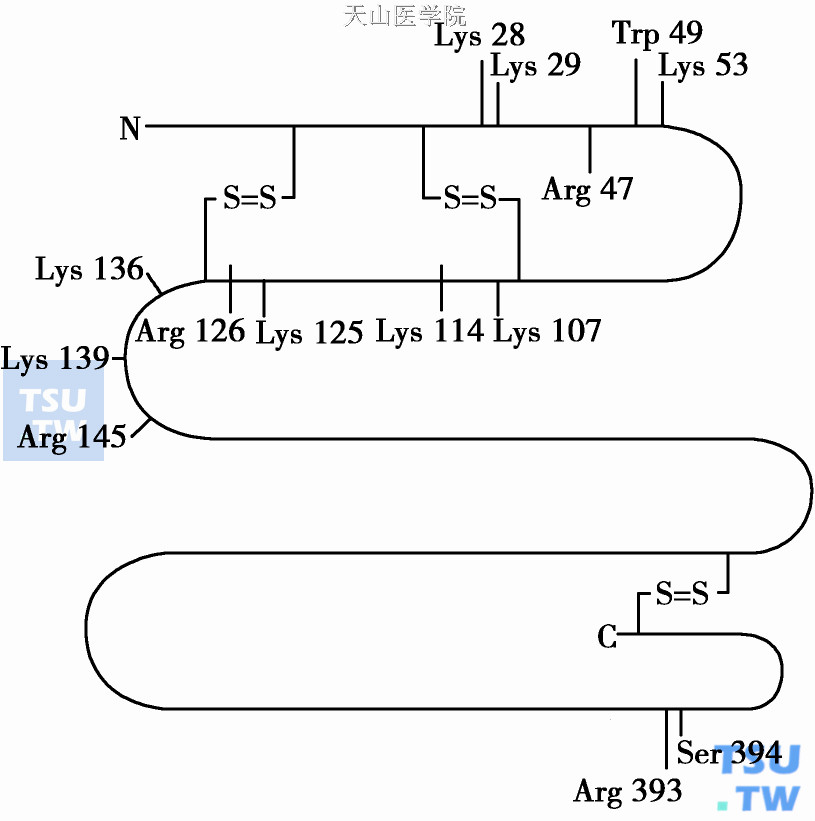
一、抗凝血酶Ⅲ反应部位及肝素结合部位
AT Ⅲ反应部位Arg393- Ser394接近羟基端。反应部位赖氨酸能和凝血酶等酶(E)活化中心丝氨酸结合成四面体中间物,并形成1:1当量计共价键结合的抑制复合物,即E+AT Ⅲ→E•AT Ⅲ。AT Ⅲ的抑制机制根据三维结构提示,其四面体中间产物为酶的陷阱,并非裂解底物(E)的活化中心键。
凝血酶在此过程中结构未改变。凝血酶- AT Ⅲ抑制复合物易被肝脏受体清除,T1/2少于15分钟。病理情况下复合物被大量清除可继发血浆AT Ⅲ水平降低。
AT Ⅲ有两个主要的肝素结合区。Ⅰ区位于氨基酸28~53,包括AT Ⅲ28、29、53位上的赖氨酸,都能和肝素结合。Ⅱ区位于氨基酸107~156,包括AT Ⅲ107、114、125、126、139上的赖氨酸和129、145位上的精氨酸。Ⅰ、Ⅱ区是呈直线排列的正电荷氨基酸使ATⅢ能和肝素的硫酸基团以电子键形成暂时性复合物,使肝素能成为凝血酶的快速抗凝剂。血浆中存在少量Asn135非糖基化的ATⅢ库,这一氨基酸位于肝素结合区并与肝素亲和力增强。
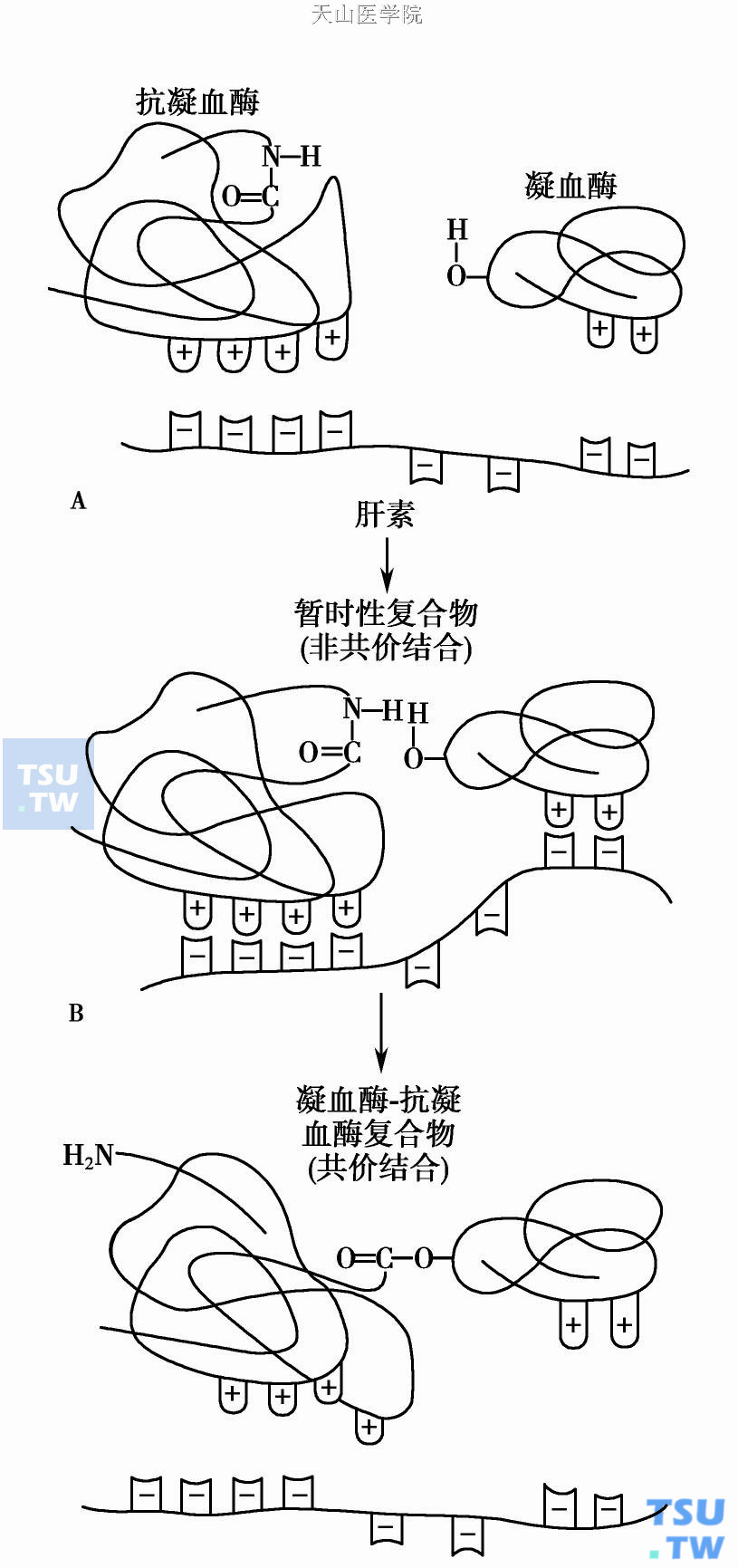
肝素- ATⅢ的作用机制
二、肝素催化并迫使凝血酶- ATⅢ复合物形成并迅速从蛋白聚糖脱离
凝血酶- ATⅢ(T- AT)抑制复合物在无肝素时形成的速率很慢。ATⅢ必需有肝素参与才能完成其有效的最佳反应速率。这是因为肝素戊糖序列键中几个硫酸基团与ATⅢ以电子键形成暂时性复合物。复合物的形成能使ATⅢ构形改变(上图),使丝氨酸蛋白酶更易陷入,因而不能发挥其酶的活性,并被灭活。抑制复合物中共价键的形成使ATⅢ对肝素亲和力减弱,肝素被释放后再利用。凝血过程中许多止血酶如Ⅸa、Ⅹa、Ⅺa和Ⅻa都能被ATⅢ灭活,灭活方式和ATⅢ陷阱机制相似。实验表明肝素与ATⅢ形成酶抑制复合物中的结合力要比黏多糖与ATⅢ的结合力弱100~1000倍。因此,内皮表面的肝素能再游离、反复参与蛋白酶的抑制圈子。
三、抗凝应答中ATⅢ的多糖依赖性加速,对不同介质的影响
ATⅢ-肝素复合物可抑制所有的维生素K依赖性凝血因子的活性,但是主要抑制FⅡa、FⅩa、FⅨa,而FⅦa为例外。FⅦa或蛋白C(PC)与ATⅢ-肝素复合物的反应十分缓慢。FⅦa一旦与组织因子结合,在Ca2+存在下,ATⅢ抑制此酶的速率即增强30倍,高分子激肽原(HMWK)能明显加速饱和ATⅢ-肝素复合物对FⅪa的中和速率。FⅫa则主要被C1抑制物所中和。某些实验表明为获得灭活凝血酶(FⅡa)及FⅨa、FⅪa的效果,肝素链必须有16个以上的单糖(较大的寡糖)、需同时与ATⅢ以及凝血酶等酶结合并形成三元复合物。
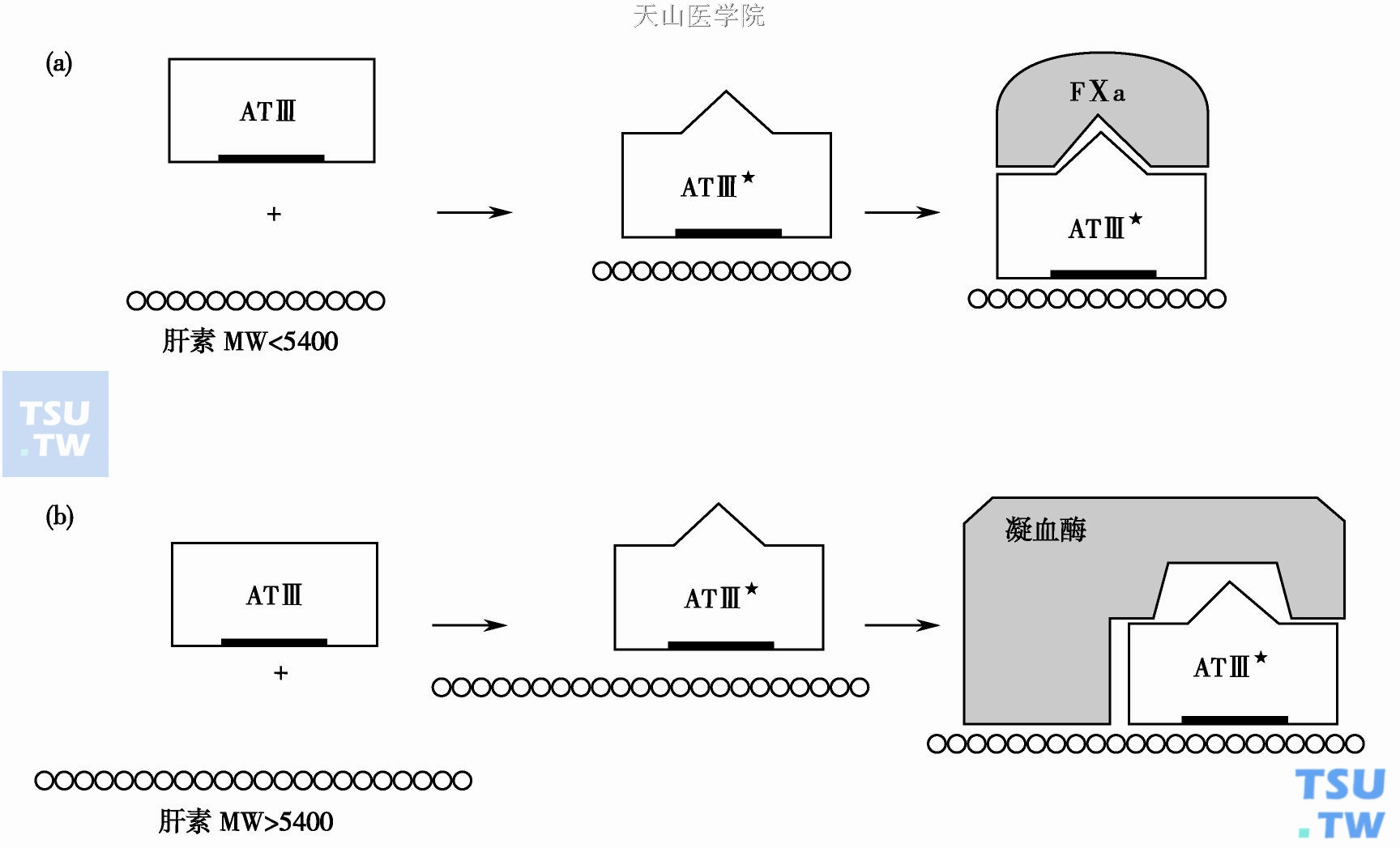
肝素- ATⅢ复合物对FⅡa或FⅩa的灭活作用
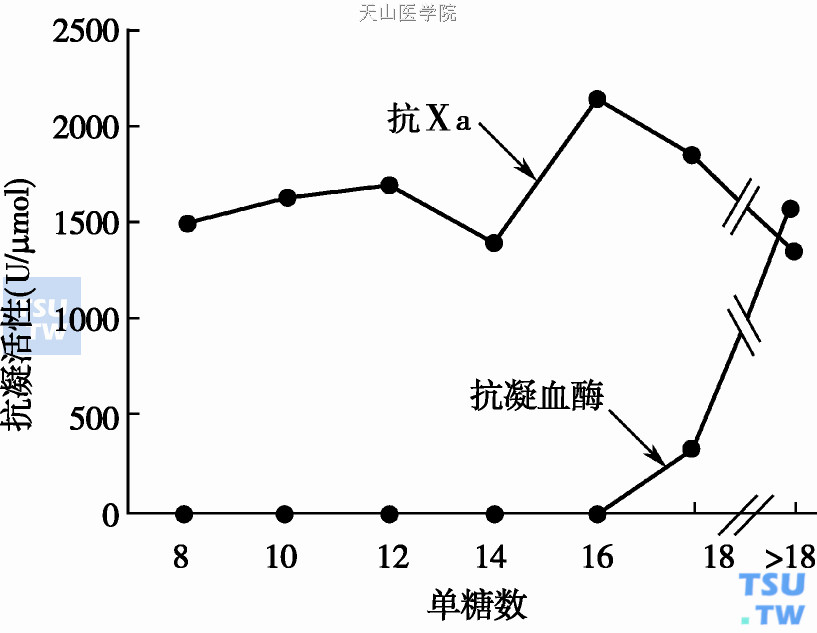
肝素链的糖苷数与其抗FⅩa、抗FⅡa的关系
少于6个单糖的肝素不具备抗Ⅱa活性,亦不影响活化部分凝血活酶时间(active partial thromboplastin time,APTT)。为灭活FⅩa和FⅫa,肝素分子链只需和ATⅢ单向结合即可发生抑制作用。至于肝素是否与FⅩa或FⅫa结合对抑制过程并不起作用。8个以上单糖的肝素链即可加速ATⅢ- FⅩa的相互反应(上图),但不能催化中和其他的止血酶。血栓局部从活化血小板释出的血小板第4因子(PF4)能使肝素失去催化灭活Ⅱa的活性,但对灭活Ⅹa的影响较小。由于各实验中采用的肝素商品剂型不同、链长短不同,因此肝素与ATⅢ多位点结合的强度不同,不同肝素制剂对肝素- ATⅢ介质中和速率的报道结果互有差异。肝素单糖序列中特殊的群体,糖结构组合在增加ATⅢ-Ⅱa、ATⅢ-Ⅹa中和速率反应中的作用尚在进一步研究中。与ATⅢ低亲和力的肝素(LAH)组成链的功能尚不明了。有报道认为LAH能影响血小板功能,导致血小板功能障碍。
肝素和硫酸类肝素蛋白多糖的化学合成
肝素分子结构与功能的不均一性
肝素是一种高度硫酸化的氨基聚糖(或称氨基多糖,glycosaminoglycan),由长短不一的多糖链(寡糖)组成的混合物。由氨基己糖(即N-乙酰氨基葡糖或名己糖胺)或其衍生物与糖醛酸构成的二糖单位是肝素分子中的主要重复序列,无ATⅢ催化活性。肝素链中特殊的硫酸化戊糖序列是催化ATⅢ-E复合物形成的必需结构。戊糖序列由N-乙酰氨基葡糖(6- OSO3)-葡糖醛酸- N硫代氨基葡萄糖(6-OSO3)-艾杜糖酸(2- OSO3)- N硫代氨基葡糖(6-OSO3)组成。商品肝素制剂中仅少于1/3的肝素分子具有与ATⅢ呈高亲和力的戊糖序列。
有报道认为由特殊的四糖序列组成的八糖,无硫酸基团的艾杜糖- N乙酰葡糖胺(6- OSO3)-葡糖醛酸- N硫代/O硫代葡糖胺,位于还原末端与肝素加速ATⅢ- FⅩa反应有关。人类血管腔内皮表面存在的大量类肝素,仅少于10%的天然类肝素链有抗凝活性。通过各种化学和物理分级法可制备得到不同分子量的肝素片段及组分,制备出各种生物利用度高的新型低分子肝素(low molecule weight heparin,LMWH)制剂。不少研究者正在寻找一些抗凝活性很弱的类肝素物质,试图通过工艺改造、制备出具有某种特殊用途的类肝素。
类肝素硫酸多糖蛋白
Meyez(1938)首先提出把来源于动物组织并含有氨基己糖的多糖称为黏多糖(旧名:黏蛋白)。后来发现黏多糖含有糖醛酸及硫酸基团,且具有酸性,故称之为酸性黏多糖(acidic mucopolysaccharide),现在命名为氨基(多)聚糖(glycosaminoglycan),即含糖醛酸和氨基糖残基的多糖,为一种杂多糖,包括肝素、类肝素、硫酸皮素、透明质酸、硫酸软骨素、硫酸角质等。在体内,上述各种氨基聚糖的长链连接在一核心蛋白上,因其糖含量远比蛋白质含量为多,故将此类糖蛋白称为蛋白多(聚)糖(proteoglycan)。国外将肝素称为肝素硫酸蛋白多糖(heparin sulfate proteoglycan),类肝素称为类肝素硫酸蛋白多糖(heparan sulfate proteoglycan,HSPG),以资区别。
蛋白多糖的化学合成
蛋白多糖是一种内皮细胞相关蛋白,具有核心蛋白及肝素侧链。侧链中的糖苷(单糖以糖苷键相连)带有ATⅢ识别序列。近年来认为内皮下的肥大细胞(mast cells)颗粒内含肝素。肥大细胞和血管内皮细胞是肝素的主要合成部位。已知从培养的内皮细胞、牛脑微血管、视网膜微血管中均可获得与商品肝素相似的肝素硫酸蛋白多糖。类肝素硫酸蛋白多糖(HSPG)由血管内皮合成。已从大鼠微血管内皮细胞中分离获得并克隆得其cDNA。大鼠主动脉电镜可见到内皮细胞相关的类肝素的组织学结构。血管腔内膜层含低浓度的HSPG,而腔表面存在着大量蛋白多糖库。但经输注的ATⅢ仅少量(<1%)经主动脉与腔壁内皮细胞相反应,提示内皮所产生的HSPG最初在细胞膜内,之后经血浆腔内蛋白酶作用而释出的HSPG主要累积在血管壁的基底膜。HSPG分布于多种器官如肝、心、肾、肠的肥大细胞表面。自大鼠微血管内皮细胞分离并获得cDNA克隆表明,仅5%HSPG能与ATⅢ结合。有活性的HSPG含202氨基酸残基,过去称之为ryudocan;无ATⅢ结合活性的含313氨基酸,过去称之为syndecam。两者有十分相似的透膜区和细胞内功能区,但两者的细胞外区明显不同。这一多基因家族组成的整合膜蛋白,带有内皮合成的有抗凝活性的肝素侧链。
多糖的合成起始于糖的蛋白连接部位与多肽的丝甘氨酸(serglycin)相接触,组成糖-蛋白连接序列。之后,聚合物的多糖链经酶的作用被不均一地与糖醛酸或N乙酰葡糖(己糖胺)接触,并交替组装,产生的高度不规则多糖链再经化学修饰,使大多数葡糖醛酸异构成艾杜糖酸(酯),以及大多数糖胺的乙酰基被N硫代。此二糖序列是肝素分子中的主要的重复结构,但是无ATⅢ催化活性。仅小部分糖苷链中的葡糖醛酸C2位和己糖胺C3及C6位发生酯硫酸化(分别以2- OSO3,6-OSO3,3,6- OSO3表示),使Mr 30 000~100 000的多糖分子中形成具有催化活性的戊糖序列。
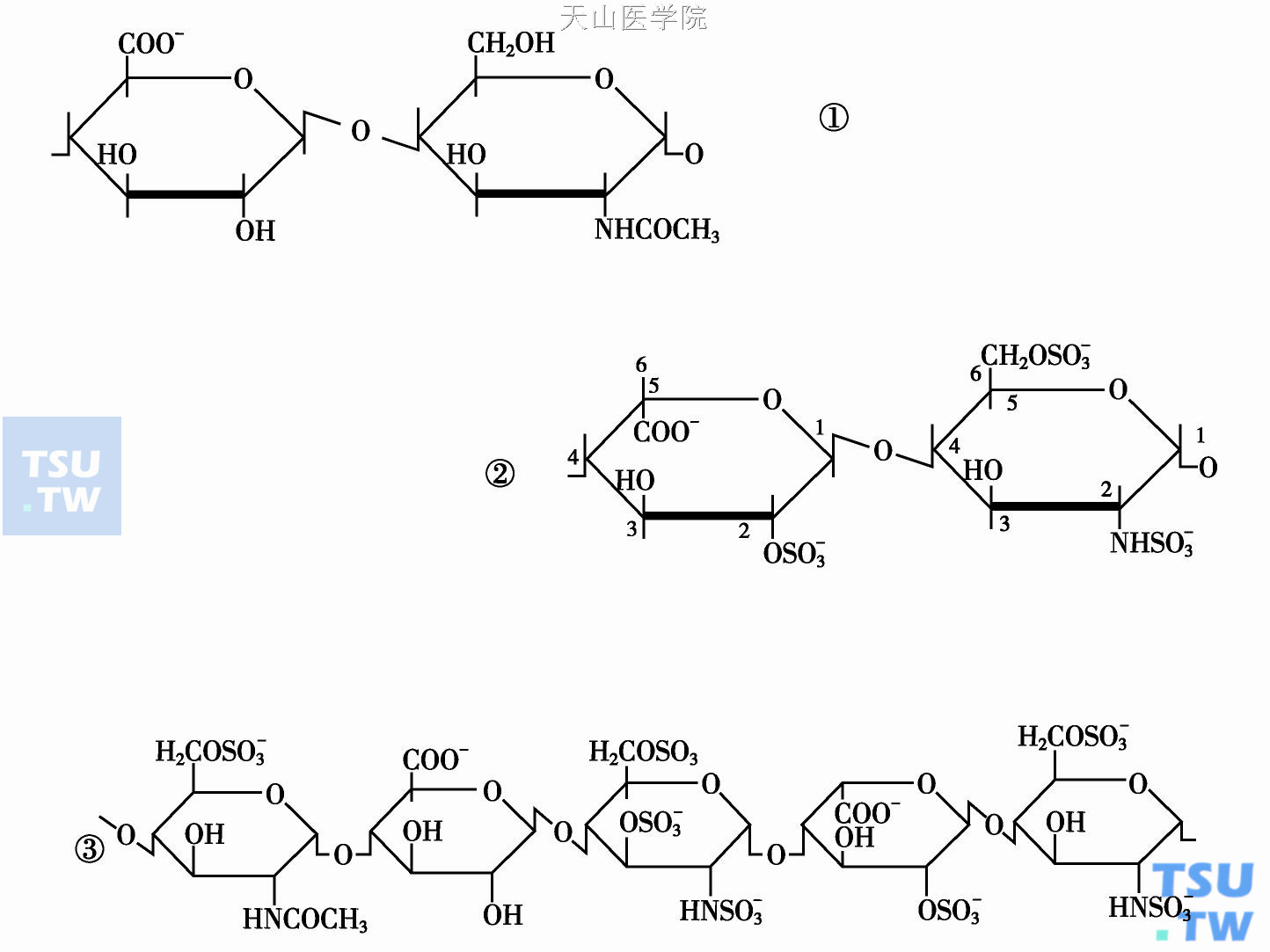
肝素链的基本重复结构及戊糖序列
①糖醛酸-己糖胺;②艾杜糖酸(酯)- N硫代己糖胺;③戊糖序列
抗凝血酶Ⅲ-肝素的生理作用
以凝血酶和ATⅢ做大鼠后腿灌注的实验证实ATⅢ的抗凝活性与血管内皮密切相关。血管床能加速凝血酶- ATⅢ复合物的形成,较此一种组分在溶液中的反应速率增速10~20倍。若经后腿血管灌注肝素酶先于凝血酶,则灌注液中酶-抑制复合物水平可测不到。进一步的实验表明凝血酶- ATⅢ复合物的加速形成主要是由于血管腔表面内皮细胞生成HSPG的作用。肥大细胞基因缺陷的小鼠,其内皮细胞HSPG仍能有加速ATⅢ的完全反应。因此,实验提示肥大细胞生成的肝素在血管抗凝活性中起的作用很少。推测生理情况下只有内皮生成的血管腔的小部分HSPG参与调节血液-血管中ATⅢ的反应;然而,内皮广泛受损时大量血管腔面累积的HSPG库将成为凝血瀑布反应的调节者。在受损区周围环境中,HSPG加强血浆中ATⅢ对凝血酶的中和作用。
