肝素,又名普通肝素钠、标准肝素、未分组肝素钠、Heparin、Regular heparin[RH]、Standard heparin [SH]、unfractionated sodium heparin[UFH]。肝素是一种带阴离子的氨基葡聚糖硫酸酯,是一种不均一物质,平均分子量12 000,存在于许多主细胞的表面。商品肝素钠自猪肠或牛肺中提取。
肝素由长短不同的、不分支的低糖链组成。由D-葡糖胺和D-葡糖醛酸(或L-艾杜糖醛酸)以糖苷链相连组成肝素链基本的二糖重复序列(图141-7)。这种重复的二糖序列中发生多处替代。包括:R1:H或- OSO3基团,R2:SO3或- COCH3基团,使少数二糖组成戊糖序列。
肝素分子量3~30kDa(大多数链为13~15kDa)。虽然多肽链长短不同,肝素链中只1/3多肽链含能与ATⅢ结合的戊糖结构。戊糖结构在肝素链中随机分布,是肝素的抗凝和抗栓的功能单位。
作用机制
多种凝血因子云集结合在血小板或组织磷脂表面,因此凝血瀑布反应中最终生成的凝血酶自磷脂表面的微环境中释出。这一唯一游离的促凝酶,能被ATⅢ肝素复合物优先地中和,而其他的活性凝血因子(FⅩa和FⅨa)与磷脂结合着,只轻度被抑制。
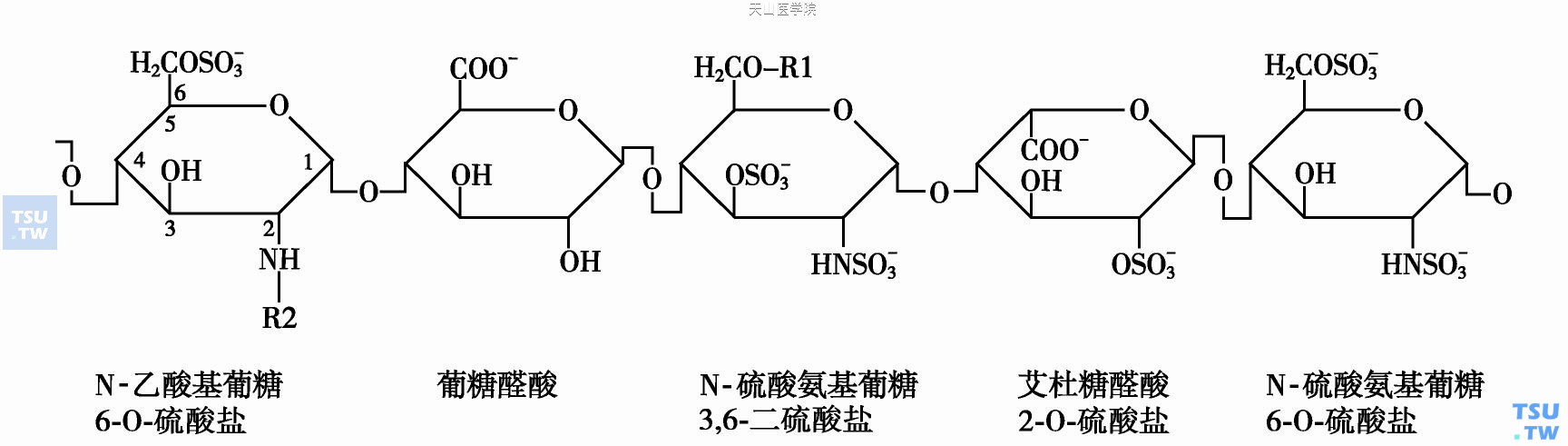
肝素的结构
凝血酶能活化血小板、辅因子(FⅤ和FⅧ),参与凝血酶的自我生成(正反馈)机制。故凝血酶抑制剂是一种有效的抗凝药,能阻断凝血的正反馈机制而阻断凝血过程。活化血小板所生成的PF4能中和肝素,因此肝素的抗凝活性在活化血小板表面被减弱。肝素在内皮细胞表面能与ATⅢ结合,成为一种依赖ATⅢ的凝血酶抑制剂。
低剂量肝素的抗凝作用主要由于能中和FⅩa,从而阻止凝血酶原转化成凝血酶。低剂量肝素时凝血酶的中和能力低,因此低剂量肝素只对凝血酶未完全生成前,通过抑制凝血酶的生成,有低度抗栓功能。主要适于血液淤滞情况下抑制凝血酶生成,作为预防性应用。足量肝素治疗能中和凝血酶(Ⅱa)从而阻止纤维蛋白原转化成纤维蛋白。全量肝素并能通过抑制凝血起始阶段生成的凝血酶而抑制纤维蛋白稳定因子FXⅢ的活化,阻止稳定的纤维蛋白凝块的形成;抑制Ⅱa对血小板聚集的影响、抑制FⅤ和FⅧ的活化而起有效抗凝作用。肝素无溶栓作用,不能溶解已形成的血块。肝素与口服抗凝剂不同点是抗凝作用迅速,体内外都有抗凝活性。
其他作用:肝素在体内有降脂作用,主要是由于它刺激释放并活化脂蛋白酯酶而使乳糜颗粒的三酰甘油水解成脂肪酸和甘油,使乳糜颗粒脂质血症者血浆变清。降脂作用所需的肝素剂量要低于抗凝量,但有报道使用肝素一段时期后引起高脂血症反跳。
体内过程
口服不吸收,必须注射给药。静脉注射后80%肝素与血浆蛋白(低密度脂蛋白、球蛋白、纤维蛋白原、纤维连接蛋白、外连接蛋白、PF4、vWF、Histidine rich glycoprotein)相结合,部分被血细胞膜所吸附,并很快进入组织。故肝素血浆水平及疗效有很大的个体差异。肝素生物半衰期及活性除剂量因素外,主要与血浆中富组氨酸糖蛋白(HRG)和PF4有关。故肝素的抗栓剂量宜根据APTT时间而调整。肝素不通过胎盘,不分泌到乳汁,不被透析出。正常人血浆肝素半衰期约1~2小时,并随剂量增加而延长。清除方式主要是与血浆蛋白、细胞膜结合,部分肝素经肝网状内皮系代谢成一种去硫酸的肝素,部分肝素以原形经肾排出。肝病患者肝素半衰期降低,但肝硬化者则延长。肾炎或严重肾功能不全者肝素不需减量。肝素可以皮下注射给药,皮下注射后2~4小时达血药活性高峰,但生物利用度只为静脉注射量的30%。因此肝素皮下给药时需增加剂量以达到有效的血浆肝素的活性水平。
临床应用
主要用于血栓栓塞性疾病的防治,尤其适合于需快速抗凝者。如:
- 急慢性静脉血栓或无明显血流动力学改变的肺栓塞(PE),肝素能阻止栓子延伸而争取时机,使机体自发性溶栓。
- 心房纤颤伴栓塞的防治。
- 早期弥散性血管内凝血(DIC)治疗。
- 外周动脉血栓形成或心肌梗死的防治。
- 其他体外抗凝:如心血管手术、体外循环、血液透析、心导管检查,也可用于输血或血液标本的制备。目前肝素应用的主要适应证是深静脉血栓形成(DVT)、PE及血栓高危患者的预防。
用法及剂量
治疗目的不同,使用方法可不同。
(1)深静脉血栓(DVT)及肺栓塞(PE)
1)治疗性应用:a.全剂量肝素持续静脉输注:近端DVT或PE 每12小时按每公斤体重100U静脉泵入,或在溶栓治疗后,或无溶栓指征的患者应考虑持续肝素输注,并逐渐过渡到口服抗凝治疗。初次肝素剂量75U/kg静脉注射(儿童50U/kg),继以100U/(kg•12h)或10~25U/(kg•h)维持。输注4小时后测试活化部分凝血活酶生成时间(APTT)或白陶土部分凝血活酶生成时间(KPTT),控制在1. 5~2倍基础值,或APTT 80~100秒较为适宜。疗程7~10天。抗凝适宜的血浆肝素水平为0. 3~0. 6U/ml。部分血栓病患者因血栓局部PF4或血浆中HRG增高而表现为肝素耐药。
b.监控下肝素皮下注射:首剂5000U(>60kg体重)静脉注射,同时10 000~20 000U皮下注射,之后8000~10 000U每8小时1次皮下或15 000~20 000U每12小时1次皮下注射。初72小时在每次给药后4小时测APTT,并控制在1. 5倍基础值。疗程7~10天,对华法林有反指征的患者可采用本法使APTT延长1. 5倍,应用3个月,或6周后改用低剂量肝素皮下注射。
c.间断静脉注射:体重60kg以上者,首剂以肝素钠10 000U静脉注射,然后予5000~10 000U每4~6小时静脉注射。儿童首剂以100U/kg静脉注射,维持剂量为50~100U/kg每4小时静脉注射。再次给药前半小时的PTT控制在基础值的1. 5~2倍。本法肝素的每日需要量较持续输注高50%,故出血并发症高。
2)预防用药:采用固定、低剂量肝素皮下注射,适用于胸腹大手术、全髋置换术、前列腺手术、心血管手术者,以预防术后并发DVT或PE,尤对年龄大于40岁者。本方法也适用于已有DVT者在全量肝素治疗之后,对口服抗凝剂有禁忌证者,可作为随访期间预防DVT复发的治疗。每8~12小时肝素钠皮下注射5000U,应用6周至3个月。
(2)二尖瓣瓣膜病或心房纤颤伴栓塞:全量肝素治疗后终身口服抗凝维持,可降低本病的血栓并发症。
(3)弥散性血管内凝血(DIC):主要治疗原发病。对原发病不易去除或控制者,有人主张在DIC早期用肝素治疗,但死亡率统计能否减低尚未肯定。DIC患者表现为暴发性紫癜或明显血栓症,是采用肝素的强指征。
(4)急性心肌梗死:为预防溶栓后早期再栓塞,主张采用监控下的抗凝或血小板抑制剂,应在溶栓后4~12小时给予首剂肝素,应用7天,可降低早期栓塞发生及死亡率。
(5)人工肾:透析前肝素钠3125U静脉注射,维持量500~800U/h。
不良反应
(1)过敏反应:偶见发热、荨麻疹、哮喘、结膜炎、鼻炎、头痛、恶心、呕吐。过敏性血管反应或休克少见。肝素大剂量(>1000U/d,3个月)长期应用可致脱发、骨质疏松并发自发性骨折。
(2)出血:为主要副作用,发生率为15%~20%。以静脉推注给药。年龄>60岁、女性患者多见。用药前及肝素化期间凝血象监测可降低出血并发症。
(3)血小板减少症:肝素能诱发可逆性急性血小板减少症。其中部分患者在应用肝素的早期即可出现血小板的轻度下降,可自行恢复,不伴有出血或血栓倾向,为非免疫因素介导。而在部分患者在应用肝素第5~14天后可出现免疫因素介导的血小板计数的显著下降(通常>50%但不低于20×109/L),并伴有血栓倾向或肝素注射部位皮肤坏死、急性过敏反应等特殊临床表现。这种在肝素使用后由免疫机制介导的血小板减少症被称为肝素诱导血小板减少症(heparin induced thrombocytopenia,HIT)。目前认为HIT的发生机制是患者体内产生了肝素-血小板第4因子复合物的IgG型抗体,该抗体与肝素-血小板第4因子复合物相结合形成免疫复合物。这种循环中的免疫复合物可进一步与血小板表面的Fc受体相结合,导致血小板的活化和凝血系统的激活。不同来源的肝素制剂发生HIT的几率不一,牛肺制品较猪肠黏膜制品发生率为高。因此肝素抗凝期间应常规监测血小板计数。若发现血小板数低于10 万/ml,应停用肝素。在高度怀疑或确诊HIT的患者,除常规停用肝素外应考虑采用替代药物进行抗凝治疗。
(4)骨质疏松:长时间、大剂量肝素使用可导致骨质疏松,特别是在妊娠期妇女。
注意事项
(1)局部作用:肌内注射易引起局部血肿故禁用。少数患者皮下注射发生注射部位瘙痒及灼热感,应做深部皮下(脂肪层)注射,可选择腹壁脐以下脂肪层,脐周2~3cm以内为禁区。
(2)肝酶诱导剂:肝素为酶诱导剂,常见肝素效应包括ALT(SGPT)、AST(SGOT)、LDH升高,但胆红素及碱性磷酸酶正常,以静脉给药者发生率高。因此,在使用肝素情况下,对与酶水平变化有关的疾病如肝炎、PE、急性心肌梗死等病的诊断需慎重。
(3)药物互相反应:肝素带强酸性,遇碱性药物则失去抗凝性能。阿司匹林、非类固醇类消炎药、右旋糖酐、双嘧达莫,有增加出血并发症的危险。合并应用应小心监测。
(4)有出血素质、严重肝肾功能不全、胆囊疾病、溃疡病、溃疡性结肠炎、恶性高血压、内脏肿瘤、脑出血史、血友病、亚急性细菌性心内膜炎、围产期妇女、近期外伤、眼、脑及脊柱手术、胃肠持续导管引流、腰椎留置导管者等均禁用肝素。
