接触激活的酶原蛋白
凝血因子Ⅻ
凝血因子Ⅻ(FⅫ)基因位于第5号染色体(5q33- qter),全长11. 9kb,含14个外显子,13个内含子(下图a)。外显子分别编码信号肽(外显子1)、前导肽(外显子2)结构与其他蛋白的前肽不同。Ⅱ型纤维连接蛋白区(外显子3、4)、EGF区(外显子5、7)、纤维连接区(fibronectin finger domain、外显子6)。1个Kringle区(外显子8、9)、胰蛋白酶样催化区(外显子10- 14)。催化区结构与尿激酶(UK)、tPA和FⅪ相似。FⅫmRNA 24kb长,成熟蛋白质为596个氨基酸组成的单链糖蛋白。
FⅫ又名Hageman因子,是内源性凝血系中首先被接触活化的因子。FⅫa能使FⅪ活化为FⅪa,在凝血过程中的接触反应期中被发现。这一因子不参与生理止血,缺乏者不发生出血症状。但在病理血栓形成过程中,FⅫ、高分子激肽原(HMWK)、激肽释放酶原参与启动过程。
循环中的FⅫ为单链酶原,分子量80 000的糖蛋白。天门冬酰胺(Asn)230和414与糖基相连,其他糖基化位点包括苏氨酸(Thr)280、286、309、310、318,以及丝氨酸(Ser)287。阳性电荷氨基酸序列组氨酸-赖氨酸-酪氨酸-赖氨酸(His- Lys- Tyr- Lys)介导FⅫ的表面结合特性,尤其是在接触阴性电荷表面时能增强并加速FⅫ的活化。这一序列也可见于激肽酶原。FⅫ血浆水平30μg/ml,血浆半衰期2天。
凝血因子Ⅺ
凝血因子Ⅺ(FⅪ)参与正常止血,参与凝血的正反馈扩增机制,属于内源性凝血系组成。
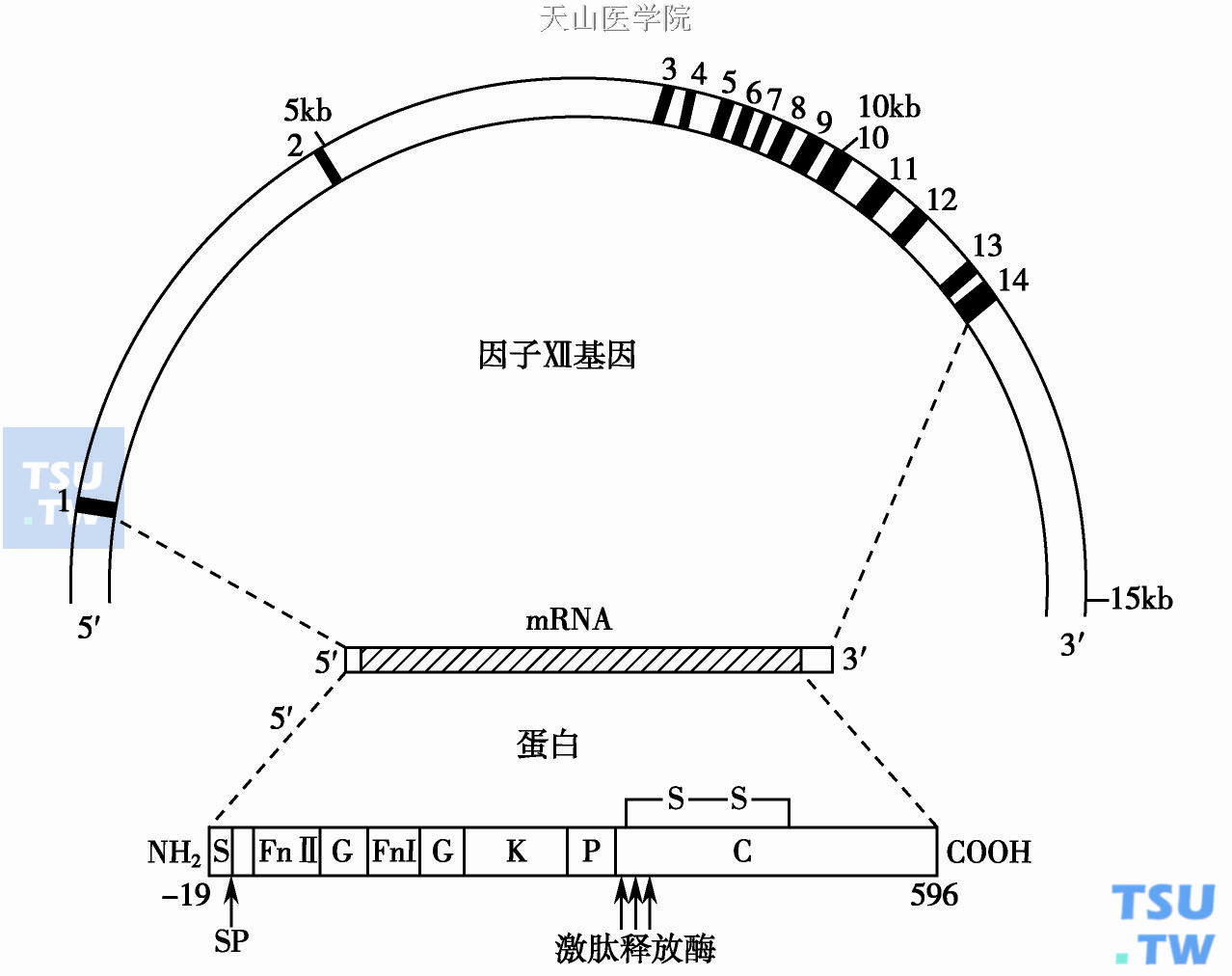
图1a 凝血因子Ⅻ基因和蛋白
FⅪ在肝合成。23kb全长的FⅪ基因位于4号染色体长臂(4q35),mRNA 2. 1kb。基因含15个外显子和14个内含子。外显子分别编码5'非翻译序列(外显子1)、信号肽(外显子2)、4个重复序列(apple)各由2个外显子编码(外显子3~10)、胰蛋白酶样区(外显子12~14)。FⅪ前体不含前肽。FⅪ分子量160 000,血浆FⅪ水平30nM(5μg/ml),生物半衰期2. 5~3. 3天。血循环中FⅪ和高分子激肽原(HMWK)以非共价结合。FⅪ是由两条相同多肽链以非共价键和共价键连成的二聚体(图2),这是与其他酶原蛋白不同处。FⅫa激活FⅪ时需在HMWK及阴电荷表面将FⅪ酶原的两条多肽链的精氨酸369-异亮氨酸370键裂解,使一对Ⅺa链上产生两个催化活性部位。α-凝血酶也能使FⅪ裂解,故目前认为FⅪ参与生理凝血的正反馈机制。FⅪa二聚体含2个重链(369个氨基酸)和2个轻链(238个氨基酸),重链和轻链内有3个二硫键相联,另一个二硫键位于重链321位连接两个对称分子的两个重链。酶的活性在重链。
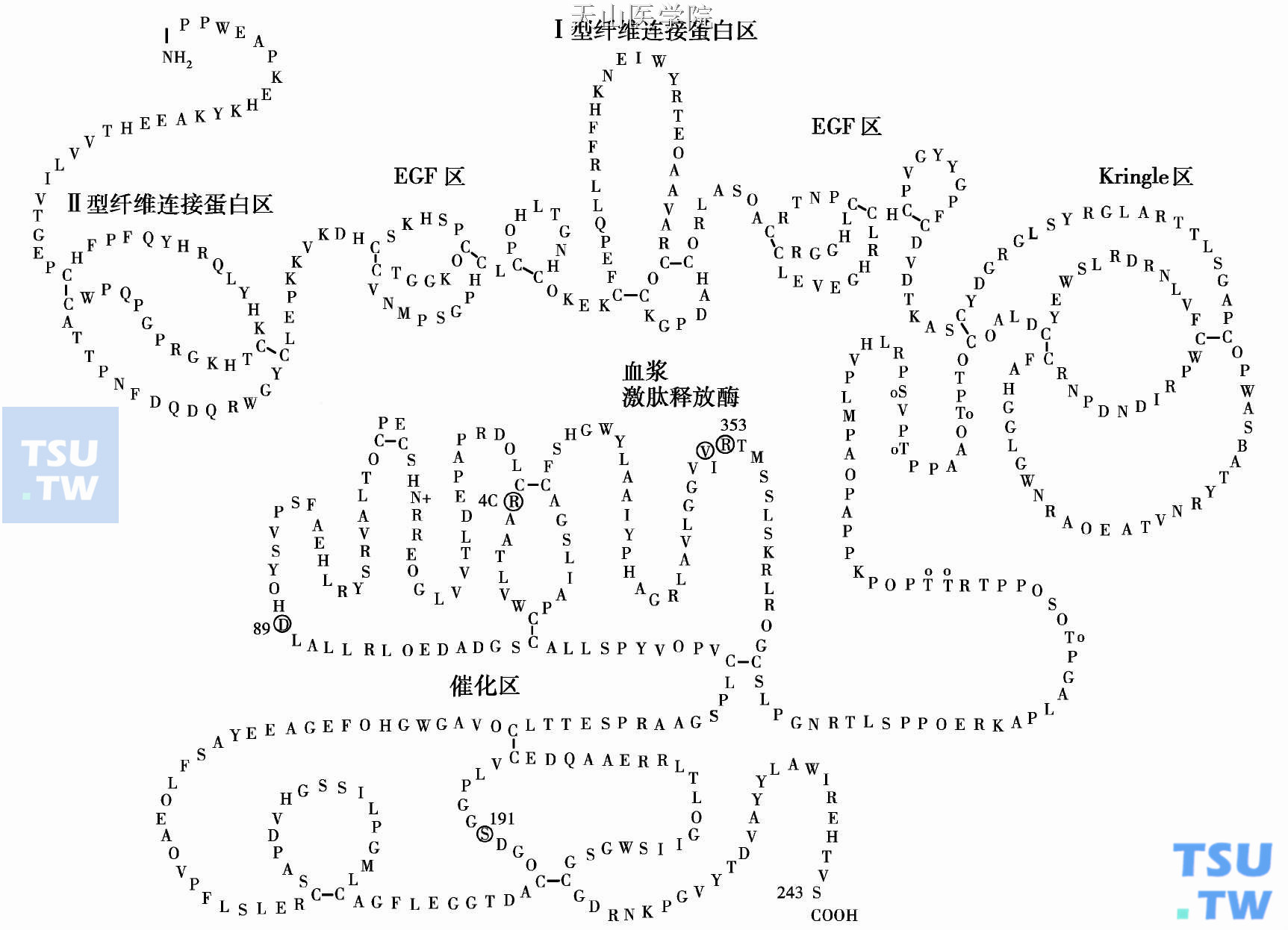
图1b 凝血因子Ⅻ的结构示意图
初级结构分析FⅪ重链尚保留有4个重复序列称apple区(A区),含84个氨基酸(图3);自N端分别为Al、A2、A3、A4重复序列区。A1区中的缬氨酸59-赖氨酸83是HMWK结合部位,A2区丙氨酸317-甘氨酸350是FⅫa的结合部位。A2羧基端含有FⅨ结合位点。血浆中FⅪa主要被C1抑制物、α1蛋白酶抑制物、ATⅢ及α1抗纤溶酶所灭活。
维生素K依赖性酶原蛋白
凝血因子Ⅸ
性联的凝血因子Ⅸ(FⅨ)基因位于X染色体长臂(Xq27. 1),邻近FⅧ基因,全长34kb,含8个外显子。FⅨ基因结构与FⅦ、X、PC高度同源,提示来自同一祖先的相关基因。此基因缺陷产生血友病B (hemophilia B)。FⅨmRNA 2. 8kb长。基因转录受肝特异的顺式活化元件所调控,后者需与肝特异的转录因子NFI- L(CCAAT元件-结合蛋白)结合。结合位点在转录起点上游-99~-76处。EBP结合位点在邻近转录部位。FⅨ具有雄激素启动子元件与Leyden核型有关。
FⅨ分子量56 000,是单链糖蛋白,又曾名Christmas因子,血浆水平90nM(5μg/ml)半衰期1天,可血管内外分布。FⅨ含4个功能区:γ- Gla区、结合区、活化肽区和催化区。成熟蛋白的结合需维生素K使Gla区所含的12个谷氨酸完全羧基化成γ羧基谷氨酸(图4)。FⅨ的完全羧基化的蛋白才能与Ca2+结合以及通过Ca2+与膜丝氨酸磷脂、胆碱磷脂结合而桥联膜磷脂。FⅨ表达与磷脂的特异性结合时涉及依赖Ca2+的二次构型转化。Gla区的γ-谷氨酸有2个Ca2+结合位点,第三个高亲和力的Ca2+结合位点在ECF区,由β羟化的天门冬氨酸64组成。FⅨ含N和O-联结糖基,丝氨酸61通过岩藻糖与四糖O-联结。
FⅨ和FⅨa能与活化血小板结合,但不能与静止血小板结合,结合的机制尚不十分清楚,可能是通过血小板表面受体或由膜磷脂参与。

图2 凝血因子Ⅺ(单体)结构示意图
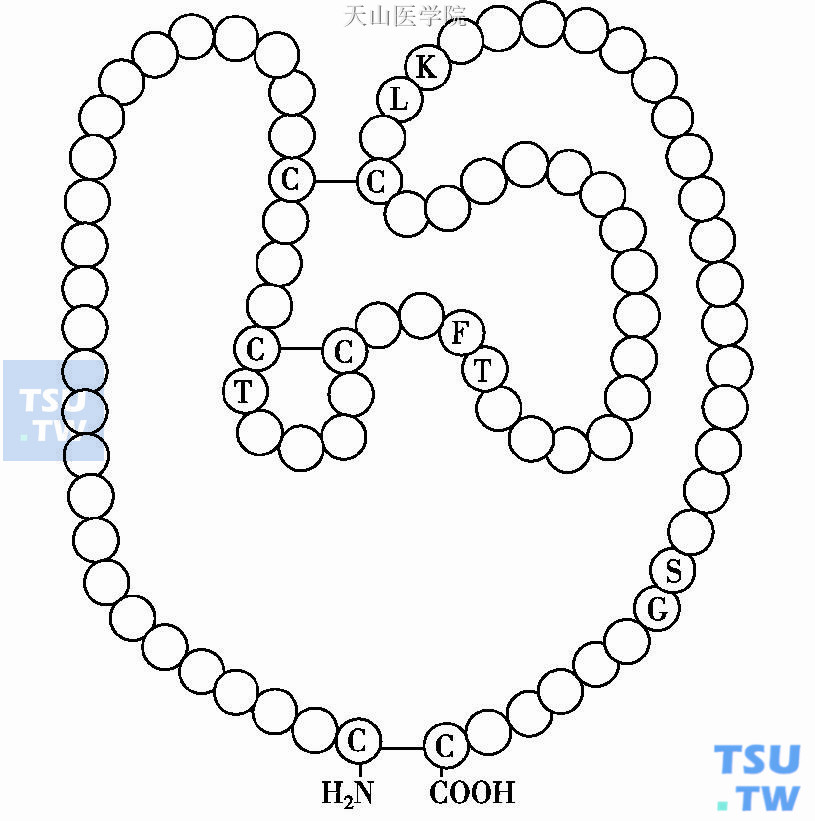
图3 凝血因子Ⅺ重链apple结构
FⅨ的主要生理功能被FⅪa二次裂解转化成FⅨa后,与FⅧa在磷脂表面结成复合物,后者酶解FⅩ使FⅩ转化为FⅩa,因而产生促凝活性。FⅨa(不是FⅩ)能与FⅧa在活化血小板表面结合。结合需ECF2及丝氨酸蛋白酶区。FⅨ的Gla区并有与内皮细胞受体的结合位点。
FⅨ的活化需先转化成一个无活性的中间底物(FⅨα),然后再转成活性酶(FⅨa)。FⅨ活化过程可由FⅪa或外源系因子FⅦa- TF裂解精氨酸145和精氨酸180的二次程序性裂解,释出小活性肽片(FⅨP Mr 11 000)而生成FⅨa(又名Ⅸαβ Mr 45 000)。FⅨαβ有促凝和酯酶样活性,由重链(Mr 28 000)和轻链(Mr 18 000)组成并由二硫键共价联结。丝氨酸蛋白酶的活性区在重链。在存在阴离子磷脂时,FⅩa也能裂解FⅨ的精氨酸145。肽键的单一裂解使FⅨ转化成中间产物FⅨα。FⅨα无促凝活性。中间产物生成的同时加速酶的生成速率。FⅨa (FⅨαβ)在磷脂表面、Ca2+桥联下与FⅧa组成酶性复合物(Ⅹ酶)使FⅩ激活。
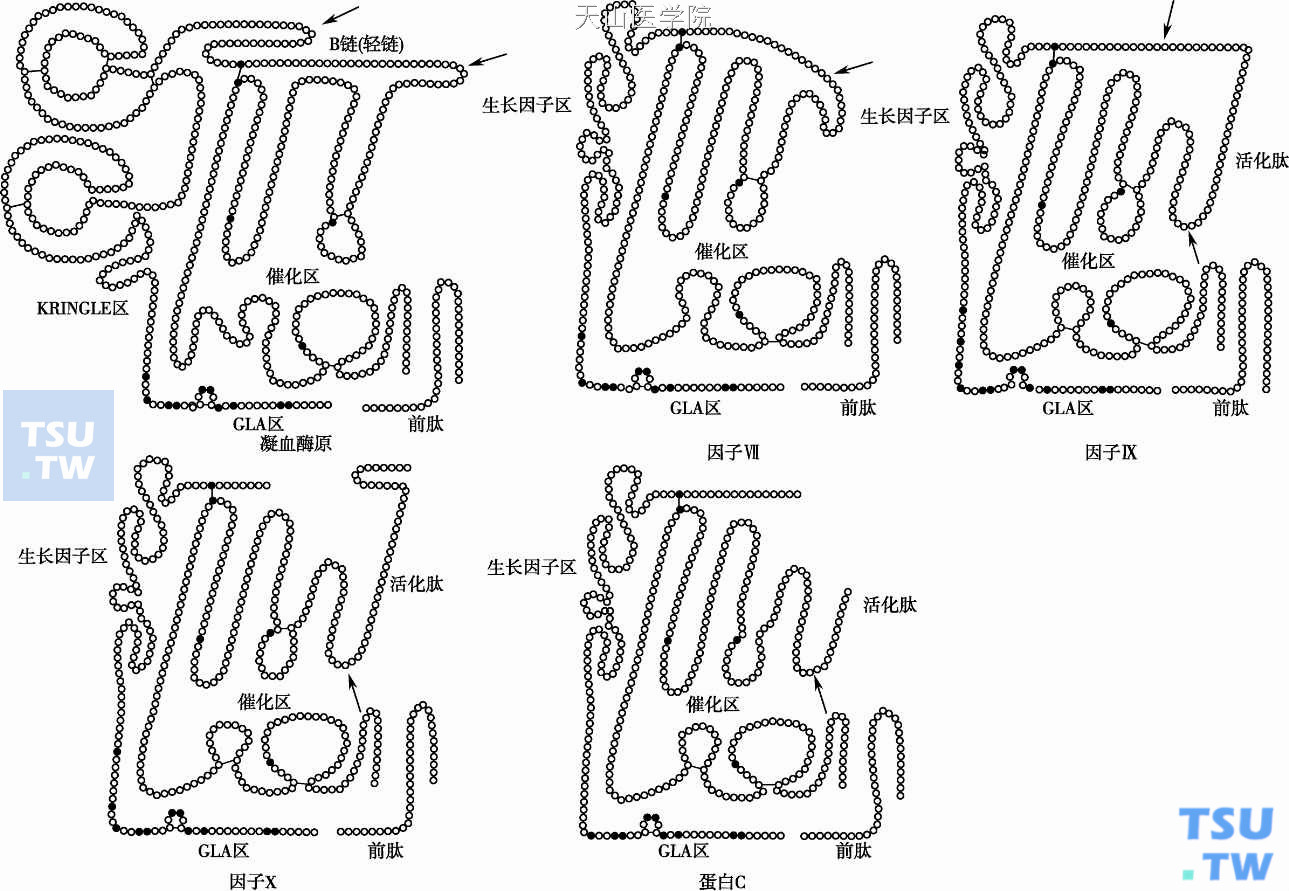
图4 几种维生素K依赖性凝血因子的结构示意图
凝血因子Ⅹ
凝血因子Ⅹ(FⅩ)基因位于13号染色体长臂(13q32- qter),邻近FⅦ基因,27kb长,含8个外显子。基因结构与FⅨ基因等同。肝特异启动子元件(FⅩP1结合位点)位于上游-63~-42bp处,其他启动子(FⅩP2、FⅩP3)分别分布于-215~-140和-457~-351处。转录的FⅩmRNA约1. 5kb长。肝脏初合成的FⅩ为单链多肽。单链中精氨酸-赖氨酸-精氨酸序列(139~141)对细胞内外的蛋白溶解作用十分敏感,被胰蛋白酶样蛋白酶裂解而除去,使血浆中分离得到FⅩ为双肽链分子。FⅩ血浆水平170nM(10μg/ml),半衰期1. 5天。FⅩ酶原蛋白(Mr 59 000)由C端重链(Mr 42 000)和N端轻链(Mr 16 500)以单一的二硫键相联。轻链Gla区含11个γ- Gla,分别位于6、7、14、16、19、20、25、26、29、32、39位。随后为EGF1,其63位为β-羟化天门冬氨酸。2个EGF区能与FⅤ结合,EGF2与辅因子FⅤa结合的引力会发生递减。重链为催化区,包括活化肽(激活时被裂解除去)和丝氨酸蛋白酶区。与凝血酶相似,重链的天门冬酰胺糖基化含侧链NeuAco2→3GalB1→3(NeuAca2→6)GlcNAC。糖基化序列对FⅩ活化有重要作用。
FⅩ是一种Ca2+结合蛋白,在Ca2+存在下,以低、高亲和力的Ca2+结合位点(γ- Gla,β羟基天门冬)与膜表面结合,引起构象改变,表现出膜的结合特征。与其他维生素K依赖蛋白相似,膜结合的FⅩ是一种膜外的蛋白,并不透入膜内。FⅩ可被内源凝血系的FⅨa- FⅧ(Ⅹ酶)复合物或外源凝血系的FⅦa-TF(Ⅹ酶)复合物裂解其重链精氨酸1094-异亮氨酸1951键而转化成FⅩa。FⅩa(Mr 48 000)具有促凝及酯酶活性,含重链(Mr 30 000)和轻链(Mr 18 000),以单一的二硫键共价相联。磷脂表面的FⅩa与磷脂表面的辅因子FⅤa组成复合物(凝血活酶又名凝血酶原酶),使凝血酶原发生有限的蛋白水解作用而活化。血浆中的FⅩa被抗凝血酶Ⅲ(ATⅢ)或组织因子途径抑制物(TFPI)灭活。
凝血酶原
凝血酶原基因位于11号染色体(11pl1- q12),21kb长,由14个外显子和13个内含子组成。外显子分别编码:信号肽(外显子1)、前肽/γ- Gla区(外显子2)、芳香族氨基酸堆积区(外显子3)、两个Kringle区(外显子4~7)、活化区(外显子8,9)和丝氨酸蛋白酶区(外显子10~14)。内含子的大小自84bp(外显子8,9间)至9447bp(外显子12~13间)。凝血酶原蛋白结构虽与其他维生素K依赖性凝血因子(FⅨ、FⅩ、FⅦ、PC)一致,但其基因仅部分同源:外显子1~3相同;不同处为:①其外显子3 ~4编码Kringle与其他上述因子不同,但该结构也见于FⅫ、纤溶酶原、组织型纤溶酶原活化物等分子中;②其催化区(活化区和丝氨酸蛋白酶区)含7个外显子,而其他FⅨ基因家族只含2个外显子。凝血酶原mRNA 2. 1kb长,包括5'非翻译区(>150bp),开放阅读框架(1. 8kb),3'非翻译区(97bp)。凝血酶原基因的转录起始点含弱启动子,肝特异增强子分布于转录起始点上游900bp处,能和肝细胞因子-1(HNF- 1)相反应。
凝血酶原是一种血浆单链糖蛋白,其氨基酸顺序已阐明。未成熟的分子合成时含疏水性信号肽(自-43~-19位,由25个氨基酸组成),到粗内浆网时被信号肽酶除去信号肽。前肽含γ- Gla识别位点(包括-18~1位,由18个氨基酸组成)。γ羧化作用完成后在高尔基复合体中被细胞内多肽酶除去前肽。分泌到血浆的成熟分子凝血酶原Mr 72 000,由579个氨基酸组成,血浆水平1. 4μM(100ng/ml),半衰期3天。分子的氨基端含10个Gla,位于6、7、14、16、19、20、25、26、29、32位。分子含糖量10%,人与牛的凝血酶原的天门冬酰胺78、100、373位N-联结糖基,天门冬酰胺相联的寡糖包括:Neu Acα2→3Glaβ1→3(Neu Acα2→6)GlcNAc。Gla区和两个Kringle区含有短的芳香氨基酸堆积区功能尚不清楚,可能与凝血辅因子FⅤa形成蛋白复合物有关,这一结构也见于FⅫ、纤溶酶原和tPA。凝血酶原分子结构1/2为催化区,后者包括使凝血酶原转化成活性酶的活化肽和具有活性蛋白酶识别和裂解底物的丝氨酸蛋白酶区。该区含有组氨酸-天门冬氨酸-丝氨酸(催化三联体)顺序与其他丝氨酸蛋白酶相类似;该区的精氨酸382~393称阴离子结合部位能与底物纤维蛋白原、凝血酶调节蛋白(TM)和水蛭素相结合。凝血酶原活化后生成的蛋白水解酶为凝血酶。凝血酶具有多种生理功能:促凝作用使纤维蛋白原转化为纤维蛋白、促使血小板聚集并提供有效膜表面,活化ⅩⅢ促进纤维蛋白交联、活化凝血酶激活的纤溶抑制物(TAFI)起稳定纤维蛋白凝块作用。凝血酶活化FⅧ、FⅤ、FⅨ、FⅦ而参与血块形成的正反馈机制。凝血酶活化PC而参与血块形成的负反馈调控。凝血酶尚有激发纤溶活性、刺激成纤维细胞和内皮细胞增殖、趋化巨噬细胞,参与内皮细胞、血小板、粒细胞间的相互反应等功能。然而,生理情况下,微循环血管内皮细胞通过抗凝血酶Ⅲ(ATⅢ)、TM等机制能有效地清除凝血酶。
凝血因子Ⅶ
凝血因子Ⅶ(FⅦ)基因位于13号染色体长臂(13q34),紧接FⅩ基因,全长12. 8kb,含9个外显子。前体蛋白的信号肽有两种合成方式:①无形体的外显子1B编码信号肽,其他编码基因与FⅨ基因相似;②信号肽由外显子1A编码。后一形式使前体蛋白N端链延伸;延伸的信号肽/前体含38~60个氨基酸。外显子编码的功能区包括前体及γ- Gla区(外显子2),短的芳香族氨基酸堆积区(外显子3),EGF1、EGF2(外显子4、5),不含活性肽的催化区(外显子6~8)。mRNA2. 4kb长,包括3'非编码区(1. 0kb)和中止编码子后的多A尾。
FⅦ是外源性凝血系的组成,FⅦa- TF复合物能使FⅩ活化,人FⅦMr 50 000,含406个氨基酸,血浆酶原蛋白水平10nM(0. 5~2. 0mg/ml),血浆半衰期4~6小时。FⅦ是血浆凝血因子中除PC外的最短半衰期者,使替代性治疗时很难维持血浆水平。分子N端含10个γ- Gla。牛FⅦ的γ- Gla位于6、7、14、16、19、20、25、26、29、34、35位。63位的天门冬酰胺部分β羟化。FⅦ含糖量13%。与其他酶原蛋白不同的是,循环中FⅦ有不活化和活化的两种形式。最近资料表明循环中极微量的FⅦa(0. 1nmol/ L)足以在组织损伤时和新形成的TF结合,所形成的FⅩa又能使FⅦ活化而增强组织损伤中的FⅩa量,从而大大增强通过外源系的凝血酶生成。凝血酶、FⅨa、FⅩa、FⅦa、FⅫa都能使FⅦ酶原裂解产生FⅦa。凝血酶使FⅦ精氨酸152-异亮氨酸153处裂解产生FⅦa。FⅦa(Mr 50 000)由N端轻链(Mr 20 000)和C端重链(Mr 30 000)以二硫键共价结合,重链含催化区。FⅦa几乎不被血浆蛋白酶抑制物中和。FⅦa半衰期为1~2小时,是所有活化的凝血因子中半衰期最长者。
