细胞因子是指由基因编码的细胞产生的有特异性受体的传导细胞间信息的蛋白分子。由于是基因编码的,与许多基因类似存在着基因多态性和微卫星多态性,转录时可能出现选择性剪接,翻译后由于糖基化的不同出现更多的多态性。所以,细胞因子异质性和功能冗余性是普遍存在的性状。但是,细胞因子及其受体也有许多共性,是其细胞生物学和生理、病理生理作用的基础。
细胞因子及其受体的作用方式
细胞因子及其受体的作用方式按因子(配体)和受体所在细胞的位置和距离分为4类:
一、自分泌(intracrine)或自激作用(autocrine)。因子和受体由同一细胞产生,受体在细胞表面,因子分泌至细胞外与细胞表面的受体结合,作用于细胞自身。最初在肿瘤细胞中发现,是肿瘤自律性生长机制之一。初期认为乃肿瘤细胞特有,后来证实许多正常细胞也有自激作用机制。细胞内自激因子是指细胞因子在形成细胞因子的细胞内未经成熟、分泌就起作用,这种现象多见于肿瘤细胞,正常细胞中是否存在有待研究。
二、旁分泌(paracrine)。因子和受体由附近的不同细胞产生,受体在细胞表面,因子由另一类细胞分泌。在体内普遍存在,是细胞间通讯的主要方式。如骨髓基质细胞和造血细胞分泌大量细胞因子相互作用。
三、内分泌(激素)(endocrine)作用。因子和受体由相距甚远的不同细胞产生,受体在细胞表面,因子由另一类细胞分泌。在体内普遍存在,是远距离细胞间通讯的主要方式之一。除传统的激素外,EPO和TPO由肾脏和肝脏产生,作用于骨髓造血细胞,有人称它们为造血激素。
四、并置分泌(juxtacrine)。因子和受体由相邻的同类或不同细胞产生,受体和因子都在细胞表面。膜结合型因子及其受体如此作用,黏附分子也如此作用。正常白细胞与血管内皮细胞相互作用常由此机制介导,癌细胞浸润、转移与此有关。
细胞因子受体后信号转导调控网络
细胞因子与其受体结合后启动的信号转导途径很多,形成了错综复杂的调控网络。是当前生命科学研究的前沿之一。细胞因子介导的细胞内信号转导形成的调控网络有两种调节方式,即级联反应和交联(cross talk)。级联反应是纵向调节,在信号转导途径中各种调节因子作用于信号传递的不同环节,如磷酸化和去磷酸化作用。交联是横向调节,各信号转导途径间的相互交流,可发生在多个水平,可以是激酶与转录因子间作用,也可以是其他形式的作用,使之真正成为调控网络,举例说明如下:
许多细胞因子的信号传导是通过受体-酪氨酸激酶(PTK)-信号转导和转录活化子(STAT)-靶基因激活实现的。
信号转导和转录活化子家族
信号转导和转录活化子家族(signal transducers and activators of transcription,STATs)。STAT是细胞质潜在的转录因子,它们充填式地激活细胞表面的受体,众多细胞因子受体的信号转导是通过STAT蛋白的。受体胞内区与STAT蛋白结合后在该处磷酸化,并形成同型或异型二聚体后进入核内,与特异的启动元件结合后调节基因表达。在哺乳动物已发现7个STAT成员:STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B、STAT6。它们的DNA结合序列相似:TTN46AA,但有一定的特异性,即不同的基因由不同的STAT复合物调节。STAT蛋白能与多种别的核因子作用,包括CBP、Nmi(可的松受体)、c-jun和MCM5,因此STAT蛋白的作用范围扩大了许多。其中酪氨酸磷酸化,也许还有丝氨酸磷酸化对于STAT蛋白的激活是关键性的。
小鼠的STAT1和STAT4基因定位于1号染色体,人类的在2q12~2q33。STAT5A和STAT5B基因:小鼠的定位于11号染色体,人类的在12q13~q14。STAT2和STAT6基因:小鼠的定位于10号染色体,人类的在17q11~q22。STAT通过酪氨酸磷酸化受到调控,它们有一特殊的结构域:癌基因Scr同源物2(SH2)结构域,它能与含磷酸化酪氨酸的其他蛋白作用。与NF-κB同属于一个保守的转录因子家族,成员有c-rel、p65、p50、relB、Dorsal。它们间形成同源或异源二聚体。NF-κB即由p65和p50组成异源二聚体,其功能受细胞质内另一抑制蛋白IκB的调节,IκB与NF-κB含有核定位信号(NLS)的RHR区结合,使NF-κB不能进入核内,从而抑制其转录活性。DNA结合和转录活化区域在STAT全长750~850氨基酸,由N端至C端包括六个功能区:N端保守区,调节STAT的功能区;400~500AA的DNA结合区;500~600AA Scr同源区3(SH3);600~700AA Scr同源区2(SH2),此区使STAT与活化受体结合,诱导蛋白构象变化,与JAK(Janus protein kinases)相互作用而磷酸化,形成二聚体并有DNA结合能力;701AA是酪氨酸磷酸化位点,当酪氨酸磷酸化时STAT呈活化状态;C端为转录功能区。
JAK/STAT细胞信号转导途径是能快速引导基因转录的独特途径,许多细胞因子都是通过它起作用。生理状况下细胞因子通过细胞表面的受体激活JAK/STAT通路,其表达是短暂的。近年来多个实验室的工作证明:在AML、ALL和EBV转化的LCL细胞中有STAT的异常持续性表达,尤其在有M-CSF或SCF存在时可引起LCL的STAT持续性表达。
Notch信号转导途径
在多种细胞的特化(specification)中起重要作用。广泛存在,自线虫至哺乳动物均可测出。参与胚胎发育、造血细胞分化、T细胞胸腺选择、血管生成等,主要介导细胞分化的抑制信号。发生分化和特化的细胞表面Notch配体Delta/Jagged表达升高,与周围未分化细胞表面的Notch分子结合,通过并置性刺激机制,Notch胞内区解离,移至核内与DNA结合蛋白C启动子结合因子1(C promotor binding factor 1,CBF1)结合,起转录激活作用,激活分化拮抗基因(如Hairy enhancer of split,HES)的表达。
gp130介导的信号转导途径
gp130是IL-6、IL-11、LIF、OSM(抑瘤素M)、CNTF(睫状神经营养因子)、心肌营养因子(CT-1)等细胞因子受体家族的共同信号传导链,不直接结合配体,但参与形成高亲和受体。细胞因子与受体结合引起gp130二聚体化,导致与gp130结合的酪氨酸激酶JAK激酶相互作用——自身磷酸化而活化;同时受体酪氨酸磷酸化而启动多种信号转导途径活化:STAT、Ras、MAPK。在几乎所有的细胞系和器官都能测出gp130 mRNA的表达,在小鼠胚胎干细胞即有其表达。可见gp130的功能已超出细胞因子受体的界限。转基因动物研究表明,gp130纯合子缺陷小鼠均胎死宫内,说明gp130有不可替代的功能。
不同的细胞因子受体的信号传递途径不同,不同信号传递途径间可以沟通。细胞内的信号转导途径宛如城市的交通形成网络。以M-CSF/M-CSFR为例说明细胞因子受体的信号传递:M-CSF与MCSFR结合,引起M-CSFR分子二聚化,向胞内传递信息。二聚化过程是M-CSFR信号传递的重要步骤,分几步完成:结合M-CSF后,首先形成M-CSFR非共价二聚体,引起受体自身磷酸化,然后通过二硫键形成共价二聚体,此二聚体随即被修饰为异源或同源二聚体,接着酪氨酸残基发生去磷酸化,最后因子-受体复合物通过内在化进入胞内。M-CSFR二聚体形成后,受体酪氨酸激酶被激活,导致M-CSFR胞内区多个酪氨酸残基自身磷酸化:包括近膜区Tyr561、1K区Tyr699、Tyr723和Tyr708、K2区Tyr809 和C末端Tyr921等位点。以前认为M-CSFR胞内区酪氨酸残基磷酸化以后,只被带有SH2结构域的蛋白Grb2和磷脂酰肌醇激酶3(PI3)识别。后来研究证明,活化的M-CSFR可以被细胞内多种分子识别,包括ATAT1、STAT3、STAT5、Src、PI3、JAK、SHIP、Shc、Cb1、RAFTK、pp37和pp57等信号分子,以及一些未知的150kD酪氨酸磷酸化蛋白等。突变实验表明M-CSFR中Tyr699、Tyr723、Tyr708和Tyr561分别是Grb2、PI3、STAT1和Src等分子识别的特异性位点。由此可见,M-CSF/M-CSFR可通过PI3、JAK、STAT和ERK、MAPK等多条信号途径传递信息。此外,M-CSFR尚能通过蛋白激酶C(PKC)、二酰基甘油(DAG)、磷酸酯酶C(PLC)、cAMP、细胞周期蛋白D和周期蛋白E等信号分子进行细胞内信息传递,产生相应的生物学效应。
造血的转录调控
从造血干、祖细胞到终末分化的成熟血细胞,从胚胎期卵黄囊、胎肝到成人骨髓造血,造血微环境不同,调控的细胞因子也不尽相同,但是各种造血细胞的表型基本相同。造血干细胞体外扩增实验研究表明:造血干、祖细胞在不尽相同的细胞因子调控下,获得基本相同的造血细胞,亦即细胞因子调控的特异性不强。细胞分化的本质是相关基因的表达或关闭,直接受转录因子的调控。近年来逐步认识到了转录因子对造血的基础调控作用。例如缺失M-CSF基因的纯系小鼠虽然易于罹患某些疾病,但是仍然能够存活,仍有数量不多的单核-巨噬细胞产生。缺乏G-CSF和G-CSF受体或G-CSF和GM-CSF的小鼠仅呈轻度粒细胞减少,不如缺乏转录因子C/EBP-α或PU-1小鼠的粒细胞减少严重。G-CSF对缺乏PU-1小鼠的粒细胞减少没有治疗作用。对受体后信号转导的深入研究表明,细胞内信号转导构成了复杂的网络,造血调控实际上受转录调控的调节,有系列特异的转录因子,也有广谱的转录因子。转录调控有正调节,也有负调节,直接调控许多重要基因的表达,包括生长因子及其受体、其他转录因子以及其他与分化有关的重要基因的表达。有些转录因子的表达又受细胞因子等细胞外信号的控制。上述错综复杂的因素形成了调控网络。
转录因子在细胞分化调控中的作用最近获得又一明显的实验证据:用两个转录因子(Oct4,Sox2)就可以在体外将成纤维细胞诱导为“诱导性多潜能干细胞”(iPS),可能成为再生医学临床应用的“种子细胞”。
转录因子是由基因编码的调节基因产物,调节由DNA转录为mRNA的蛋白分子。哺乳动物的转录因子可分为两大类:普通转录因子和特异性转录因子。普通转录因子即Ⅱ型RNA聚合酶复合体,它启动顺序的级联反应,形成包括Ⅱ型RNA聚合酶在内的多种起始(蛋白)复合体,结合于DNA转录启动位点,其转录效率取决于蛋白复合体的稳定性,后者由特异性转录因子调控。特异性转录因子通过与起始复合体的直接或间接作用调节Ⅱ型RNA聚合酶的活性,这种作用通过特异性转录因子的特异结构域进行。特异性转录因子能识别和结合特定基因的DNA基序,根据识别的DNA基序对特异性转录因子进行分类。往往一个特异性转录因子能识别多个DNA基序。
参与造血转录调控的转录因子很多,是转录因子,而不是细胞因子的受体后信号在定向分化中起关键作用。SCL是多能造血干细胞必需的转录因子;CBF,c-Myb和GATA-2是多能造血干细胞分化必需的转录因子;GATA-2调节C/EBP-α向粒系分化;Ikaros和PU-1导向淋巴系列;GATA-3为T细胞分化必需;PU-1和Pax为B细胞分化必需;GATA-1 和C/EBP-α调控向嗜酸性粒细胞系列分化;GATA-1单独诱导向红细胞系列和巨核细胞系列分化;GATA-1和FOG(Friend of GATA)以及NF-E2促进巨核细胞系列分化;GATA-1和红细胞系列Kruppel样因子(EKLF)促进红细胞系列分化;PU-1和C/EBP-α导向髓细胞系列分化。此外,多年的研究表明转录因子、转录调控的异常与白血病、淋巴瘤密切相关,如新的或不恰当的基因表达;变异的转录因子使关键性蛋白增加或减少,变异的启动子蛋白等都可能引起白血病。
信号传导机制的负调节-内灭活步骤
细胞因子受体的胞内区可与不同信号传导途径的蛋白接头(adaptor protein)连接,例如EPOR与EPO结合后二聚体化导致Jak分子和EPOR链磷酸化,从而形成STAT分子连接位点,该信号传导的终末是将EPOR链的一个结构域与蛋白酪氨酸磷酸化酶S-PTP1结合,接着Jak分子去磷酸化,STAT分子本身降解。已发现多种STAT诱导的STAT激活的抑制物,它们的活性多种多样:有的可抑制Jak激酶;有的直接与STAT本身结合(如PIAS3抑制STAT3的活性)。已报道了许多磷酸化酶介导的蛋白接头分子活性的灭活,表明任何途径的制动能力是十分广泛和高度安全的。磷酸化酶抑制物增强是通过细胞因子受体的。有许多例子表明磷酸化酶调节物失灵会导致癌变。
抑制受体的研究始于对小鼠FcγRⅡB1胞内区结构域的研究,发现有13个氨基酸序列(AENTITYSLLKHP)对于抑制B细胞激活的受体是必需的。FcγRⅡB1介导TgG免疫复合物和IgG抗免疫球蛋白抗体的免疫调节性质。IgG抗体抑制FcγRⅡB1和BCR(B细胞对抗原的受体)聚集引起的激活。人类FcγRⅡB介导的负调节作用业已在人和鼠的B细胞证实,也需要高度保守的基序。深入研究表明此类作用不仅限于B淋巴细胞,在T细胞和髓系也已证明,可能是带有ITAMs的造血细胞的普遍性质。
酪氨酸免疫受体激活基序(immunoreceptor tyrosine-based activation motifs,ITAMs)即酪氨酸和亮氨酸之间由两个其他氨基酸隔开(YXXL),最早是从FcγRⅡB的氨基酸序列中确定的,它调控酪氨酸磷酸化和含SH2结构域酶的更新,进而发现FcγRⅡB的酪氨酸免疫抑制受体基序(immunoreceptor tyrosine-based inhibitor motifs,ITIMs)。ITIMs由6个氨基酸扩展而成:(ILV)XYXX(LV)。ITIMs位于受体的胞内区。有ITIMs的受体构成了一个抑制受体族,它们对生长因子和癌基因激活有抑制作用,近年来发现多个新成员,其中还有不含ITIMs的非抑制/激活配对受体(下表)。带有ITIM的分子的定义,必需有下述性质:
人类细胞的免疫抑制受体
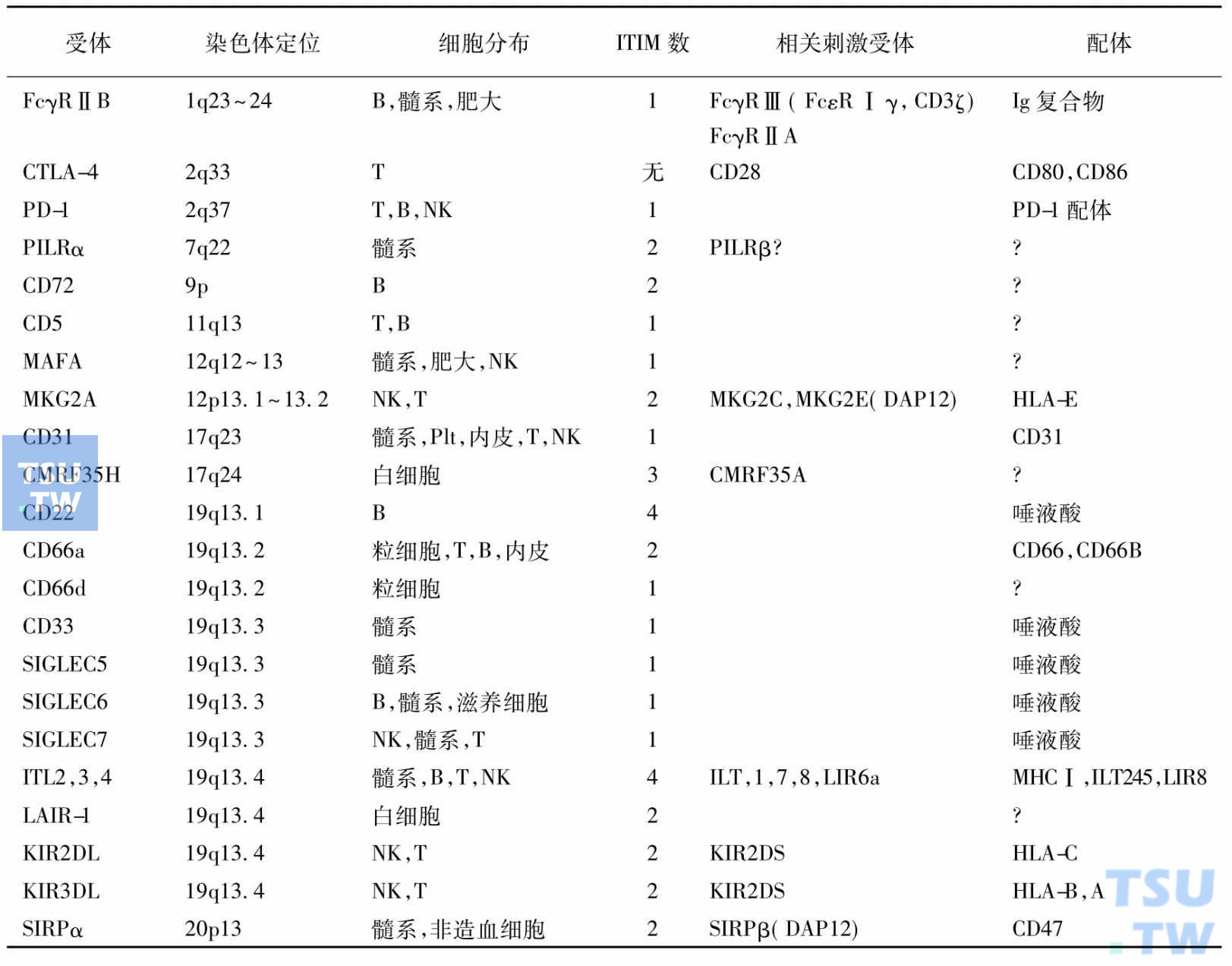
- 带有ITIM的分子抑制ITAM依赖的级联反应的激活。
- 带有ITIM的分子的胞内区具有保守的l/ VXYXXL/V基序。
- 带有ITIM的分子必须与带有ITAM的受体聚集才具有抑制功能。
- ITIMs在酪氨酸残基磷酸化。磷酸化后,带有ITIM的分子更新SH2结构域的磷酸酶。
含ITIM受体在造血细胞中存在。有些带有ITIM的分子的受体也有刺激作用。如CD22既有ITIM又有ITAM样序列,EPOR、IL-3R、IL-5R和GMCSFR的共同β链,c-Kit生长因子的受体也如此。有些细胞刺激受体和抑制受体与同样的配体结合,其总效应取决于两种信号的相对强度。这种调节的意义已在小鼠的致死性自身免疫性疾病中证实,该疾病是由于免疫抑制受体的破坏引起的;ITIM在进化过程中的保守性也证明了抑制受体的重要性。
近年来免疫学家还研究另一类抑制受体:免疫球蛋白介导的抑制受体。半个世纪以来对抗体缺乏的患者采用静脉注射免疫球蛋白(IVIG)疗法治疗感染性休克很有效,IVIG是批量生产的,由众多供血者的血清分离免疫球蛋白,主要成分是IgG。近来注意到大剂量IVIG对自身免疫性疾病(如ITP、Guillain-Barre综合征等)呈抗炎症作用,有令人鼓舞的疗效。用小鼠ITP模型研究的结果表明,免疫球蛋白IgG的Fc抑制性受体FcγRⅡB起关键作用。在此小鼠ITP模型中巨噬细胞吞噬与抗血小板抗体结合的血小板形成ITP,给予大剂量IVIG可阻止ITP模型形成。但是用抗FcγRⅡB的抗体阻断或将小鼠的FcγRⅡB剔除则IVIG不起作用。用IVIG治疗小鼠的巨噬细胞FcγRⅡB表达明显增高。深入研究巨噬细胞FcγRⅡB表达增高的机制又揭示了复杂的调控网络,而不是简单的FcγRⅡB基因表达增加,与TgE的Fc受体FcεRⅠ表达增高有关。
