非冷冻保存
适用于造血干细胞(HSC)的短期保存,时间从数小时至数天不等,主要用于AHSCT患者。非冷冻保存一般将BM放于4℃冰箱中,不需任何处理。BM在4℃中保存48小时后CFU- GM和BFU- E的回收率分别在80%和45%左右,保存时间延长至72小时,分别降至40%和30%左右。通常把保存时间控制在60小时之内。另外,HSC如需体外扩增、净化等则在37℃保存。
深低温冷冻保存
深低温冷冻保存是保存HSC最常用的方法。在低温中细胞代谢和各种酶的活动几乎完全停止,故保存的时间得以延长,而且温度越低可保存的时间越长。HSC在-80℃可保存1~2年,在-196℃中则可长期保存。为了取得好的保存效果,应注意以下几个环节的处理。
采用冷冻防护剂
降温分为慢速降温和快速降温,慢速降温会形成细胞外冰晶,细胞外渗透压增加,引起细胞脱水;快速降温则会使细胞内结冰,引起细胞机械损伤,两者的冰晶损伤均可导致细胞死亡。解决这一问题的方法是采用冷冻保护剂。冷冻保护剂对细胞的保护作用机制尚未完全阐明,但部分可以用冰晶形成和玻璃化理论来解释。冷冻保护剂即防冻剂分为细胞内和细胞外防冻剂。细胞内防冻剂如甘油、二甲基亚砜(DMSO)等;细胞外防冻剂如羟乙基淀粉(HES)、右旋糖酐(DEX)等,是大分子溶液,高分子量,溶质较少,不能透过细胞膜,它们在浓度增加到一定程度时,在形成冰晶之前,在细胞膜外形成一层黏稠的“玻璃壳”即玻璃化,阻止细胞内水分子外流,降低细胞脱水程度,减少细胞损伤。冷冻保护液除了有防冻剂外,还有糖盐溶液及血浆蛋白等,增加蛋白的浓度或细胞内外防冻剂联合应用可以提高细胞存活率。
冷冻保存HSC前移植物处理
采集到的BM和外周血中含有多种细胞成分,不同细胞的保存条件如防冻剂种类及浓度、降温速度等存在差异,对HSC的冷冻保存条件仅适合于HSC,其他成熟细胞在冷冻保存后会被破坏,出现絮状沉淀、引起输注相关毒性,如溶血所致的血红蛋白尿,严重时甚至发生急性肾功能衰竭。因此,在冷冻前需对采集的HSC进行处理,BM需提取白膜或MNC部分以去除大部分红细胞;外周血在采集时应设定采集MNC程序,使采集物中RBC的含量降低。
细胞浓度
冷冻前需要浓缩采集的HSC。有研究表明PBSC的平均浓度为3. 7×108/ml(0. 4× 108~8×108/ml)时,对CD34+细胞回收率无影响,而较高浓度可降低CFU- GM的回收率。因此,一般BM细胞浓度为1×108/ml,PBSC<4×108/ml。
降温速度
降温速度是影响HSC冷冻保存质量的重要因素,HSC冷冻保存时合适的冷冻速度是1~3℃/min。有作者比较了应用5%~10%的DMSO做防冻剂,降温速度分别为1℃/min、5℃/min 及10℃/min时HSC的回收率,结果DMSO在实验浓度下对细胞回收率无明显影响,但降温速度对细胞回收率的影响却非常大,随着降温速度的增大,细胞回收率降低,以10%的DMSO为例,在降温速度分别为1、3、5℃/min时,干细胞回收率分别为85%、58%和30%,三者之间有显著性差异。中国医学科学院血液病医院移植中心自1987年开始应用CryoMed程控降温机对人的HSC进行冷冻保存,DMSO的终浓度为10%,样品的降温速度保持1℃/min,到-40℃后改为10℃/min,冷冻结果稳定可靠。HSC容量减至原容量的11. 2%±16. 9%,MNC回收率75. 3%±16. 9%,解冻后CFU- GM回收率为84. 9%±19. 96%。
冷冻细胞的保存
HSC如果在程控降温过程中没有受到损伤,那么在储存过程中,只要储存的温度足够低,能够封闭整个细胞所有酶的代谢途径,在理论上样品无论储存多长时间都不会引起细胞存活率的改变。因此认为,储存的温度越低越好。目前大部分实验室是采用液氮来储存标本。在液氮中储存标本分为两种方式,一种是利用液氮蒸气储存,液氮蒸气的温度范围为-100~-194℃。另一种方法是储存于液氮-196℃中。有报道HSC冷冻保存11年后回输给移植患者,仍能重建造血功能。36例患者应用冷冻保存中位2. 7(2. 0~7. 8)年的HSC进行AHSCT,其粒细胞与血小板的恢复时间与应用短期冷冻保存HSC进行AHSCT患者无显著性差异。28份中位保存4. 4年的HSC进行CFU- GM及BFU- E集落培养时,发现集落的产率没有随着保存时间的延长而降低。
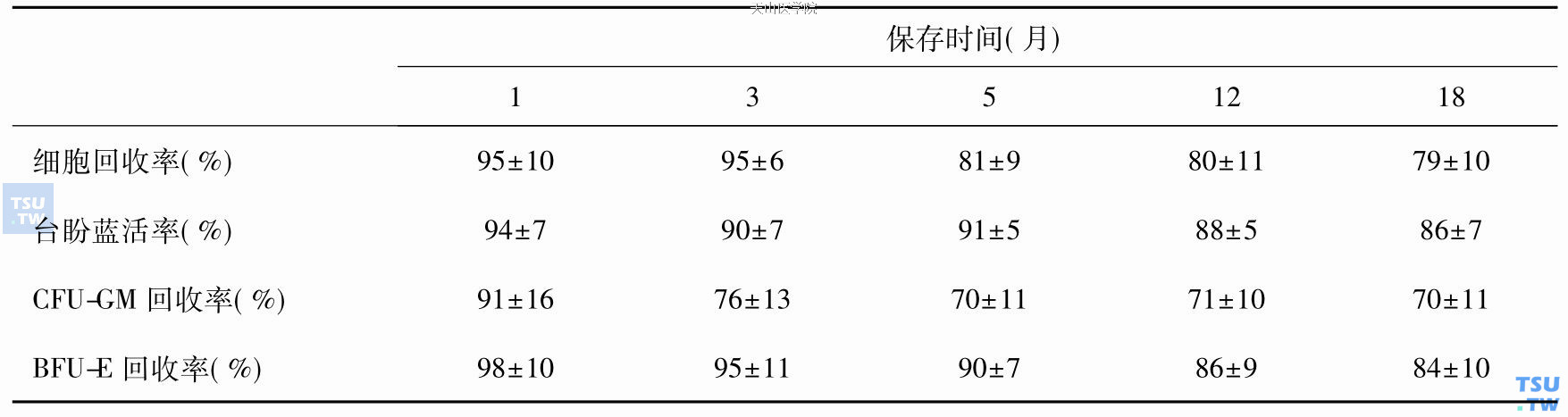
-80℃冰箱保存HSC,保存温度是否足够低是人们比较担心的问题,有资料表明联合DMSO/HES冷冻保存细胞可以保存22个月;保存18个月内的细胞输注给移植患者可以使患者重建造血功能。PBSC在-80℃保存不同时间后造血干/祖细胞回收率见下表。
PBSCs在-80℃保存不同时间后造血干/祖细胞回收率
解冻
HSC的解冻过程十分重要,操作不当易引起细胞肿胀,破裂死亡,当应用的细胞内防冻剂扩散速度慢时,发生的程度更严重。因此,主张采用快速解冻,缩短细胞熔化肿胀过程,同时还以避免再结晶及重新形成冰块。1970年Leibo报道以90℃/min的速度熔化细胞,活率比以2℃/min熔化的细胞活率增加2倍。解冻时一般是采用37~42℃水浴熔化细胞。
