原子吸收光谱法测定金属元素
这种方法在仪器结构及操作上与分光光度法很相似。原子吸收光谱与原子发射光谱的产生是互相联系的相反过程,每一种元素的原子不仅可以发射一系列特征的光谱线,而且也可以吸收与发射线波长相同的特征谱线。当光源发射的某一特征波长的光通过原子蒸气时,原子中的外层电子将选择性地吸收其同种元素所发射的特征谱线,使入射光的强度减弱。在此过程中,原子蒸气对入射光吸收的程度符合比尔定律,即入射光的强度(I0)、入射光所通过原子蒸气的厚度(L)、被原子蒸气吸收后透过光强度(I)与吸光度(A)和试样待测元素浓度(C)之间的关系式为:A=log I0/I=K·L·C,式中K为常数,在同等条件下L也为常数,则A仅与C有关。A=K·C,即元素的吸光度与元素的浓度成正比。
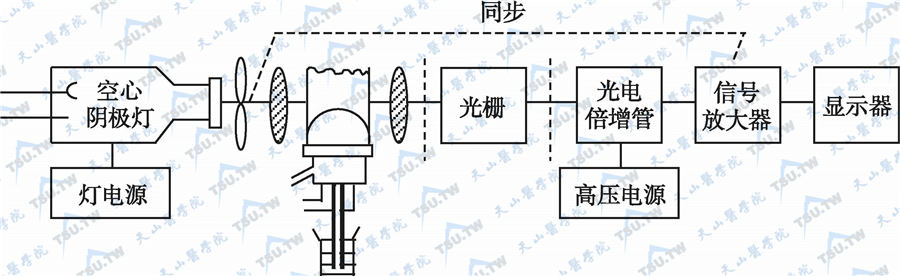
原子吸收光谱仪原理示意图
原子吸收光谱仪主要由光源、原子化器、单色器和检测系统(光电倍增管、信号放大器和显示器)组成,其工作原理见上图。光源为空心阴极灯,采用短脉冲电源提供电子,使惰性气体电离成阳离子,再强烈轰击镀有待测金属元素的阴极表面,使其原子发生溅射,并受到高速电子及离子流的撞击而被激发和发射出待测金属元素吸收的特征谱线。原子化器通常用石墨炉或氧化亚氮-乙炔火焰等提供高温,使试样中的待测原子蒸发成原子化蒸气,吸收来自光源发射的特征谱线。该法对大部分金属元素的检测灵敏度可达10-10~10-14g;元素之间的干扰小,测定的选择性好;测量速度快,仪器操作简便。由于原子吸收光谱法有上述优点,而被广泛应用于众多行业的许多研究领域,在临床和实验室常被用于测定人体内含有的铁、铜、锌、锰、钴、铬、镁、钠、钙、硒、铅等微量金属元素。AAS的主要缺点是不能同时进行多元素分析,分析元素必须用该元素的空心阴极灯作光源。另外AAS也存在需要将血清稀释后再进行测定、操作步骤较多、血清用量大等缺点。流动注射分析(FIA)与AAS联用可实现管道化及自动化,FIA是一种很好的血清进样技术,可将两者联合应用测量血清铜、锌。
荧光光谱法测定氨基酸/多环芳烃/维生素/甾体化合物和酶类
荧光光谱法(spectrofluorometric method,SFM)也称荧光光度法,它与紫外-可见光谱法或原子吸收光谱法的本质区别是:SFM是测量待测物质发射光谱的强度,而前者均是测量待测物质的分子或原子吸收光谱的强度。荧光的产生是多原子分子吸收光量子时,电子根据量子力学的选择原则,从基态的最低振动能级跃迁到高能电子态,然后分子又通过无辐射过程弛豫到一种激发态的最低振动能级,并在回到基态时以发射光子的形式释放能量,通常把这种发射光子称为荧光。由于发射前后的振动弛豫,荧光发射的能量总是低于所吸收的能量,因此,溶液中溶质分子的荧光光谱与吸收光谱相比总出现在较长波长区。激发用的辐射光常采用紫外光或激光。SFM测定的基本原理是待测物质受激发光激发后发射的荧光强度(F)、荧光效率(Φ)、激发光强度(I0)、摩尔吸光系数(ε)、溶液中荧光物质的浓度(C)、溶液厚度(L)和仪器常数(K)之间存在下列关系:F=KΦI0εC·L。在一定条件下,式中的K、Φ、I0、ε和L均为常数,则F与C在一定浓度范围内成正比。
一种物质受能量激发后,能否产生荧光是由其本身的分子结构决定的,只有共轭体系的以苯环为基础的芳香族化合物和一些杂环化合物的分子,才能从激发态返回基态时发射荧光。其发射荧光的强度受溶液的pH、实验温度、溶剂种类、光分解作用、荧光猝灭剂和自吸收等因素的影响。如苯酚在酸性溶液中以分子形式存在,可发生荧光;在碱性溶液中离解成苯酚阴离子,就不显示荧光。如荧光色素罗丹明B在甲醇溶剂中的荧光效率为0.97,而在水溶液中仅为0.25。又如一般物质的荧光强度随温度下降而增加,因为温度下降后,溶液的黏度增加,荧光物质的分子与溶剂的分子碰撞随之减弱,致荧光效率和荧光强度增加;温度升高时,荧光强度下降甚至消失,称为温度猝灭。所以,精密的荧光分析必须在严格控制影响因素的前提下进行。
SFM的检测灵敏度通常比可见光光谱法和紫外光谱法高2~3个数量级[可达皮克(pg)级],因而在氨基酸、多环芳烃、维生素、甾体化合物和酶类等的分析中得到广泛应用,如定性或定量测定尿中的儿茶酚胺(多巴胺、去甲肾上腺素和肾上腺素)等。SFM还被用做HPLC、HPCE和FIA等的检测器,其检测灵敏度可达10-15mol/L;用激光诱导(激发)时,检测灵敏度会更高。大多数氨基酸、生物胺、甾体、生物碱、脂肪酸等本身都不含发射荧光的分子结构或基团,必须与荧光衍生化试剂反应,连接上能产生荧光的基团后才能用SFM分析。SFM的主要缺点是影响因素较多,但只要严格控制条件和排除影响因素,仍能做到精密测量。
