放射免疫分析(radioimmunoassay,RIA)和放射受体分析及竞争性蛋白结合分析均属于竞争性体外放射分析技术。
放射免疫分析是核素标记抗原和待测成分与限量抗体竞争结合的反应
放射免疫分析的反应式如下:
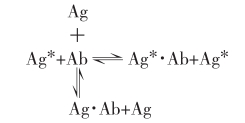
式中Ag*为放射性核素标记抗原;Ag为非标记抗原(待测组分);Ab为限量抗体;Ag*·Ab为标记抗原与抗体形成的复合物;Ag·Ab为非标记抗原与抗体形成的复合物。在反应体系中,当Ag*和Ab的量一定时,两者结合形成免疫复合物的量受Ag含量的竞争性抑制。由于Ag*和Ag同Ab具有相同的亲和力,且Ag*和Ag的分子总数超过Ab所拥有的结合位点数,Ag*·Ab复合物的形成将与Ag量的增减呈函数关系(下图)。当反应达到平衡后,将游离抗原(Ag*和Ag)与形成的免疫复合物(Ag*·Ab和Ag·Ab)分离,并分别测定其放射性强度,游离部分的放射活性(F)与免疫复合物的放射活性(B)即可分别反映Ag*和Ag*·Ab的量。同理,Ag的量也可从反应体系中的F%、B%或B/F的变化中推算出来。

竞争性放射免疫分析原理示意图
注:Ag:待测抗原;Ag*:标记抗原;Ab:限量抗体;C:抗原-抗体复合物;FAg*:游离标记抗原;B:抗原-抗体复合物的放射活性;F:游离标记抗原的放射活性;B/F:B与F的放射活性比
在实际工作中,将已知不同浓度的标准抗原分别与一定量的标记抗原混合,再与一定量的抗体反应,当反应达到平衡后,分离B与F并分别测定其放射活性,求得标记抗原-抗体复合物的结合率。以已知标准抗原的浓度为横坐标,标记抗原-抗体复合物的结合率为纵坐标,绘制剂量反应曲线(或称校正曲线,下图)。这样,通过待测样品在同一实验条件下测得的放射性或结合率,即可由此校正曲线推算出待测抗原的浓度。
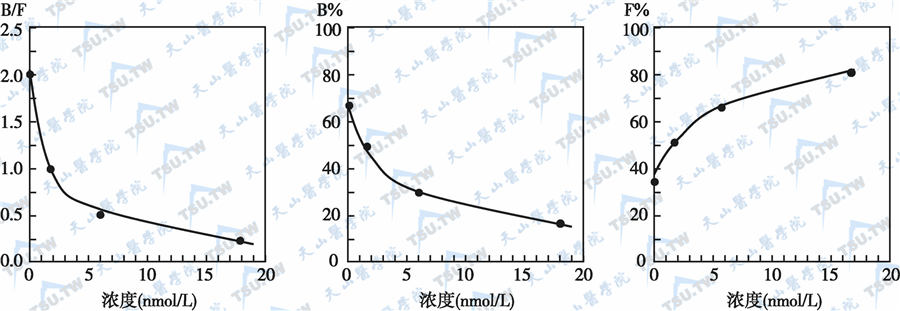
放射免疫分析法的校正曲线
应用125I/131I/3H/14C标记抗原
抗原
用于RIA的抗原或半抗原必须纯度高,否则所含杂质也可能同时被标记上放射性核素,影响RIA反应的特异性,降低检测的灵敏度。对于天然抗原(分子量大于5000Da物质),须选用适当的材料,应用盐析、层析、电泳、离心或结晶等生物化学方法,在保存抗原免疫活性的前提下,将其分离纯化。对半抗原(分子量小于5000Da的物质),通常用化学方法将其共价连接到载体蛋白上。常见的半抗原主要为小分子肽类、类固醇化合物、各种降解产物的片段、药物及其他小分子活性物质。
几乎任何蛋白质都可用做半抗原的载体,甚至包括同源的血浆蛋白。目前最常用的有牛血清白蛋白、卵清白蛋白和甲状腺球蛋白(Tg)等。半抗原与载体蛋白耦联的方法很多,常用的有戊二醛法、碳二亚胺法和活泼酯法等。方法的选用原则是反应条件不致改变半抗原的结构,不使载体蛋白变性,对抗原决定簇的空间结构不造成影响。
放射性核素
用于RIA标记抗原的放射性核素有125I、131I、3H和14C等,其中最常用的为放射性碘,因为它的化学性质活泼,用较简便的方法即可标记成功;容易获得高比活的放射性标记物;衰变时释放的γ射线可用一般晶体闪烁计数仪直接测量,方法简便。而3H和14C的标记方法较复杂,释放的β射线需较昂贵的液体闪烁计数仪测量,难以在一般实验室推广应用,两者的半衰期(14C为5730年,3H为12.3年)长,放射性废弃物处理困难。与131I比较,125I的放射性核素丰度高(>95%),半衰期较长(60天),稳定性较好,试剂盒的保存时间相对较久。而131I的核素丰度(20%)、半衰期(8.04天)和稳定性均不如前者,但其释放的γ射线能量较高,在放射自显影技术中显影时间短,图像清晰。
标记方法
以125I标记抗原为例,有氯胺T法、乳酸过氧化物酶(或双酶)法和氯甘脲法。标记碘原子可与被标记的抗原分子所含有的酪氨酸残基或组氨酸残基等基团结合,一般蛋白质和多肽类完全抗原的分子结构中均含有上述基团,可直接标记。低分子量的类固醇激素、某些蛋白质的降解片段和药物不含上述基团时,必须在其分子结构上耦联上述某种基团后,方能进行标记。
氯胺T法的标记原理是氯胺T系氯代酰胺类氧化剂,在水溶液中易分解并形成次氯酸,将125I-氧化成放射性单质碘(125I2),然后取代抗原分子中酪氨酸残基苯环上的氢原子,或与组氨酸残基的咪唑环共价连接,使蛋白质或多肽发生碘化反应而成为标记有125I的抗原。
乳酸过氧化物酶(LPO)法的标记原理是LPO与H2O2先形成络合物,并将125I-氧化成125I2,然后在LPO催化下,使125I2离子活化而取代肽链中酪氨酸残基苯环上的氢原子。其反应式为:
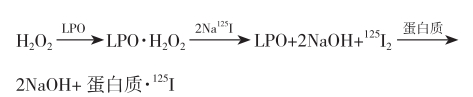
如果在反应体系中加入葡萄糖氧化酶(GOD)和葡萄糖,GOD在氧化其底物时可不断产生微量H2O2作为LPO的底物,以减少H2O2浓度过大对被标记物的损伤,故又称双酶标记法。该法的不足之处是在标记体系中引入了另外的蛋白质[LPO和(或)GOD],LPO和GOD本身亦可能发生碘化反应。
氯甘脲(iodogen)的化学名为1,3,4,6-四氯-3α,6α-二苯基甘脲,是一种不溶于水的固相氧化剂,该法标记原理类似于氯胺T法,氯甘脲能将125I-氧化成125I2,125I2再与蛋白质或多肽分子中酪氨酸残基上羟基邻位的氢原子发生置换反应而标记到抗原上。该法的优点是标记率高,可获得高比活的标记化合物;标记时对抗原的损伤程度最轻,对肽类被标记物无聚合作用;标记反应时间长(一般为2~20分钟),易于控制,标记反应产物主要为单碘标记物。该法在一定程度上克服了其他标记方法的缺点。
对半抗原等小分子物质也可用直接或间接碘标记法标记。直接法是先在甾体激素等半抗原分子上连接一个芳香族胺(组氨酸甲酯或酪氨酸甲酯),然后选用上述任一标记方法将125I标记到半抗原分子连接的结合基团上。间接法是先用一标记方法(如氯胺T法)将125I标记在酪氨酸或酪胺、组氨酸或组胺等衍生物上,经纯化后再将其与类固醇进行衍生反应,组胺的氨基与类固醇衍生物的羧基将相互连接成标记抗原。此外,酪氨酸或组氨酸衍生物经碘化作用后能制备出反应灵敏的标记物,与任何蛋白质或含氨基的半抗原均可连接。
标记产物的纯化
标记后的产物必须除去游离的放射性核素(125I等)和标记时反应体系中的其他物质。通常根据被标记物相对分子量的大小,选用孔径适合的葡聚糖凝胶(如Sephadex G-50等)柱,进行层析分离纯化。
