酶免疫技术即酶标记免疫分析,是在RIA基本理论的基础上发展起来的一种非放射性标记免疫分析技术,可分为酶免疫组织化学技术(enzyme immunohistochemical technique)和酶免疫分析技术(enzyme immunoassay,EIA)两类。非均相的酶免疫分析技术也称固相酶免疫分析技术(酶联免疫吸附分析,ELISA)。在ELISA的基础上,发展了均相-酶免疫分析技术(酶倍增免疫分析,EMIT)。斑点免疫技术是利用金、银、硒等为标记物,在微孔膜载体上进行抗原抗体反应及检测的一种固相标记免疫技术。操作简单,省略了温育过程,因而更加快速。但是只能定性,不能定量,且重复性不高。生物素-亲和素系统(BAS)是一种新型的生物反应放大系统,BAS也常与EIA联合使用,使免疫技术的检测方法更灵敏、快速、简单和经济。
EIA技术由免疫反应系统和检测系统两部分组成。在免疫反应系统中,抗原与抗体反应形成抗原-抗体复合物。生物酶作为标记物的指示剂,同时又是一种生物催化剂,可与其底物发生特异性催化反应,生成的产物又可与另一种能产生反应(生色源)或使紫外吸光值变化的化合物发生氧化还原反应。用分光光度计测定底物溶液的吸光值,检出指示剂的变化。
广义的EIA工作原理,可用以下三个反应式来表示:①免疫反应:抗原+抗体形成抗原-抗体复合物;②酶活性放大:抗原-抗体复合物+酶标记抗原-抗体-酶复合物;③显色:抗原-抗体-酶复合物+底物产物,后者出现颜色反应或紫外线吸光值发生变化。
不同的酶免疫分析各有优缺点
竞争性酶免疫法
竞争性酶免疫法(competitive enzyme immunoassay)。待测抗原(半抗原)或抗体与标准抗原(半抗原)或标准血清竞争结合对应的免疫反应物,其竞争性主要表现在如下两个方面:①待测抗原或待测抗体(包括标准抗原或标准血清)直接与酶标抗原或酶标抗体竞争,使最终检测体系中的酶含量减少,因此,最终检出的酶活性与待测物浓度呈负相关,由此建立的标准曲线斜率为负值。②待测抗原与底物标记抗原、辅酶标记抗原或亲和素标记抗原等竞争结合相应抗体,从而改变酶的活性(增强或减弱),使最终检测体系中的酶活性增强或减弱。如果酶活性增强,则最终检出的酶活性与标准品(或待测样本)的浓度呈正相关,标准曲线的斜率为正值。相反,如果竞争结合后酶活性减弱,则在标准曲线中酶活性与标准品的浓度呈负相关,标准曲线的斜率为负值。
非竞争性酶免疫法
非竞争性酶免疫法(non-competitive enzyme immunoassay)。待测抗原(半抗原)或抗体直接与对应的免疫反应试剂结合,利用酶标记抗抗体或酶标记非免疫识别物质,将酶与待测物连接起来,最后根据所检出的酶活性来推测待测物的含量。在这类方法中,通常最终检出的酶活性与待测物的含量呈正相关,建立的标准曲线斜率为正值。
固相酶免疫分析法(非均相酶免疫分析法)
抗原、半抗原、半抗原-蛋白质结合物、抗体或某些非免疫试剂(如亲和素)等与固相载体连接,对应的配位体(如抗体、抗原和生物素)酶标记物再与固相化的上述免疫反应物联系。根据这一原理建立的EIA方法称为固相EIA(solid-phase enzyme immunoassay,sEIA)或非均质法(non-homogeneous methods)。sEIA方法在所有EIA方法中占很大的比重。目前常用的EIA方法大多数为sEIA类型。最典型、最常用的sEIA方法有酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)和限量抗原底物珠法(defined antigen substrated sphere,DASS),前者使特异性抗原抗体的检测灵敏度达到10-12~10-9 mol/L。现以这两种方法为例,介绍sEIA的操作原理。
ELISA法以微量反应板、试管、齿轮、棒、纸和珠等在水中不改变其形状的材料作为固相载体的EIA方法,均可称为ELISA法。ELISA可用于测定抗原,也可用于测定抗体。在这种测定方法中有三个必要的试剂:①固相的抗原或抗体;②酶标记的抗原或抗体;③酶反应的底物。根据试剂的来源和标本的性状以及检测的具体条件,有下列6种类型。
一、双抗体夹心法测定抗原
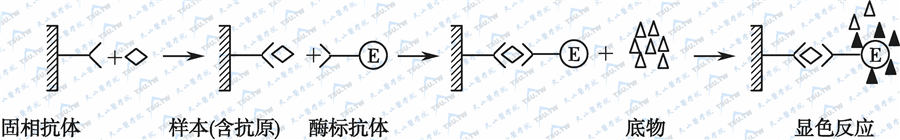
双抗体夹心法测定抗原示意图
如上图,其反应原理是:
- 将特异性抗体与固相载体连接,形成固相抗体,洗去未结合抗体及杂质。
- 加入受检标本,与固相抗体接触反应,让标本中的抗原与固相抗体结合,形成固相抗原-抗体复合物。洗去其他未结合物质。
- 加入酶标抗体,使固相免疫复合物上的抗原与酶标抗体结合。洗去未结合的酶标抗体。此时,固相载体上带有的酶的量与标本中受检抗原的量呈正相关。
- 加底物显色。
夹心式复合物中的酶催化底物成为有色产物。根据颜色反应的程度进行该抗原的定性或定量测定。
双抗体夹心法只适用于二价或二价以上较大分子抗原的检出和定量分析,而不能用于半抗原等小分子的测定。双位点法测抗原也属于此类,用此法测定β-HCG的原理见下图。
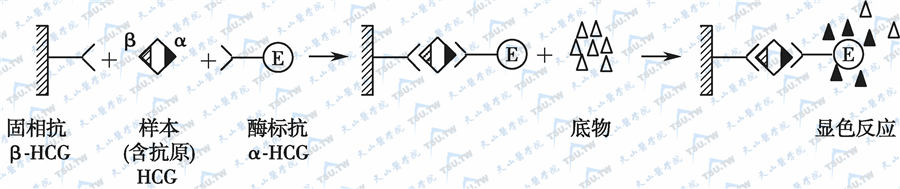
双位点法测定抗原示意图
二、间接法测定抗体
利用酶标记的抗抗体以检测与固相抗原结合的受检抗体,故称为间接法。反应原理(下图)是:
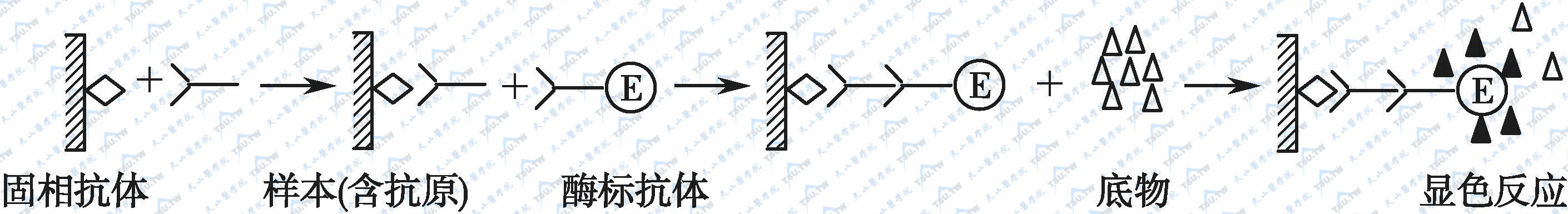
间接法测定抗体示意图
- 将特异性抗原与固相载体连接,形成固相抗原。洗去未结合的抗原及杂质。
- 加入稀释的受检血清。血清中的特异性抗体与固相抗原结合,形成固相抗原-抗体复合物,经洗涤后,固相载体上只留下特异性抗原-抗体复合物。其他免疫球蛋白及血清中的杂质由于不能与固相抗原结合被洗去。
- 加入酶标抗免疫球蛋白(酶标抗抗体,一般为酶标抗人IgG),它与固相复合物中的抗体结合,从而使该抗体间接地标记上酶。清洗后,固相载体上的酶的量与特异性抗体的量相关。
- 加底物显色。
颜色深度与标本中受检抗体量相关。本法主要用于对病原体抗体的检测,其主要缺点为受检标本须经稀释(1∶50~1∶200)后才能进行测定,否则血清中高浓度的非特异性IgG和其他干扰物质会引起本底过高,影响结果的判断。
三、双抗原夹心测定抗体
反应模式与双抗体夹心法类似。用特异性抗原包被和制备酶结合物,以检测相应的抗体。同属抗体检测,与间接法不同之处为以酶标抗原代替酶标抗抗体。在间接法不适用时(如包被抗原中的杂质可与酶标记的抗人IgG反应),可试用此法。此法中受检标本不需稀释,可直接用于测定,因此其敏感度相对高于间接法。在临床检验中,抗HBs的ELISA常采用本法。
四、竞争法测定抗体
当相应抗原材料中含有与抗人IgG反应的物质,而且不易得到足够的纯化抗原进行包被时,可用此法检测特异性抗体。其原理为标本中的抗体和一定量的酶标抗体竞争与固相抗原结合。标本中抗体量愈多,结合在固相上的酶标抗体愈少。因此阳性反应呈色较浅于阴性反应。一般在包被时多采用捕获法,即先包被与抗原相应的抗体,然后加入抗原,形成固相抗原,以测定HBcAg为例,其反应原理如下图。
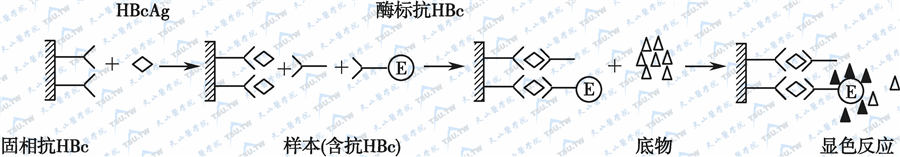
竞争法测定抗体示意图
五、竞争法测定抗原
小分子抗原和半抗原因缺乏可作为夹心的两个或两个以上的位点,因此不能用双抗体夹心法进行测定。竞争法的原理是标本中的抗原和一定量的酶标抗原与固相抗体竞争结合。标本中抗原量愈多,结合在固相上的酶标抗原愈少。因此标本中抗原含量较多时,呈色较淡。小分子激素或药物的ELISA测定多用此法。反应原理如下图。由于这些定量测定的准确度要求较高,试剂制备较困难。
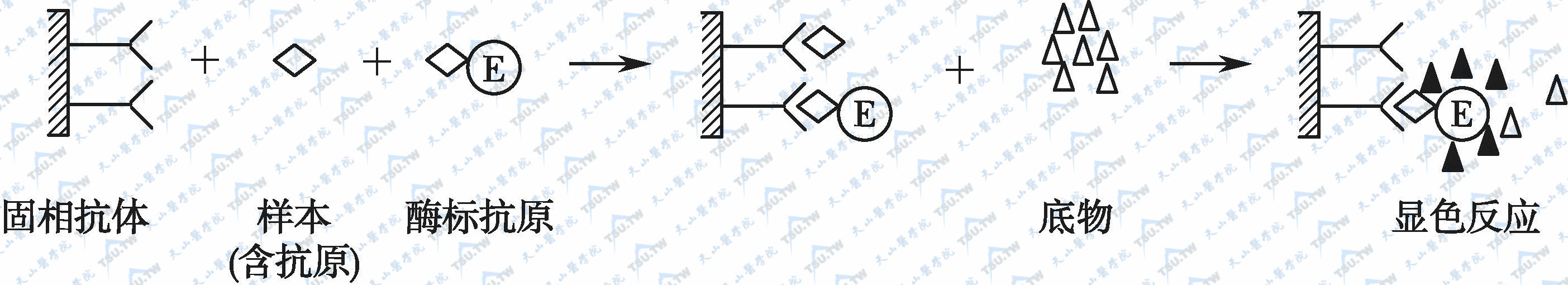
竞争法测定抗原示意图
六、双夹心法测IgM抗体
IgM抗体的检测用于传染病的早期诊断。间接ELISA一般仅适用于检测IgG抗体。如用酶标记的抗人IgM作为二抗进行间接ELISA测定IgG抗体,标本中同时存在的不同浓度的IgG抗体将与IgM抗体竞争,而使结合在固相抗原上的IgM抗体相应减少。另外标本中如含有类风湿因子,也会产生干扰。因此用一般的间接法测定IgM抗体不能得到准确的结果。在双夹心法中,用抗人IgM抗体包被固相,以捕获血清标本中的IgM(其中包括针对抗原的特异性IgM抗体和非特异性IgM)。然后加入抗原,此抗原仅与特异性IgM相结合。继加酶标记针对抗原的特异性抗体,再与底物作用,呈色即与标本中的特异性IgM呈正相关,以检测IgM抗HAV的原理如下图。
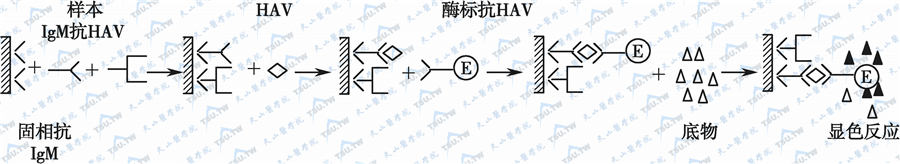
双夹心法测定抗体示意图
DASS法是将抗原或抗体交联到溴化氰活化的琼脂糖4B上,用于检测待测样本中的抗体或抗原含量。测定时,在试管内加入与抗原(或抗体)交联的琼脂糖珠和待测样本,室温下作用,离心除去上清液,用缓冲液洗涤底物珠2~3次,加酶标记抗体(或抗原)。室温孵育后离心、洗涤、加底物显色。由于固相载体为琼脂糖珠,整个免疫反应都在试管内完成,故又称为试管法。如果将固相载体置于涂布明胶的玻片上,所建立的方法则称为玻片法。为了便于分离免疫复合物与游离物,也可将磁性琼脂糖珠(magnogel,含7%氧化铁的聚丙烯酰胺-琼脂糖微珠)用5%戊二醛活化后与抗体或抗原结合,然后加入待测血清,再用酶标记抗体(或抗原)与之作用,形成双抗体(或抗原)夹心。由于magnogel中含Fe3O4,故洗涤时可用磁场将magnogel吸住后反复清洗(不需离心)。
液相酶免疫分析法(又称均相酶免疫分析法)
在这类方法中,抗原或半抗原、抗体和酶标记物等均游离于整个反应体系中(包括免疫反应和酶促反应)。结合物与游离物必须通过特定方法才能进行分离(如类似于液相RIA的双抗体离心分离法)。
常见的液相EIA有双抗体法(double antibody method)和均质法(homogeneous enzyme immunoassay,HEIA)两种类型。
(1) 双抗体法:抗体和抗抗体的分子量较大,它们结合后形成分子量更大的免疫复合物,在离心力的作用下可以沉淀下来。当酶标记抗原与抗体结合后,可用抗抗体将其沉淀。相反,未与抗体结合的酶标记抗原因不能与抗抗体结合而不能沉淀(游离状态),从而将结合的酶标记物与游离的酶标记物分开(双抗体法)。该法不需要固相载体,因此不存在固相载体质量影响测定结果的问题。
(2) 均质法:将抗原(半抗原)、抗体和酶或酶标记物及底物混合在一起,反应结束后,即可直接测定结果(均质EIA或均相EIA,homogeneous phase EIA)。根据抗原与抗体反应动力学特点,可将均质法分为竞争性和非竞争性两类。根据标记物的特点又可将均质法分为三类,即标记抗原系统、标记抗体系统和配对酶双标记系统。在标记抗原系统中,抗原可与全酶(如酶放大EIA)、辅酶(辅酶循环EIA)或底物(底物标记荧光EIA)耦联,从而建立各种HEIA方法。在标记抗体系统中,抗体与酶分子耦联,使酶活性增强(酶增强EIA)、减弱甚至被抑制(标记抑制酶抑制EIA)。在配对酶系统中,通常需要两种配对酶。这些酶的催化活性受免疫反应的影响。
直接、间接酶免疫分析法
直接酶免疫分析法:检测体系与反应体系直接联系,中间不需任何环节。这类方法的特点是操作简便,特异性强,但灵敏度较差。
间接酶免疫分析法:在反应体系与检测体系之间,连接一个或多个中间体或连接桥,如非免疫识别系统、免疫识别系统等,以增强酶的相对含量或增强酶的比活性,这类方法的显著特点是灵敏度高,但精密度较差,而且需要制备中间体,故增加了测定成本并使方法变得烦琐。
酶催化反应效率高而特异性强
在EIA技术中使用的酶,无论是化学本质还是催化反应的基本特性都与其他生物酶类是基本相同的,它们通常与免疫识别物质(抗原或抗体)、非免疫识别物质(如IPA、亲和素等)或酶底物有机结合。酶促反应充当免疫反应化学定量的示踪物,酶与其特异性底物构成EIA的指示系统。
效率高
酶的催化作用特点之一是效率极高,可比一般催化剂高106~1010倍。当酶作用于特异的底物,使其变成复合物时,中间要经过一个生成过渡状态分子(酶底物复合物)的阶段,由于过渡状态分子含能量很高,极易释放能量转变成产物,所以酶促反应的速度与过渡状态分子的生成量成正比关系。通常使反应物变成过渡状态分子需要一定的能量(称活化能),如果活化能很高,则只有少数分子可以达到活化能,所以生成的产物很少,故反应速度慢。若在此过程中温度升高,可促进底物分子的运动,使生成过渡状态分子的数目增多,增加分子的有效碰撞机会,故能加速反应的进程。
特异性强
酶催化作用的另一特点是具有较高的特异性,即一种酶只作用于一类化合物(如过氧化物酶)或一定的化学键,以促进一定的化学变化,得到相应的产物。有些酶甚至具有绝对特异性,只能作用于一种专有底物,催化一种反应(如苹果酸脱氢酶)。
酶促反应的速度可用Michaelis-Menten方程(米-曼式方程)计算出来:
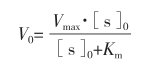
上式中,V0:初始反应速度;Vmax:最大反应速度;[s]0:底物初始浓度;Km:米氏常数。
当[s]0=Km时,V0=Vmax/2,即酶促反应达到最大反应速度的一半。从米-曼式方程可以看出,当[s]0远大于Km时,V0=Vmax,即底物浓度过量时,反应速度达到最大。但在实际工作中,底物过量的程度要注意如下3个因素:①底物对酶是否有抑制作用;②底物的成本和来源;③底物的溶解度。通常底物的用量为100Km,若底物用量不足,则酶促反应有可能朝逆反应方向进行,从而影响产物的生成速度。
酶活性抑制分为不可逆性和可逆性抑制两类
不可逆性抑制
与酶活性中心的必须基团结合,使酶分子中一个或多个功能基团遭到破坏或改变(如有机磷化合物能与多种酶活性中心的丝氨酸残基的OH-结合,使之失去活性,重金属离子能与酶活性上半胱氨酸残基的巯基结合而抑制酶活性)。这种结合不能借助稀释或透析等简单方法而解除。所以酶标记物的制备、提纯以及酶促反应过程中,应避免污染这一类抑制剂。
可逆性抑制
又可分为竞争性、非竞争性、反竞争性和混合性抑制四类:
- 竞争性抑制在EIA中比较常见,抑制剂与酶可逆性结合生成酶-抑制剂复合物,其结合部位和酶与底物的结合部位相同,通常可通过增加底物浓度而使抑制作用减弱,即抑制作用的强弱取决于抑制剂的浓度与底物浓度的相对比例。
- 非竞争性抑制可能是抑制剂在酶分子上的结合部位与结合底物的部位不同,对酶促反应的Km值没有影响,但可改变Vmax。因此不能通过增加底物浓度而使反应逆转。
- 反竞争性抑制其抑制剂虽不能与游离酶结合,但可与酶-底物复合物结合,从而使酶促反应的Km和Vmax同时以同样的比率降低。
- 混合性抑制作用是指酶促反应中同时发生竞争性和反竞争性的两种抑制作用,同时使酶促反应的Vmax和Km值按不同的比例变化。
控制酶促反应影响因素是提高测定质量的关键
酶的化学本质是蛋白质,极易受外界条件的影响而改变其构象和性质,因而其催化活性必然会受到影响。温度、缓冲液成分和pH以及其他易导致蛋白质变性的因素,都对酶促反应速度有影响。
温度
在一定温度范围内(0~40℃),酶促反应速度随温度的升高而加快。但酶是蛋白质,随着温度的继续升高和时间的延长,蛋白质的变性速度加快,从而使反应速度减慢或使酶完全失去活性。在酶促反应中,提高温度使反应速度加快与使酶失活这两个相反的影响是同时存在的。在温度较低时,前一影响较大,反应速度随温度上升而加快;当温度继续上升时,则酶蛋白变性这一因素逐渐成为矛盾的主要方面。因此,随着活性酶的数量的减少,反应速度也减慢。只有在最适反应温度时,酶促反应速度才达到最大。通常测定酶的催化活性都在最适温度条件下进行。但是,最适温度与反应所需要的时间和反应体系的pH值有关。反应时间短时,酶的最适温度可以适当提高。反应体系的pH也可改变酶促反应的最适温度。如碱性磷酸酶反应体系pH分别为10.3、10.1和9.9时,对应的最适温度分别为25℃、30℃和37℃。
pH
酶蛋白具有许多极性基团,在不同的酸碱环境中,这些基团的游离状态不同,所带电荷也不同。酶分子处于一定的游离状态下,酶与底物结合。其原因是:
- pH过高或过低,将影响酶蛋白的构象甚至使酶活性失活;
- pH影响复合物的离解状态,从而使酶活性降低;
- pH影响酶分子中的另一些基团的离解,这些基团的离子比状态与酶的专一性及活性部位的构象有关。
另外,一些酶的辅酶或底物也具有离子特性,pH的变化也影响它们的游离状态,同样可影响与酶的结合。只有在最适pH范围内酶促反应速度才能表现最大。各种酶的最适pH不同,但多数是在中性、弱酸性或弱碱性范围内。
正如最适温度一样,酶的最适pH也不是一个特有的常数,它受许多因素的影响,如酶的纯度、酶的固相法(固相EIA)、底物种类和浓度、缓冲液成分和离子强度、反应温度等因素的影响。因此在建立EIA方法时,最好对酶促反应条件(包括最适温度、最适pH值和最适反应时间)进行选择。
缓冲液的成分和离子强度
缓冲液成分可从下列两个方面影响酶促反应:
- 不同的酶对缓冲液成分的要求不同。一些酶要求缓冲液中含二价离子,而另一些酶(如碱性磷酸酶)则要求缓冲液不含二价离子。一些缓冲液(磷酸盐缓冲液)甚至对某些酶(如碱性磷酸酶)有抑制作用。
- 不同的酶底物和生色源(或供氢体)对缓冲液成分也有要求。如辣根过氧化物酶对H2O2的作用,如果生色源为邻苯二胺,则宜用磷酸氢二钠和枸橼酸组成的缓冲液;如果用四甲基联苯胺作生色源,则须用乙酸钠和枸橼酸配制缓冲液。
缓冲液的离子强度(即浓度)对酶促反应也有影响。离子强度过低,势必降低缓冲液的缓冲容量;相反,离子强度过高,则能改变酶的表面活力和介电常数,从而影响酶的结构和活性。EIA中底物缓冲液的配制浓度一般为0.1~0.2mol/L。
其他工作条件
酶免疫分析的固相载体不能直接应用液相酶免疫分析的工作条件。在固相EIA中,常将抗原(或半抗原-蛋白质耦联物)或抗体通过物理或化学作用包被在固相载体上,酶标记物则通过免疫反应使酶转变成不溶于水但仍保留酶活力的衍生物。在催化反应中,它以固相状态作用于底物,而不同于以液相状态作用于底物的酶促反应。固相的直接接触成分影响酶的活性,因为固相酶与液相底物之间有可能被一层膜(厚度约1μm,相当于蛋白质分子平均直径的100倍)隔离,使酶促反应的最适pH和最适温度发生偏移。
酶的固相化有可能使酶分子结构发生变化,导致部分酶失活,从而影响催化能力和Km。如变构酶可因固相化而使变构活化的能力降低。此外,固相酶也可因为空间屏障作用而使酶与底物或效应物的结合能力减弱,降低酶的催化活性。某些固相载体本身直接影响酶活性,如聚苯乙烯材料易使辣根过氧化物酶失活。酶固相化后,蛋白质分子的空间构型(特别是活性部位的构型)发生变化,影响抑制剂对酶的作用。同时,载体的存在也会产生空间位阻效应,阻碍抑制剂接近酶分子。因此抑制剂对固相酶的抑制作用主要取决于抑制剂离子和载体聚合物离子的性质,载体上的离子对同电荷抑制剂有排斥作用,而对异电荷抑制剂有吸引作用。微环境对固相酶作用产物扩散的约束和限制也对抑制剂的抑制作用有影响。底物浓度很高时(无扩散限制)引起的抑制作用与液相酶类似。由于对产物的抑制作用不能迅速扩散,所以抑制剂对固相酶的抑制作用比对液相酶大。使用碱性磷酸酶作为标记物时,抑制作用特别明显。但是,底物的抑制作用(如H2O2对过氧化物酶的抑制)可因扩散的限制而减弱。
在固相EIA中,提高底物浓度(与液相EIA比较)可以抵消一部分扩散的限制,从而提高酶的催化活性。由于固相对酶的催化活性有影响,所以液相EIA的工作条件不能直接用于固相EIA。
酶及其底物系统
适用于EIA中使用的酶,必须满足下列条件:
- 纯度高,催化反应不仅专一性强,而且转化效率高。
- 酶对底物的Km值较低,但对产物的Km值较高,使酶促反应永远朝正方向进行。
- Ki或KI值均高,不易受酶抑制剂的抑制。
- 分子中含有足够的耦联用标记基团,用各种化学的或免疫学的方法与半抗原、抗原、抗体蛋白分子耦联处理后,仍保持较高的催化活性。
- 酶和底物的使用稳定性和保存稳定性均好。
- 酶活性测定方法简便、快速、灵敏。
- 样本中无内源酶或干扰物质。
- 酶和底物的来源、纯化(制备)和供应均较方便,价格亦较低廉。
- 用于固相EIA中的酶,要求受固相固定化作用的影响较小。
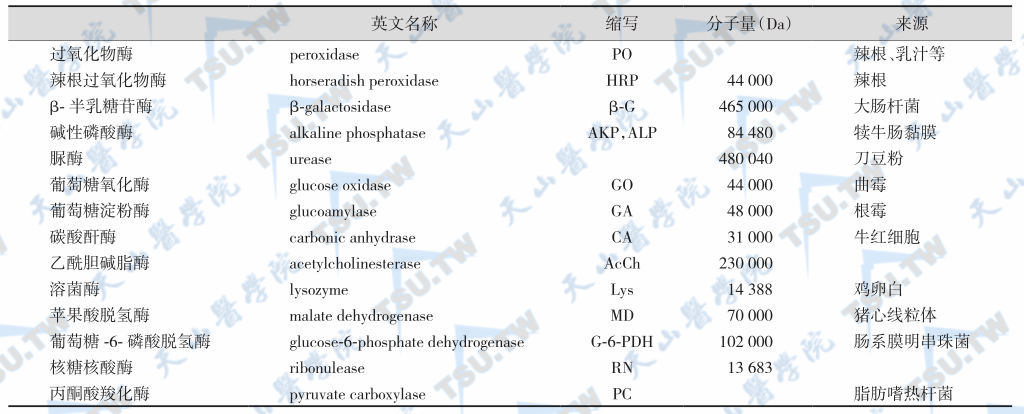
用于均相EIA中的酶,还要求当抗体与酶标记物结合后,酶的活性表现出抑制或激活作用。⑩酶活性与EIA测定条件(pH、离子强度、缓冲液成分等)相适应。目前使用的酶只能基本符合上述要求(如下表)。
EIA中常用的酶
酶免疫分析用于临床检验
酶免疫分析技术除用于抗原、抗体(包括自身抗体)的测量外,还可测定激素、激素转运蛋白、葡萄糖转运蛋白(GLUT)或细胞膜蛋白等,其中ELISA是常用测定方法之一,对于小分子物质一般使用竞争抑制法。但不论用哪种方法(包括ELISA)都要涉及细胞膜亚组分的分离问题。其优点是本法有较高的特异性和敏感性,方法简便、快速,无放射污染。但和其他常规测定技术一样,EIA这种依靠比色法或偏振光法的检测技术所受的干扰因素太多,在测定一些激素方面仍存在着非特异性干扰因素较多、敏感性尚不很高等缺点,其灵敏度和稳定性未能高于RIA,不能完全取代RIA。
酶免疫组织化学技术主要用于自身抗体的定位诊断,尤其常用于免疫组织化学及细胞的自身抗原定位。用制备性抗体还可定位一些酶类,并可测定酶的活性。例如,5α-还原酶有1型和2型两种,它们分布的部位不同,即使在皮肤毛囊中,其分布也不相同,1型5α-还原酶主要定位于皮脂腺内,主要调节皮脂的生成量,用1型5α-还原酶的特异性抑制剂可治疗痤疮。Thiboutot等发现,1型5α-还原酶抗体主要定位于皮脂腺内,而2型抗体主要定位于毛囊根底部。因而酶免疫定位是确定同工酶的作用部位与特异性的极好方法。又如,α-雌激素受体(ERα)的表达量是估计乳腺癌激素治疗预后的最好指标。在一般情况下,可用EIA来测定ERα,但很难测出微量的ERα,而免疫组织化学分析(immunohistochemical assay,IHC)可探测微量组织标本的ERα。Kobayashi等用五种不同的雌激素受体抗体(ID5、C-314、G-20、C-311和HC-20),分别与不同的受体序列结合,比较EIA和IHC两种方法的敏感性和特异性,发现EIA的阳性率为68%,而不同抗体测定的IHC阳性率为44.3%~77.3%,提示用针对受体特殊序列的特异性抗体测定或定位激素受体,IHC要明显优于EIA,用酶免疫组织化学技术对大鼠睾丸体细胞中的磷酸二酯酶5进行定位。
斑点免疫技术的应用范围极广,除了病原体抗原和抗体的检测、血浆蛋白的测定以及药品监测和吸毒者的鉴定外,主要用于早孕的诊断等。
