时间分辨荧光免疫分析(time-resolved fluoroimmunoassay,TRFIA),又称解离-增强-镧系荧光免疫分析(dissociationenhanced-lanthanide fluoroimmunoassay,DELFIA),其主要特点是所用示踪物采用镧系元素(如铕的三价离子Eu3+)或其螯合物对抗体或抗原进行标记,代替传统使用的放射性核素、酶、大分子荧光底物和发光底物,时间分辨荧光计特定的延迟时间,待血清、容器、样品管和其他成分的短半衰期荧光衰变后再测量样本浓度,这时就只存在Eu3+标记物的特异性荧光,即通过时间分辨,能够完全消除各种非特异性荧光物质的干扰,最大限度地提高了荧光信号测量的特异性和检测方法的灵敏度。加上镧系荧光的发射光波峰窄,进一步降低了本底。此外,单位分子的镧系粒子所释放的荧光信号远远超过125I原子所释放的信号,所检测的灵敏度超过了RIA,实现了分析方法灵敏度的突破,最低检测限可达10-19mol/L。加之标记物体积很小(为原子标记),标记后不会影响被标记物的空间立体结构,这既保证了被检测物质的稳定性(尤其对蛋白质的影响更小),又可实现多位点标记。
标记物的稳定性好,可长期保存,无环境污染等优点,可以对标记物进行多次激发,通过对每次激发的荧光信号累加后取平均值的办法,就可大大提高检测的准确度;多位点标记技术使检测更灵敏,一个试剂盒能够同时检测出2种或2种以上的项目。此外,TRFIA还有操作方法简便,标记物制备容易等优点。TRFIA技术按其待测物的不同,可分为双位点夹心法和竞争法两种;前者又称为时间分辨免疫荧光测量法(time-resolved immunofluorometric assay,TRIFMA)。双位点夹心法只限于蛋白质、酶和蛋白类激素、病原微生物抗原或抗体等大分子化合物的检测。竞争法主要用于小分子半抗原类化合物的测定。两者共同的测量原理是Eu3+示踪物的时间分辨荧光测量,不同之点是免疫反应模式。
Eu3+荧光测量使荧光效力显著增强
Eu3+不能直接连接至蛋白质分子上,需要一个具有多羧基的双功能基团的螯合剂起桥联作用,螯合剂一端与Eu3+连接,另一端与抗原或抗体分子上的酪氨酸或组氨酸的氨基连接。用于标记的螯合剂有异硫氰酸苯基-EDTA、异硫氰酸苯甲基-DTTA、P-异硫氰基苄基-DTTA、二乙烯三胺五醋酸氨基苯基-EDTA等。Eu3+螯合物在水溶液中很容易和抗体IgG或半抗原-蛋白结合物中的氨基以共轭双键相结合,制成Eu标记物。抗体与待测抗原反应后生成免疫复合物,但这种复合物在水中的荧光强度很弱,需要加入一种荧光增强液,使复合物中的Eu3+解离出来。自由的Eu3+被增强液中的另一种螯合剂(β-二酮体)所螯合,在协同剂等其他成分的作用下,形成一个Eu3+在其内部,通常增强荧光的效力可达100万倍。这是本法超灵敏度的主要原因。因为这种分析系统使用了解离增强步骤,所以称为DELFIA。
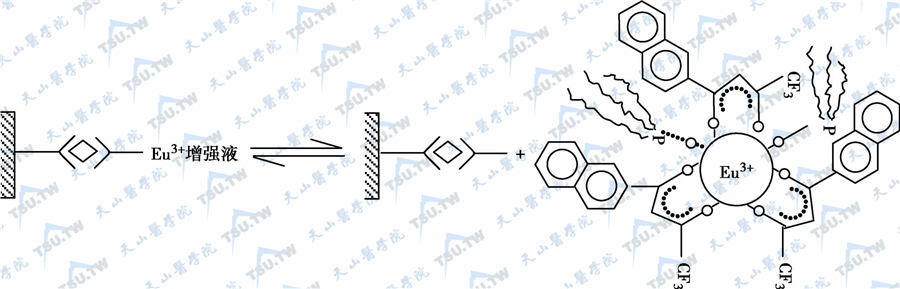
Eu3+螯合剂荧光生成示意图
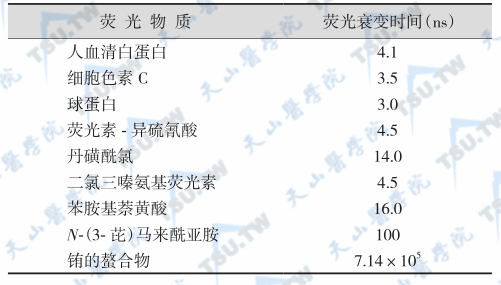
在TRFIA技术中,供标记用的主要是Eu3+,其次是Sm3+。它们的螯合物经紫外光激发不仅发出的荧光强度高,而且荧光衰变的时间也长,Eu3+和Sm3+的荧光衰变时间分别为7.14×105纳秒(nanosecond,ns)和4.1×104纳秒。而样品或试剂中的蛋白质类,以及最常用的荧光素的自然本底荧光的衰变时间仅为1~10纳秒。
部分荧光体和蛋白质的荧光衰变时间
自然本底荧光和镧系离子螯合物的荧光的衰变相差4~5个数量级。如此大的差距,在专用时间分辨荧光计上,利用延迟测量时间,待短半衰期荧光完全衰变后,所测信号完全是Eu3+螯合物的特异性荧光(下图)。
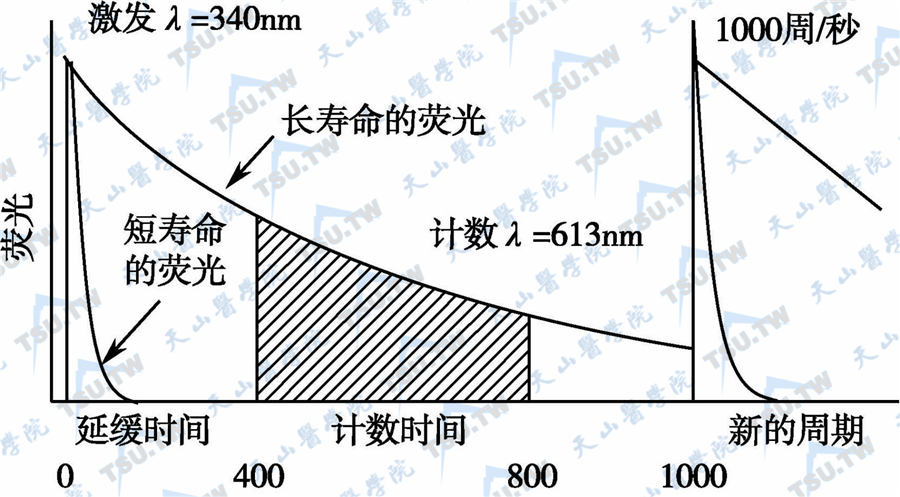
Eu3+时间分辨荧光测量示意图
此外,Eu3+螯合物另一荧光特征是斯脱克斯(Stokes)位移大,即激发光为337.1nm,发射光为613nm,峰位移达270nm。而且此荧光的发射光谱峰波长范围又很窄,小于10nm(下图),故所测荧光均为Eu3+特异荧光信号。
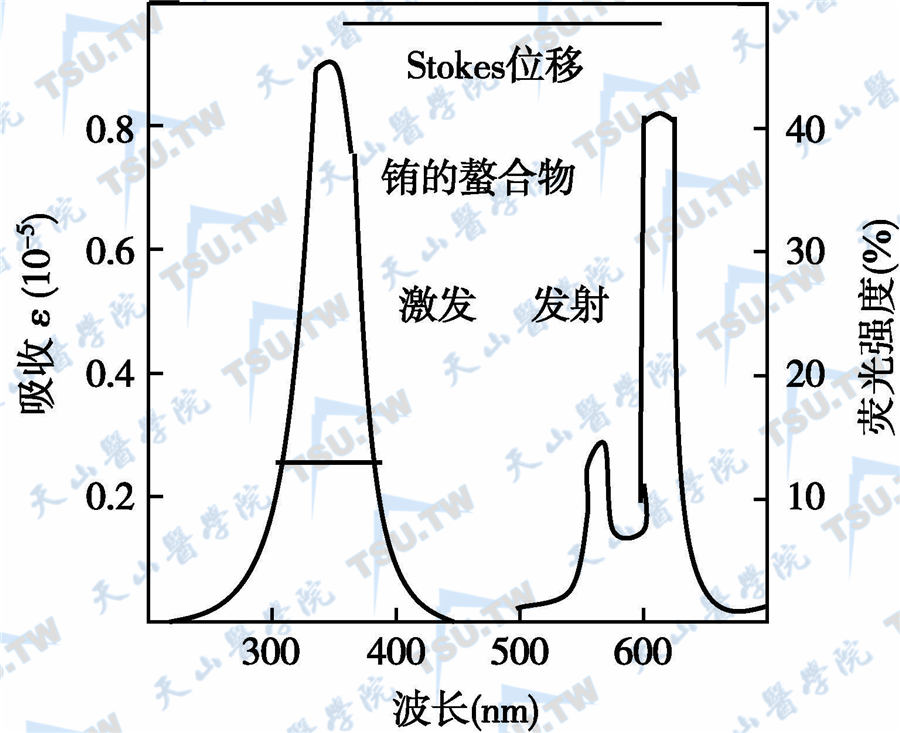
Eu3+荧光激发光谱与发射光谱
时间分辨荧光免疫技术分为双位点夹心/四层夹心/固相抗体竞争/固相抗原竞争或顺序结合等类型
双位点夹心法
标准品或待测物先和固相抗体反应,洗涤后再加入Eu3+标记抗体,再次温育,生成Eu3+标记抗体-抗原-固相抗体复合物。充分洗涤后加入增强液,最后测荧光强度,反应原理如下图。所测量的荧光强度和待测物的浓度成正比。
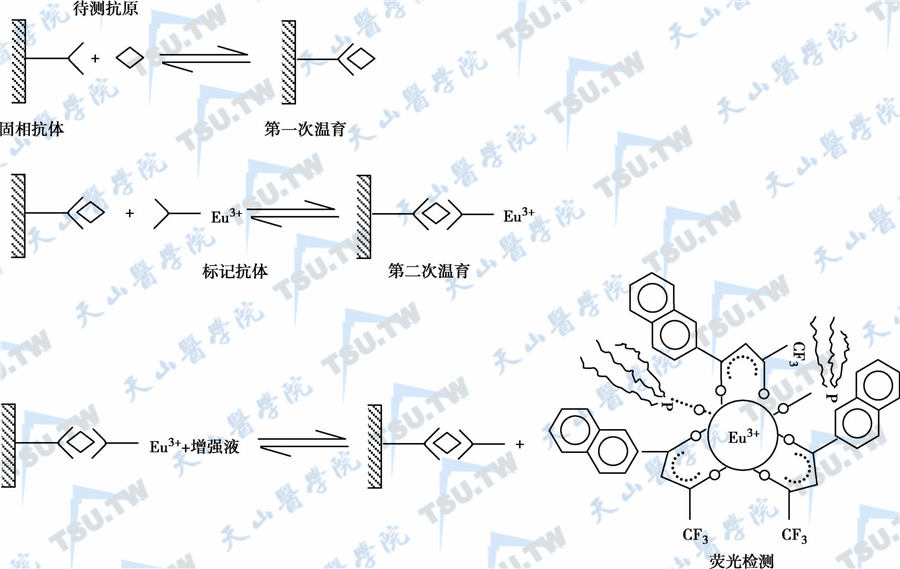
双位点夹心法反应原理示意图
四层夹心法
该法是在双位点夹心法基础上的新技术。待测物先和固相抗体反应,洗涤后再和生物素化抗体(Ab-B)反应,最后加入Eu3+标记链亲和素(SA-Eu3+),生成四层夹心复合物。充分洗涤后加入增强液,测量荧光强度。反应原理与双位点夹心法基本相似。此方法的主要优点是生物素化抗体容易制备,稳定性好。
固相抗体竞争法
该法是最初建立的测定甲状腺激素、甾体激素等半抗原小分子化合物的竞争性TRFIA技术,多采用第一抗体固相法。近年来为了试剂盒生产上的方便,主要以包被第二抗体固相法所取代,其优点是固相二抗适用于多指标的检测。这种固相二抗实际上是一种通用分离剂,分离Eu3+标记物和Eu3+-抗原-抗体复合物。其反应原理如下图。测量荧光强度和待测样品中的激素浓度成反比。
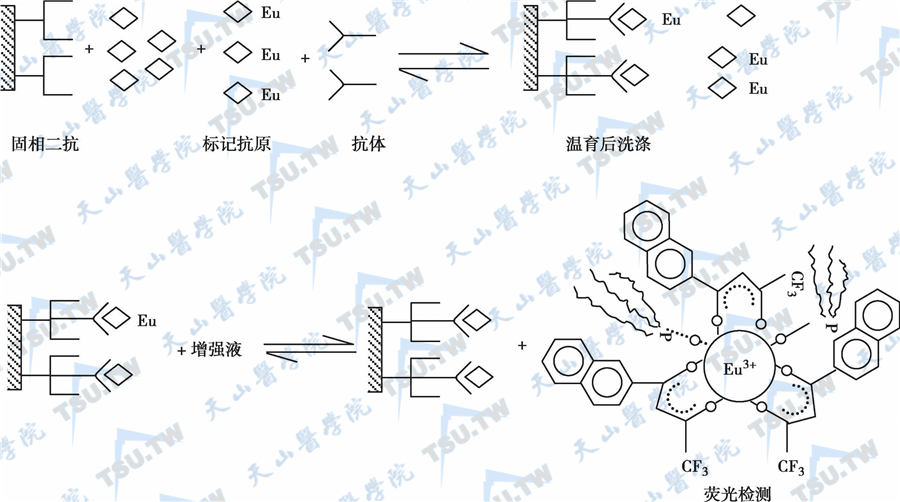
固相二抗竞争法反应原理示意图
固相抗原竞争法
小分子半抗原化合物不能直接包被于固相载体,必须经化学耦联法以共价键与牛血清白蛋白或其他蛋白载体相结合,制成半抗原-蛋白质结合物,方可包被微量滴定孔,制成固相抗原。其测定原理是固相抗原和样品中的待测物共同竞争限量的Eu3+标记抗体,样品中的待测物越多,则Eu3+标记体结合到固相上的量越少,故待测物测定和荧光强度成反比。反应原理如下图。
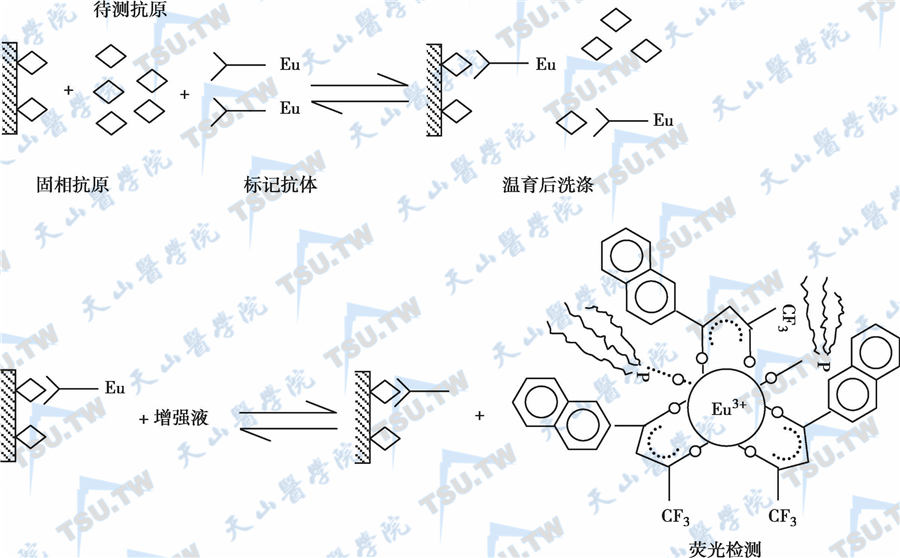
固相抗原竞争法反应原理示意图
顺序结合法
又称为反相滴定法,实际上和放射免疫分析法中“非平衡法”的基本操作程序及反应原理完全相同。其主要目的在于进一步提高方法的灵敏度,以适应样品中低浓度物质的测定。以测血清FT4为例,先以纯化抗IgG包被微量滴定条(板),制成固相二抗,将标准液或血清样品和抗T4单抗(鼠抗T4)加至固相二抗孔中,温育后洗涤,然后加入Eu3+标记T4衍生物。Eu3+标记T4与剩余单抗结合位点结合,反应过程如下图。
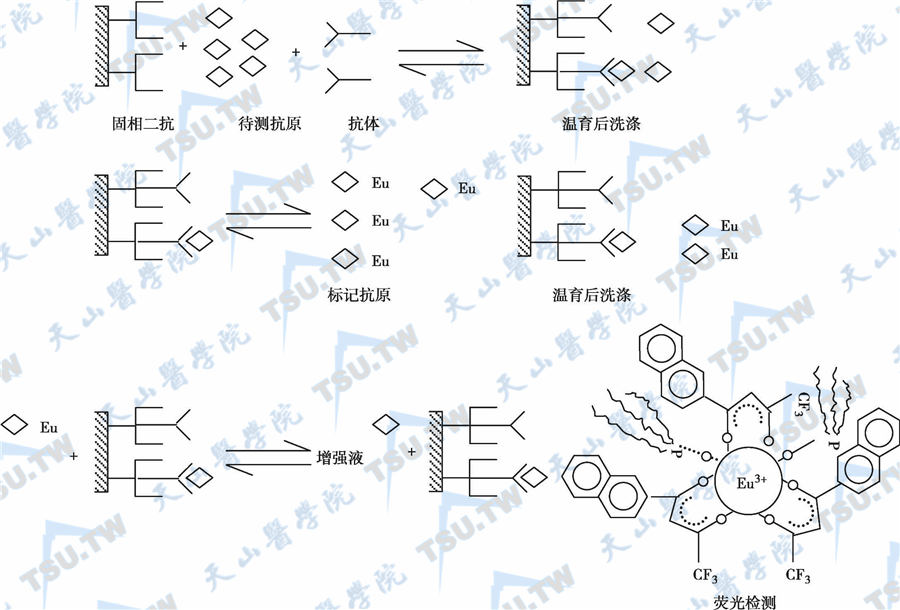
顺序结合法反应原理示意图
时间分辨免疫荧光实现测量自动化
TRFIA技术的特点之一是用一种专一的消除自然本底荧光干扰的时间分辨荧光测量仪。仪器装有自动数据处理系统,根据设计的检测项目、标准液浓度范围可以自行编制数据处理程序。只要将标准品及样品放至架上,便可以自动测量。同时绘出标准曲线和给出待测样品浓度。双位点夹心法(TRIFMA)以荧光强度(CPS)为纵坐标,标准液浓度为横坐标绘出标准曲线并计算出CV%(下图)。
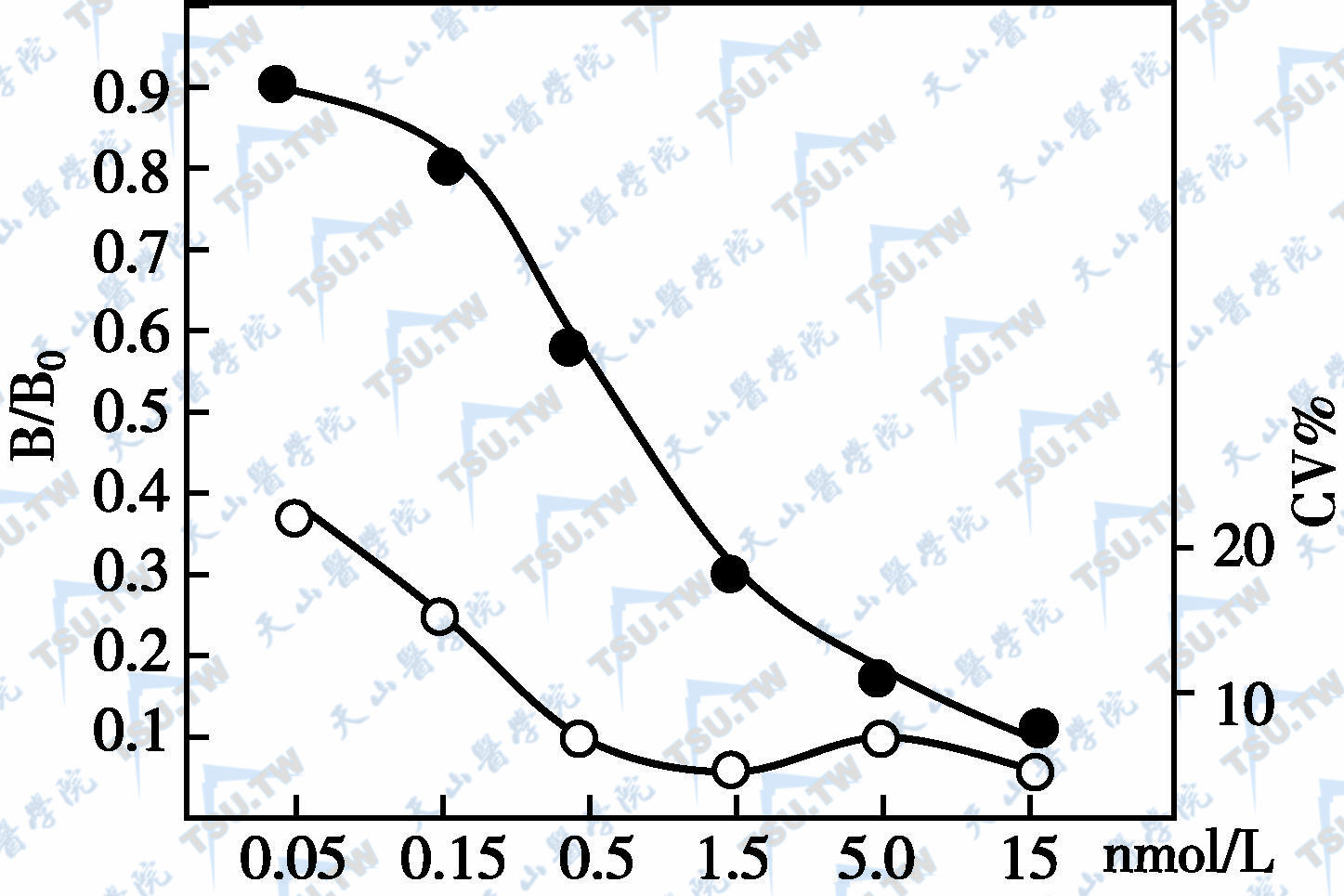
双位点夹心法的标准曲线
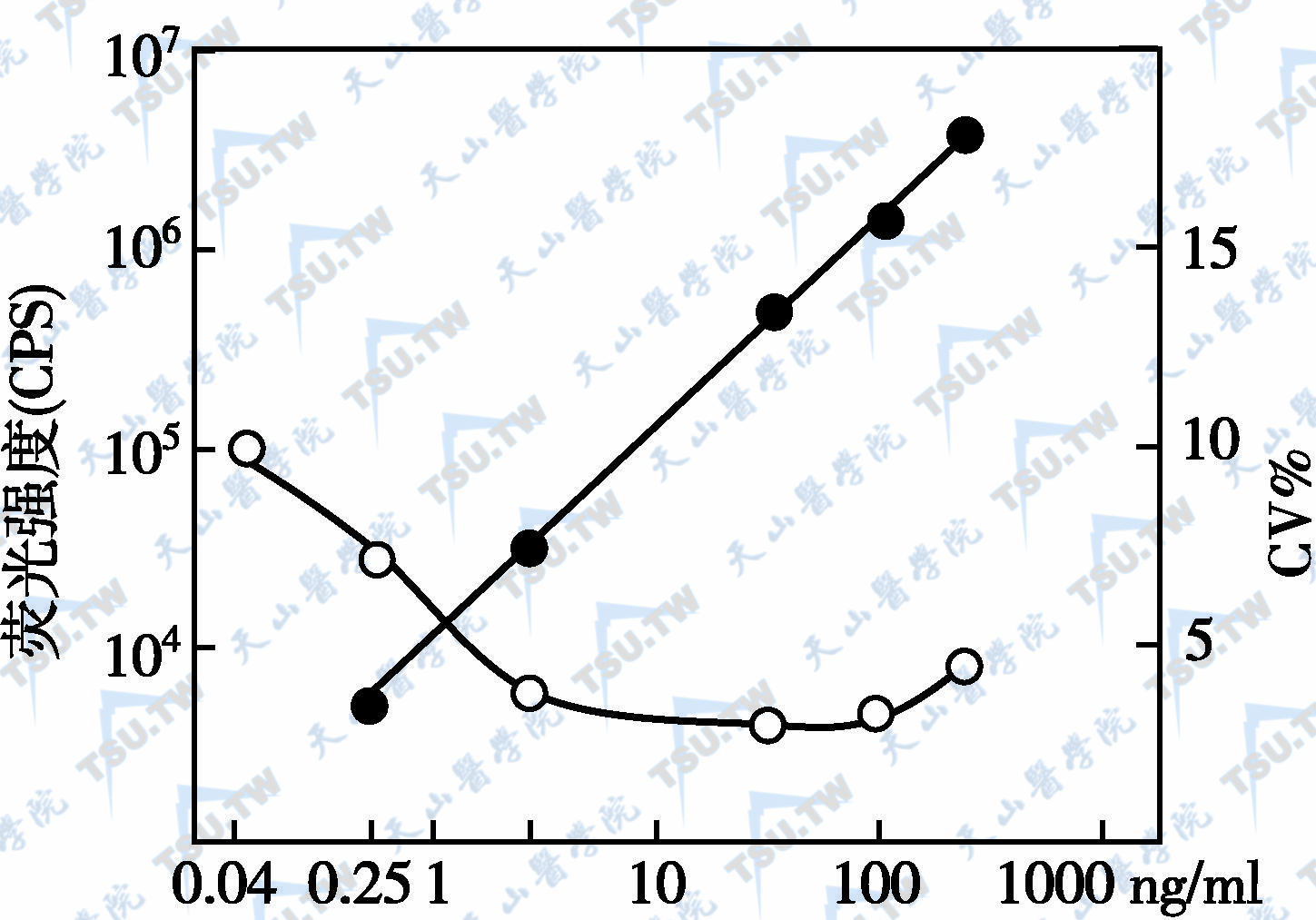
半抗原测定竞争法标准曲线
测定半抗原的竞争法,则以标准零管的最大结合为B0,标准管的结合为B,以B/B0为纵坐标,标准液浓度为横坐标,绘出标准曲线并计算出CV%(上图)。
