HIV的免疫损伤主要表现在:①CD4+T淋巴细胞数量进行性减少;②CD4+T淋巴细胞功能受损;③免疫系统的异常激活。现分述如下:
CD4+T淋巴细胞数量进行性减少
在正常人,CD4+T细胞占淋巴细胞总数的42% (38%~46%),数量约为0. 8×109/L[(0. 7~1. 1)× 109/L]。对于一名健康成年人,体内CD4+T细胞总数大约为2×1011个,其中98%存在于淋巴组织内,仅2%存在于外周血,两部分间通过机体循环系统保持交换并维持细胞数量的动态平衡。根据细胞功能、细胞表面抗原分子表达及是否接受过抗原刺激,CD4+T细胞又可分为两个亚群:未接触过特异抗原刺激的纯真CD4+T细胞(naive CD4+T,表达CD45RA及CD62L分子)和记忆CD4+T细胞(表达CD45RO分子)。在健康青壮年人,两个亚群约各占CD4+T细胞的50%。纯真CD4+T细胞经特异抗原刺激可变为记忆CD4+T细胞,前者的生命周期为3年,而后者平均为6个月。因生理原因(如细胞的自然衰老)人体每天失去的CD4+T细胞数量约0. 8× 109个,但同时通过胸腺记忆CD4+T细胞自身的增殖产生同样数量的CD4+T细胞,维持着CD4+T细胞数量的动态平衡。
HIV感染后机体CD4+T细胞数量进行性减少,这种改变有一定规律性(下图):第一期,以CD4+ T细胞数量短期内一过性迅速减少为特点,见于急性感染期,大多数感染者未经特殊治疗,CD4+T细胞数可自行恢复至正常水平或接近正常水平。此期持续时间一般不超过1年。需要注意的是,有约2%的感染者,此期内CD4+T细胞数减少较明显,且进行性减少,在1~2年进展至艾滋病期。第二期以CD4+T细胞数量持续缓慢减少为特点,见于临床的无症状期,CD4+T淋巴细胞数多在(0. 8~0. 35)× 109/L之间。此期持续时间变化较大(数月至十数年不等),但大多数人持续约8年左右,每年减少约0. 05×109/L CD4+T淋巴细胞。第三期对应于艾滋病前期,CD4+T细胞数较快速的减少,持续约2年左右,多数感染者CD4+T细胞数在(0. 35~0. 2)× 109/L之间。第四期,对应于临床的艾滋病期:CD4+ T细胞数再次快速减少,如缺乏有效的抗病毒治疗,CD4+T细胞数在数月或1~2年内减少至0。
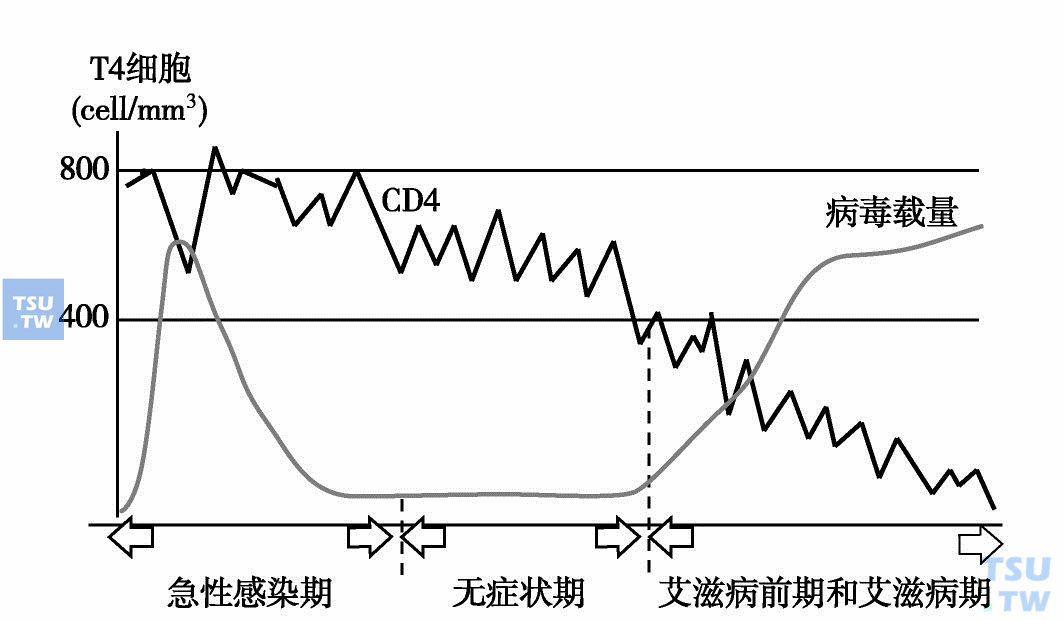
HIV感染时CD4细胞的减少规律
根据无症状期时间的长短可将HIV感染者分为三类:一类患者被称为快速进展者(rapid progressors),他们在感染后2~3年内出现CD4+T细胞数量的急剧下降并快速进展到艾滋病期,约占2%。对于这类患者,即使在急性感染期过后,其病毒载量仍保持较高的水平。另两类患者分别被称之为普通进展者(typical progressors)和长期不进展者(longterm nonprogressors,LTNP)。前者在感染后的8~10年里,CD4+T细胞数量将逐渐下降并伴随着病毒载量的升高,占HIV感染者的大多数。而后者则可长期(至少8~12年以上)维持病毒载量在较低水平,并保持CD4+T细胞数量在正常水平,LTNP约占HIV感染者中的8%~10%。研究人员认为对这类人群自身免疫系统如何有效控制病毒复制和延缓疾病进展的研究,将对HIV疫苗研制和HIV感染的控制有强烈的提示意义。
CD4+T细胞数量减少的机制至今尚未完全明确。多数学者认为HIV感染过程中CD4+T细胞数量的减少是多种因素综合作用的结果,至少与以下几个因素有关:
1. CD4+T细胞破坏增加:有人认为HIV直接(病毒引起靶细胞病变)或间接(通过CTL,细胞凋亡)杀死CD4+T细胞是导致其减少的主要原因。因为未经治疗的HIV感染者每天体内产生约1×109个HIV拷贝,可能导致了同等数量的CD4+T细胞死亡,从而使CD4+T淋巴细胞数量减少。此外,体外研究已证实HIV可引起CD4+细胞株死亡。近年来一个新的重要发现是HIV感染者肠道CD4+T细胞显著减少,被认为是其免疫损伤的主要机制之一。
2. CD4+T细胞产生减少:有人认为HIV侵犯了胸腺细胞,使纯真CD4+T细胞的产生减少,导致了CD4+T细胞数量下降。支持该假说的依据是:HIV确能感染胸腺细胞;HIV感染进程中,纯真CD4+T细胞的减少先于记忆CD4+T细胞;HIV母婴垂直感染的患儿疾病进展较成年人快;HIV感染者或艾滋病病人,其胸腺的大小与CD4+T细胞数(尤其是纯真CD4+T细胞数)有密切相关性。
3.淋巴组织扣留外周血的CD4+T淋巴细胞近年来有人提出了另一种新的假说:HIV感染过程中CD4+T细胞的减少,主要是外周血的CD4+T细胞滞留于淋巴组织,即淋巴组织扣留了外周血的CD4+ T淋巴细胞所致。由于正常人体内98%的CD4+T淋巴细胞存在于淋巴组织内,仅2%存在于外周血,这种比例发生微小变化,都能导致外周血CD4+T细胞数较大的改变。
4. CD4+T细胞凋亡增加:细胞凋亡(apoptosis)或者称为程序化细胞死亡(programmed cell death,PCD)是一种基因控制的细胞自我破坏过程,以细胞皱缩、膜缺失、染色体凝集和核内DNA断裂为特征,它是机体清除衰老和自身免疫反应细胞的一种机制。HIV可以通过多种机制促使未感染细胞凋亡,破坏免疫系统。
综上所述,HIV感染过程中CD4+T淋巴细胞数量的减少的机制仍不确定,可能由于破坏增加、产生减少和外周血的CD4+T淋巴细胞滞留于淋巴组织等综合因素所致。但比较明确的是,血浆HIV病毒载量与CD4+T淋巴细胞数量的减少有非常重要的关系,即血浆HIV载量越高,CD4+T细胞数量的减少越快。
CD4+T淋巴细胞功能受损
HIV感染的另外一个主要免疫病理改变是CD4+T细胞免疫功能的缺失,包括白细胞介素-2 (IL-2)产生的减少和丧失对特异性抗原(如结核菌抗原和巨细胞病毒抗原等)的反应活化能力,这也是HIV感染者易产生各种感染的主要原因。这种CD4+T细胞辅助功能的不足在HIV感染早期即可出现。研究表明,即使CD4+T细胞数量在正常或接近正常范围时,其细胞免疫功能已开始失去。其变化规律是:先失去对HIV抗原的反应能力(如对HIV p24抗原),大部分感染者在原发感染期后已丧失了CD4+T细胞对HIV抗原的特异活化反应能力;大部分无症状HIV感染者,CD4+T淋巴细胞数尚在500/mm3左右时,也失去对其他特异性记忆抗原的反应能力(如结核菌素、巨细胞病毒抗原和破伤风毒素),IL-2的产生也较正常人减少;进入艾滋病期的患者,CD4+T细胞丧失了对所有刺激原的活化反应能力,包括对非特异性刺激(如植物血凝素、CD3/ CD28单克隆抗体、刀豆素)的反应能力。
关于CD4+T细胞功能受损的机制,由于CD4+T细胞免疫功能的损害在其数量还处于正常或接近正常范围时已开始发生,故不能单用CD4+T细胞绝对数量的减少来解释。可能与多种因素有关:1型T辅助细胞(Th1)和2型T辅助细胞(Th2)失衡;CD28表达下调;免疫耐受;抗原呈递细胞(APC)功能受损等。目前,CD4+T细胞的功能研究已越来越受到重视,尤其是HIV感染者和艾滋病病人经抗病毒治疗后的免疫功能评估,已成为艾滋病防治研究中的热点之一。
CD4+T细胞按细胞因子产生模式和生物功能可分为两种不同的亚群,Th1细胞分泌白细胞介素-2 (IL-2)和干扰素-γ(IFN-γ),Th2细胞分泌IL-4、IL-5、IL-6和IL-10。Th1细胞能有效地刺激介导细胞免疫,Th2细胞则刺激体液免疫。正常情况下,辅助性T淋巴细胞的Th1和Th2细胞亚群处于平衡状态。Clerici M和Shearer GM于1993年提出了Th1-Th2转换失衡假说,该假说认为Th1-Th2失衡是造成HIV感染后免疫功能障碍的重要因素。
T细胞活化需要双信号刺激,其一是T细胞受体(T cell receptor,TCR)与抗原肽:MHC分子结合所传递的抗原识别信号;此外,还需要T细胞的辅助刺激分子与其受体结合提供第二信号。而CD28分子是目前已知的T细胞最重要的第二信号受体,缺乏CD28的CD4+T细胞即使结合了抗原肽,MHC分子也不能被活化,呈“无能”(anergy)状态。多项研究表明,HIV/AIDS患者CD4+T细胞上CD28的表达明显下调,而且CD28表达比例与CD4+T细胞计数呈显著正相关,与血浆病毒载量呈显著负相关,即CD4+T细胞数量越低,血浆病毒载量越高,CD28表达下调越严重。
总之,HIV感染过程中,不仅有CD4+T细胞数量的变化,也有细胞免疫功能的损害。所以,单用CD4+T淋巴细胞绝对数量并不能全面衡量一个HIV感染病人的免疫功能。现在,研究CD4+T淋巴细胞的功能已越来越受到重视,尤其是HIV感染者经抗病毒治疗后的免疫功能评估。
异常的免疫激活
HIV感染人体后,病毒抗原的持续刺激使机体免疫系统处于异常增高的激活状态,CD4+T、CD8+T细胞表达CD69、CD38和HLA-DR等分子水平异常升高,且与血浆病毒载量有良好相关性。其原因可能是:一方面,细胞激活与病毒复制水平的升高可能是互相促进的,病毒复制速率加快,产生的病毒抗原也越多,可为T淋巴细胞激活提供更多的刺激信号;同时,T淋巴细胞的异常激活又为病毒复制提供更多的宿主细胞,促进病毒的复制。另一方面,激活的CD8+T细胞可以破坏被HIV感染的CD4+T细胞,引起CD4+T细胞计数的减少。近年来对HIV引起的激活水平增高进行了多项研究,使得人们对其在艾滋病发病机制中的作用有了新的认识。异常激活的产生原因可能有两种机制:其一是体内持续的大量抗原刺激;其二是机体加速产生T细胞以补偿CD4+ T细胞丢失导致的。
